天蚕素抗菌肽B在鱼类疾病控制中的应用
2020-09-07罗阳瑞代奉林黄红云樊汶樵姜玉松李晓英
罗阳瑞,王 晗,代奉林,黄红云,樊汶樵,姜玉松,李晓英
(重庆文理学院林学与生命科学学院 重庆文理学院水生动物疫病防控研究所,重庆 永川 402168)
抗菌肽是分子质量小、两亲性、带正电的非特异性物质[1-2],多为α螺旋结构,天蚕素是最早被发现的,目前研究最清晰,效果最显著的一类抗菌肽。早在1972年,瑞典科学家Boman等[3]从美国希古比天蚕蛹(Hyalophoracecropia)中获得抗菌肽,并将其命名为Cecropin;随后,Boman等测定了天蚕素抗菌肽A (Cecropin A) 和天蚕素抗菌肽B (Cecropin B)的一级结构[4]。目前,天蚕素抗菌肽家族已被分为A、B、C、D、E共5个成员,其中Cecropin B具有最高的抗菌活性[5-6]。
鱼类是较低等的脊椎动物,缺乏完善的免疫系统来抵抗微生物的侵袭,其皮肤、黏膜存在的免疫活性因子在主动防御中发挥着重要作用[7]。抗菌肽是鱼类自身先天免疫的重要组成成分,研究抗菌肽在鱼类中的应用,不仅为预防鱼类病害开辟新途径,还能拓展抗菌肽在渔业生产中潜在的应用领域。天蚕素抗菌肽B抗菌谱广,对多种细菌性疾病有很强抗性[8],对不同种类的病毒也有抵御作用,使其在水产行业有很好的应用前景。
1 Cecropin B的结构与作用机理
Cecropin B是最早从希古比天蚕中分离得到,由35个L-氨基酸残基组成的抗菌肽,其序列为KWKIFKKIEKVGRNIRNGIIKAGPAVAVLGEAKAL[9],分子量约4 kDa。Hu等[10]认为天蚕素抗菌肽B具有两亲性的α螺旋结构,N端形成亲水性的α螺旋结构,C端形成疏水性的α螺旋结构且酰胺化[11]。Srisailam等[12]用NMR(核磁共振)测定Cecropin B1的结构(图1),发现其N端碱性很强,带正电荷,亲水,富含赖氨酸(Lys)和精氨酸(Arg),N端氨基酸序列比C端对于其活性具有更重要的作用;如N端第2位上的色氨酸,因色氨酸上有苯环,会影响其活性;天蚕素抗菌肽B一般不含半胱氨酸(Cys),所以不能形成分子内的二硫键[11-13]。
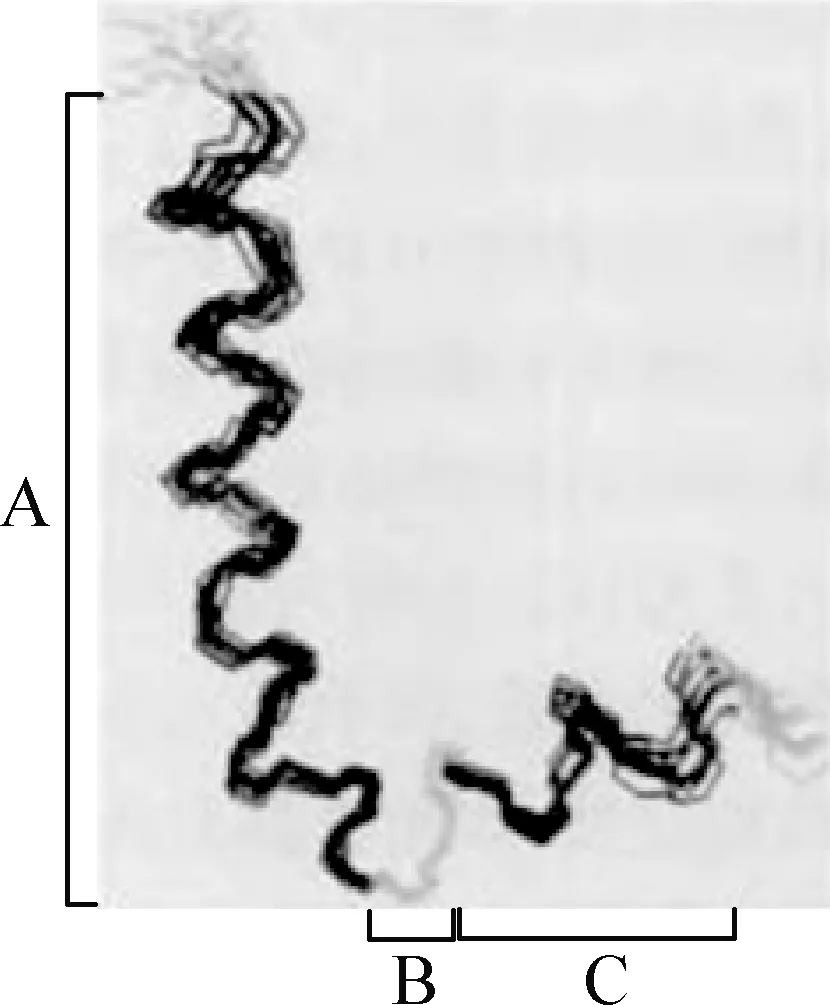
图1 Cecropin B1的结构示意图[12]A:N-末端α-螺旋; B:铰链区; C:C-末端α-螺旋
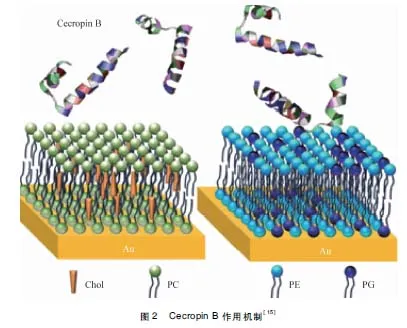
Cecropin B带正电,与细菌接触时通过静电作用,吸附于细菌表面,先破坏细菌细胞壁结构,使大量的Cecropin B选择性的堆积在细胞膜脂质表面,达到一定浓度时,因为其C端疏水性强,插入细菌胞膜,造成膜缺陷或形成“孔隙”,改变细胞通透性,使细菌内容物大量外流,最终导致细菌死亡[14-16]。其作用机制如中插彩版图2所示。
2 Cecropin B在细菌病中的应用
引起鱼类疾病的致病菌繁多,主要归属于气单胞菌属(Aeromonas)、假单胞菌属(Pseudomonas)、维氏气单胞菌(A.veronii)、杀鲑气单胞菌(A.salmonicida)、鳗弧菌(Vibrioanguillarum)等。气单胞菌会引起淡水鱼细菌性败血病、细菌性肠炎、疖疮等,假单胞菌属主要危害鲤鱼、草鱼等,能引起草鱼100%的死亡。Sarmasik A等[17]报道重组的Cecropin B和Cecropin P1单细胞克隆入大鳞大麻哈鱼(Oncorhynchustshawytscha)胚胎细胞中,表达出的杂合天蚕素抗菌肽对嗜水气单胞菌(A.hydrophila)、荧光假单胞菌(P.fluorescens)等病原菌有很强的抑菌效果;卢强等[18]将绿色荧光蛋白(GFP)基因与Cecropin B突变体ABP-S1基因进行融合表达,发现对铜绿假单胞菌(P.Aeruginosa)、嗜水气单胞菌等多种病原菌有抑菌效果;王自蕊等[19]向湘云鲫的鳍部注射0.5 mL嗜水气单胞菌活菌液后,发现添加Cecropin B组比对照组的存活率更高。林鑫等[20]在感染维氏气单胞菌的鱼类中添加Cecropin B,10 d后,锦鲤的累积死亡率显著降低;Kjuul等[21]研究发现,Cecropin B对鱼的杀鲑气单胞菌、鳗弧菌、鲑弧菌等多种病原菌都有抑制作用,还发现随着氯化钠盐浓度的升高,Cecropin B的活性会明显降低;Sallum等[22]用鳗弧菌、嗜盐弧菌(Vibriohalophilus)和耶尔森菌(Yersinia)感染青鳉鱼时,发现Cecropin B的表达量会持续升高,增强青鳉鱼的抵抗力,且这3种诱导产生的抗性与它们超微结构的可逆变化相关。Lin X等[23]将天蚕素抗菌肽加入到杂交罗非鱼日常饲料中,研究发现,与未添加相比,添加组在生长性能、非特异性免疫能力及对维氏气单胞菌的抗感染能力方面均有提高。Elaswad A[24]将Cecropin B的基因转移到鲶鱼鱼种中,用多毛鱼虱(Ichthyophthiriusmultifiliis)这种寄生虫去感染后,发现转基因鲶鱼存活率比普通鱼高;Bugg W[25]将Cecropin B的基因转移到斑点叉尾鮰(Ictaluruspunctatus)形成转基因鱼,用柱状黄杆菌(Flavobacteriumcolumnare)和爱德华菌(Edwardsiellaictaluri)去感染,发现转基因鱼存活率都要高于普通鱼。一系列的报道表明,Cecropin B在鱼类抗细菌感染中发挥着重要的作用。
3 Cecropin B在病毒病中的应用
病毒性疾病会严重危害鱼类的生长,甚至导致死亡。目前关于Cecropin B对鱼类病毒性疾病的研究较少。Lo J H等[26]发现合成肽Cecropin B和模拟Cecropin B结构的模拟肽CF17,能明显抑制感染性造血坏死病毒(IHNV)、病毒性出血性败血病病毒(VHSV)、蛇头棒病毒(SHRV)和感染性胰腺坏死病毒(IPNV)等重要鱼类病毒性病原对机体的侵袭。2014年,Chiou P P等[27]人工合成Cecropin B基因并构建CF-17转基因载体后,植入虹鳟鱼精子,随后用IHNV感染转基因与非转基因的虹鳟,发现CF-17转基因亲本鱼对IHNV的感染具有显著的抗性;Chia等[28]发现Cecropin B对致海洋鱼类在幼年期大规模死亡的神经坏死病毒(NNV)有较强的抑制作用。
4 展望
Cecropin B抗菌谱广,对鱼类多种细菌性病原体有不同程度的抑制或杀伤作用;鉴于天蚕素抗菌肽结构中没有二硫键,重组表达中不涉及二硫键的重构,且鲜有Cecropin B产生耐药性的报道,证实了Cecropin B成为新型抗生素替代品的潜力。然而从希古比天蚕蛹或其他动物中提取的Cecropin B含量很少,目前一般采取人工合成的方式获取该抗菌肽;但人工合成抗菌肽价格高昂还容易降解,影响了Cecropin B在生产中的广泛应用。在具体的研究中,针对重组Cecropin B外源蛋白表达量低、稳定性差等问题,研究者多将2个及以上的目的基因进行串联表达,取得了较好的进展[29]。随着基因重组和表达技术的不断进步,大量获得外源性Cecropin B逐渐成为现实,Cecropin B必将在实际生产中得到更为广泛的应用。