IL-33修饰的BMSCs通过MyD88减轻脓毒症所致大鼠急性肾损伤的疗效观察*
2020-09-07隗世波刘青云石雅娴
隗世波,刘青云 ,石雅娴
(武汉科技大学 1附属汉阳医院重症医学科,2职业危害识别与控制湖北省重点实验室,湖北武汉430050)
脓毒症是由感染引起的全身炎症反应综合征。全球每年脓毒症患者超过1 900 万例,其中600 万人死亡,而存活的患者大多数存在认知功能障碍[1]。脓毒症与多器官功能衰竭有关,急性肾损伤(acute kidney injury,AKI)是脓毒症患者常见的致死性并发症。据报道,临床上大约50%的AKI 是由脓毒症引起,患者的死亡率达50%~70%[2]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)具有免疫调节、促进组织再生修复和抗氧化应激损伤等功能,是近年来研究的热点[3]。既往大量研究证实,移植BMSCs 可以提高脓毒症AKI 大鼠的存活率[4-5]。然而,移植微环境会影响细胞的存活,并且可能限制其向靶器官分化,削弱了BMSCs 移植修复损伤组织和器官的能力,成为干细胞治疗中的一个重点和难点。
白细胞介素33(interleukin-33,IL-33)是IL-1 家族成员,因为具有抗炎作用而受到广泛关注。IL-33可以促进Th1细胞向Th2细胞转化,从而发挥抑制炎症反应的作用。研究显示,用IL-33基因修饰BMSCs可减少其凋亡,并影响T 细胞增殖和巨噬细胞计划,进而改善心梗后大鼠的心脏功能[6]。有研究表明,IL-33可以通过其受体ST2发挥减轻脓毒症和急性肾损伤的作用[7-9]。髓样分化因子88(myeloid differen‑tiation factor 88,MyD88)是IL-33 的靶分子,在脓毒症AKI 发病中有重要意义[10]。转基因治疗是通过基因修饰,用目的基因转染细胞并回输体内。本研究利用基因工程方法将IL-33转染入BMSCs,然后对脓毒症AKI 大鼠进行干预,检测治疗后肾组织中促炎细胞因子及MyD88的表达情况,旨在观察IL-33修饰的BMSCs治疗脓毒症AKI的效果。
材料和方法
1 实验动物
80 只SPF 级雄性SD 大鼠,购于北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2006-2009],6~8 周龄,体重约(250±20)g。允许大鼠自由摄食和饮食,饲养环境为温度22℃,湿度60%,明暗周期12 h/12 h。将大鼠随机分为对照(control)组、模型(model)组、阴性转染(negative transfection)组(移植未转染的BMSCs)和IL-33转染(IL-33transfec‑tion)组(移植转染IL-33的BMSCs),每组20只。
2 试剂和仪器
大鼠 BMSCs(Thermo Fisher Scientific);胎牛血清、DMEM 培养基、青霉素和链霉素(武汉华美公司);PCR 检测试剂盒(Sigma);TUNEL 细胞凋亡检测试剂盒(上海碧云天公司);IL-1β、IL-6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、Toll 样受体4(Toll-like receptor 4,TLR4)和MyD88 多克隆抗体(Bioworld)。CKX53 倒置相差显微镜(Olympus);AU680全自动生化仪(Beckman Coulter);ImageQuant LAS 4000成像系统(GE Healthcare)。
3 方法
3.1 BMSCs 的培养及鉴定 将100 mL 胎牛血清及10 mL 抗生素(青霉素和链霉素1∶1 混合液)加入1 L DMEM 培养基,混匀后稀释10 倍。吸取BMSCs 悬浮液加入培养液,37℃、5% CO2条件下培养,2 d 换液1次。待细胞融合80%时去除培养液,吸取贴壁细胞,用3%胰蛋白酶消化3 min。随后用含10%胎牛血清的低糖培养液终止消化,制备细胞悬液,接种于细胞培养瓶中,37℃、5% CO2条件下培养,经流式细胞术鉴定细胞表面标志物 CD34、CD45、CD29、CD73 和CD90。传代培养至第3 代的细胞可发出较强的荧光,用荧光显微镜观察传代细胞的形态。
3.2IL-33转染和RT-qPCR 检测 首先用PCR 技术扩增IL-33cDNA(上游引物序列为5'-GGAACAACA‑CAGCAAGCAAAGCCT-3',下游引物序列为5'-TA‑AGGCCAGAGCGGAGCTTCATAA-3';由苏州合惠生物科技有限公司设计并提供),随后构建IL-33慢病毒载体,在脂质体介导下与质粒共转染感受态大肠埃希菌 DH5α,用IL-33慢病毒感染第 3 代 BMSCs[11]。用 RT-qPCR 法检测转染后 BMSCs 中 IL-33 mRNA 的表达情况。用Trizol 法提取总RNA,逆转录后进行qPCR 检测。每个样本最少重复3 次,设置3 个复孔。反应条件为:预变性 95℃ 30 s;95℃ 5 s,60℃ 30 s,40 个循环。IL-33 的上游引物序列为5'-TTGGAGA‑ATGGATGTTACGTG-3',下游引物序列为5'-ACCAT‑CAGCTTCTTCCCATC-3';内参照 GAPDH 的上游引物序列为5'-GGCATTGCTCTCAATGACAAC-3',下游引物序列为5'-TGCTCTCAGTATCCTTGCTG-3'。
3.3 脓毒症大鼠模型的建立及BMSCs 移植 用盲肠结扎穿孔(cecal ligation and puncture,CLP)法建立脓毒症大鼠模型[12],操作如下:用2%戊巴比妥腹腔注射(20 mg/kg)进行麻醉,取腹部正中切口,长度约1 cm;逐层打开腹膜,找到盲肠后游离其远端,将盲肠内粪便挤向远端,用3 号丝线结扎盲肠中段并用12 号针头在盲肠远端穿孔2 次,挤压少许粪便于盲肠表面,然后将盲肠回纳,缝合腹膜、关闭腹腔。术后单笼饲养。术后24 h,阴性转染组大鼠经尾静脉注射BMSCs 悬液10 µL[4];IL-33转染组注射转染成功的BMSCs 悬液10 µL;模型组大鼠尾静脉注射10µL DMEM 培养液;对照组为正常大鼠,不给予任何干预。
3.4 肾功能检测 移植前及移植后24、48 和72 h,从大鼠眼眶静脉采血1.5 mL,用全自动生化检测仪检测血清肌酐(serum creatinine,SCr)和血尿素氮(blood urea nitrogen,BUN)水平。
3.5 HE 染色观察大鼠肾组织结构 移植72 h 后,取大鼠右肾组织固定于10%中性福尔马林,常规脱水、石蜡包埋,切片厚度为4 µm,进行HE 染色。方法如下:用无水乙醇浸没盖玻片20 min,PBS 漂洗3遍后浸入苏木紫染液;用超离子水洗涤3 遍后将玻片浸入1%盐酸酒精溶液中1 s;再用超离子水浸洗10 min;随后浸入淡氨水中,10 min 后浸入伊红染色液中10 min;超离子水冲洗,用95%乙醇脱水2次,无水乙醇脱水3 次,加入二甲苯,最后用中性树脂封片,显微镜下观察病理表现。采用改良Rabb 法对肾脏损伤进行评价,肾脏损伤包括12 种形态学变化:肾小球皱褶、肾小囊扩张、肾小球上皮细胞坏死等。每种损伤评价标准:无病变,0 分;损伤范围<5%,1分;损伤范围5%~25%,2 分;损伤范围25%~75%,3分;损伤范围>75%,4分[13]。
3.6 TUNEL法检测细胞凋亡 移植72 h后,取大鼠肾组织做石蜡切片,用二甲苯清洗2 次,随后用梯度乙醇浸洗1 次。用蛋白酶K(20 mg/L)处理组织20 min,在加入含20%过氧化氢的PBS。待玻片干燥后,加入50µL 的TUNEL 反应混合液,盖上盖玻片在暗湿盒中反应1 h。随后加入反应终止液,37℃下保存 20 min。在组织处加入 50 µL 的 DAB 底物,反应15 min,后经过梯度乙醇脱水、二甲苯透明和中性树脂封片。用荧光显微镜观察切片,TUNEL 阳性细胞发出绿色荧光。
3.7 Western blot 检测 IL-1β、IL-6、TNF-α、TLR4 和MyD88 的表达 样品中加入SDS 缓冲液煮沸5 min使蛋白变性。经凝胶电泳(SDS-PAGE)后将蛋白转移至PVDF 膜上,用5%脱脂奶粉封闭1 h,孵育I 抗,4℃过夜,弃去I 抗,TBST 洗膜3 次,每次5 min。室温孵育 II 抗 2 h,弃去 II 抗,TBST 洗膜 3 次,每次 5 min。用 ImageQuant LAS 4000 成像系统显色,以 β-actin 作为内参,计算目标蛋白条带与β-actin灰度比值。
4 统计学处理
采用SPSS 20.0进行统计学分析,计量资料采用均数±标准差(mean±SD)表示,组间均数比较采用重复测量方差分析或单因素方差分析,两两比较用LSD-t检验;生存率比较用Kaplan-Meier法,两两比较用log-rank检验。以P<0.05为差异有统计学意义。
结 果
1 BMSCs的形态学特征及鉴定
传代后BMSCs 生长迅速,4 d 后基本长满瓶底,呈梭形,第1、2、3 代细胞增殖活跃,大部分细胞单层贴壁生长。当细胞融合85%时,细胞均匀分布,细胞核和核仁清楚可见,呈漩涡状分布,第3 代BMSCs 增殖速度明显加快,生长旺盛,见图1。流式细胞术检测第3代BMSCs表面标志物,其中,CD34和CD45阳性表达率分别为 0.7% 和 0.5%,CD29、CD73 和CD90 阳 性 率 分 别 为 98.4%、98.9% 和 99.1%,见图2。
2 转染后BMSCs 中IL-33 mRNA 表达及BMSCs在大鼠体内的定植情况
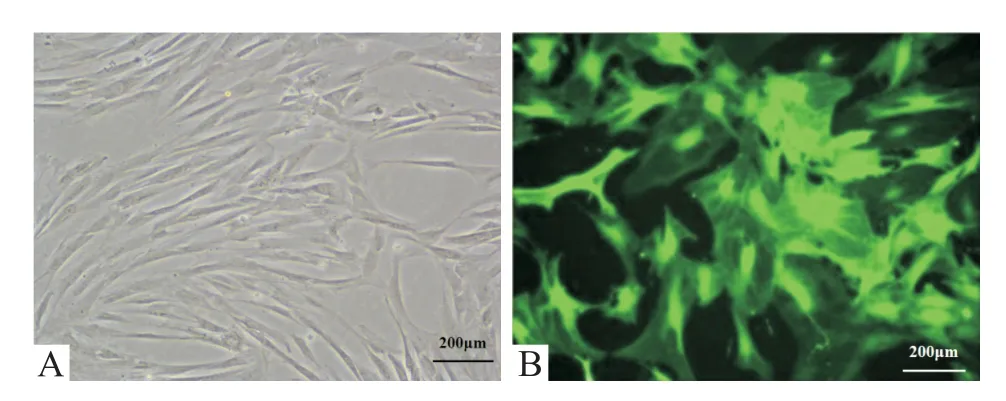
Figure 1.Morphological characteristics of the 3rd generation of BMSCs.A:BMSCs under an inverted microscope be‑fore transfection;B:BMSCs under a fluorescence mi‑croscope after transfection.Scale bar=200µm.图1 BMSCs的形态学特征
转染后BMSCs 中IL-33 mRNA 表达水平显著升高(P<0.05),见图3A,说明转染IL-33成功,BMSCs中IL-33 呈高表达。模型组大鼠外周血和肾组织中IL-33 mRNA 表达水平显著高于对照组,IL-33转染组IL-33 mRNA 表达水平显著高于模型组、对照组及阴性转染组(P<0.05),见图3B、C,说明尾静脉注入转染IL-33基因的BMSCs 后,血液和肾脏中IL-33 的表达水平显著升高。
3 各组大鼠一般情况
CLP后24 h,模型组大鼠出现躁动、寒战、疲乏和竖毛现象。模型组大鼠处死后,肉眼可见腹腔内有血性渗出液,盲肠变黑且粘连,肠管胀气,部分大鼠有肠间和(或)肾周积脓。模型组大鼠的生存率显著低于对照组(P<0.05);IL-33转染组大鼠的生存率高于模型组和阴性转染组(P<0.05),见表1。
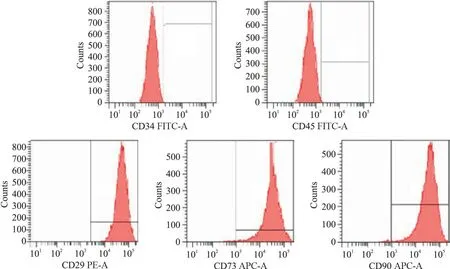
Figure 2.Identification of the BMSCs by flow cytometry.图2 流式细胞术鉴定BMSCs

Figure 3.The mRNA expression levels of IL-33 in BMSCs after transfection(A)and in peripheral blood(B)and kidney tissues(C)of the rats after transplantation.Mean±SD. n=20.*P<0.05 vs untransfected group;#P<0.05 vs control group;△P<0.05 model group.图3 转染后BMSCs中及移植后大鼠外周血和肾组织中IL-33的mRNA表达水平
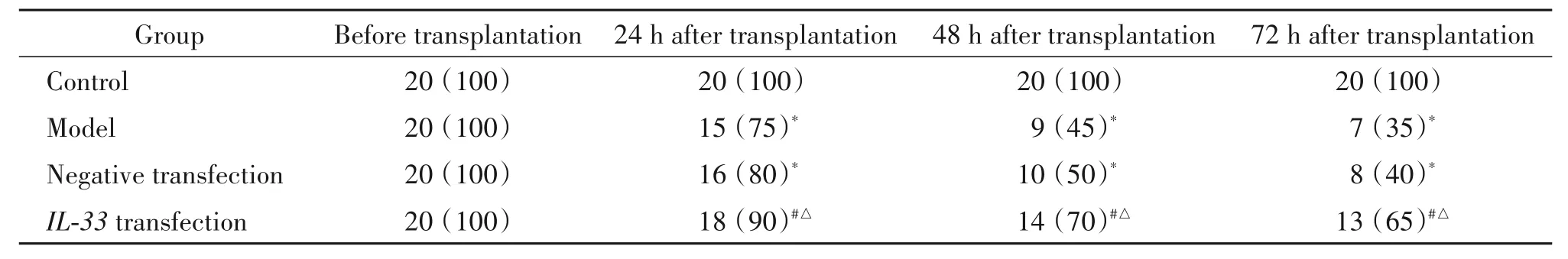
表1 移植后各组大鼠的存活情况Table 1.Survival of the rats in each group after transplantation[n(%)]
4 各组大鼠SCr和BUN比较
模型组和阴性对照组大鼠SCr 和BUN 水平均高于对照组(P<0.05);IL-33转染组大鼠SCr 和BUN 水平均显著低于模型组和阴性转染组(P<0.05),见表2、3。

表2 移植后各组大鼠SCr水平比较Table 2.Comparison of serum creatinine(SCr)levels in rats after transplantation(mg/dL.Mean±SD. n=20)
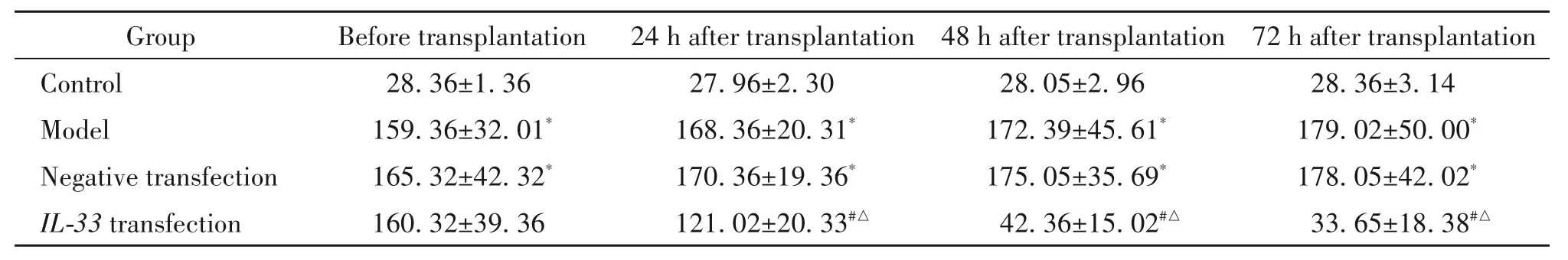
表3 移植后各组大鼠BUN水平比较Table 3.Comparison of blood urea nitrogen(BUN)levels in rats after transplantation(mg/dL.Mean±SD. n=20)
5 各组大鼠肾组织形态学特征
模型组和阴性转染组大鼠可见明显的肾小管损伤,包括上皮肿胀、刷状边界损失和严重管腔扩张,肾间质可见炎症细胞浸润,肾小球有瘀血;模型组和阴性对照组大鼠肾脏组织病理损伤评分均显著高于对照组(P<0.05),IL-33转染组大鼠肾脏组织病理损伤评分显著低于模型组和阴性转染组(P<0.05),见图4。
6 各组大鼠肾组织细胞凋亡情况
模型组和阴性转染组肾组织凋亡细胞比例显著高于对照组(P<0.05);与模型组和阴性转染组比较,IL-33转染组肾脏组织凋亡细胞比例明显降低(P<0.05),见图5。
7 各组大鼠肾组织IL-1β、IL-6、TNF-α、TLR4 和MyD88蛋白表达水平
模型组和阴性转染组大鼠肾组织IL-1β、IL-6、TNF-α 和MyD88 蛋白表达水平显著高于对照组(P<0.05);与模型组和阴性转染组比较,IL-33转染组IL-1β、IL-6、TNF-α、TLR4 及 MyD88 蛋白表达水平显著下降(P<0.05),见图6。
讨 论
IL-33 属于IL-1 家族成员,能够促进T 淋巴细胞亚群介导的自身特异性变态反应,促进IL-4、IL-5 和IL-13 的分泌,增强 Th2 型免疫[11-13];同时,还可以促进自然杀伤细胞和自然杀伤T 细胞分泌IFN-γ,激活Th1 型免疫,在Th1/Th2 的免疫调节中发挥了重要作用[14-16]。有研究显示,在脓毒症动物模型中,IL-33可促进中性粒细胞向感染部位趋化,并促进IFN-γ的分泌,进而提高脓毒症小鼠的存活率[17]。Cao 等[8]观察到IL-33 可以预防缺血再灌注小鼠的肾结构和功能损伤。但目前尚未见关于IL-33 治疗脓毒症AKI的效果及机制研究的报道。

Figure 4.The histomorphological changes of rat kidney tissues 72 h after transplantation(HE staining,scale bar=100µm)and com‑parison of renal pathological injury scores.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs negative transfection group.图4 移植72 h后HE染色观察大鼠肾组织形态学变化和肾脏病理损伤评分比较

Figure 5.The apoptosis in rat kidney tissues was detected by TUNEL assay 72 h after transplantation(scale bar=100 µm).Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs negative transfection group.图5 移植72 h后TUNEL法检测大鼠肾组织细胞凋亡情况
本研究用IL-33基因对BMSCs 进行修饰,转染后大鼠存活率显著提高,并且肾功能指标显著改善。采用HE染色观察大鼠肾组织病理学变化,结果显示IL-33修饰的BMSCs 可以明显改善肾脏病理损伤,同时可显著降低脓毒症AKI 大鼠肾脏组织细胞凋亡比例,提示IL-33修饰的BMSCs 可显著减轻脓毒症AKI大鼠的肾脏损伤,减少肾组织细胞凋亡,提高大鼠存活率。

Figure 6.The expression levels of IL-1β,IL-6,TNF-α,TLR4 and MyD88 in kidney tissues of rats in each group 72 h after transplan‑tation.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs model group;△P<0.05 vs negative transfection group.图6 移植72 h后各组大鼠肾组织IL-1β、IL-6、TNF-α、TLR4和MyD88蛋白表达水平
研究显示,TLR4/MyD8 信号转导通路在脓毒症的发病中发挥重要作用[18]。郭皓等[19]的研究显示,TLR4 介导的炎症反应参与了脓毒症AKI 的发生过程。TLR4 可释放 IL-1β、IL-6、TNF-α 等多种炎症因子,不仅可直接损害肾脏实质细胞,还可激活依赖TLR4 的免疫细胞,诱导细胞因子,发挥肾损伤作用。研究显示,使用TLR 拮抗剂可明显减轻脓毒症引起的 AKI[20]。还有研究显示,IL-33 可以通过下调MyD88 促进 Th2 细胞分泌 IL-4 和 IL-13,进而发挥抗炎作用[21]。MyD88 的激活可以促进 IL-1β、IL-6 和TNF-α 的表达,进而引起细胞和组织发生炎症性损伤[22-23]。因此 ,本研究推测 IL-33 可能通过调控TLR4/MyD88 信号转导通路介导的炎症反应发挥作用。MyD88 是IL-33 下游的靶分子,与细胞增殖、分化和凋亡密切相关[24]。MyD88 与脓毒症 AKI 的病理损伤密切相关[25]。本研究结果显示,IL-33修饰的BMSCs 治疗后 IL-1β、IL-6 和 TNF-α 表达水平均显著下降,说明IL-33可能通过MyD88减轻肾组织炎性损伤,进而治疗AKI。同时,与模型组和阴性转染组比较,IL-33转染组TLR4 及MyD88 蛋白表达水平显著下降,提示IL-33基因修饰的BMSCs 可能通过抑制TLR4/MyD88 的激活,减轻AKI 肾组织炎性损伤,改善肾功能。
综上所述,IL-33基因修饰的BMSCs对脓毒症大鼠AKI 的疗效显著,治疗后大鼠肾脏病理损伤明显减轻,细胞凋亡明显减少,其机制可能与IL-33 调控TLR4/MyD88信号通路、抑制肾脏炎症反应有关。未来需要进一步进行机制研究,以明确IL-33 对BMSCs的作用及对AKI肾脏的保护作用。
