小鼠胚胎大脑皮质活化和静息神经干细胞的初步分离与鉴定*
2020-09-07涂晓萌李莲莲罗祖强
涂晓萌,李莲莲,李 雪,罗祖强
(1温州医科大学附属眼视光医院眼视光学和视觉科学国家重点实验室,2温州医科大学附属第一医院病理科,浙江温州325027)
干细胞是未分化的细胞群,能不断增殖和自我更新[1-3],其特性之一是存在静息状态。在哺乳动物中,无论骨髓、肠上皮或毛囊,静息干细胞和活化干细胞均存在于相同的组织中,静息干细胞作为储备力量,在维持体内平衡和组织再生中发挥重要作用[4-6]。因此,细胞静息状态的研究将有助于理解生理和病理情况下的组织再生,为组织修复等提供新的治疗策略。
在包括小鼠和灵长类在内的哺乳动物神经系统中,干细胞能够分化为神经元、少突胶质细胞和星形胶质细胞[7-8]。干细胞移植对神经退行性病变(帕金森病、脊髓损伤、中风)的治疗目前为医学界的研究热点[9]。小鼠胚胎大脑皮质发育过程中,孕早期(胚胎10~13 d)的神经干细胞主要处于增殖状态;在孕中期(胚胎13~17 d),一部分干细胞通过对称分裂,得到两个相同的子细胞,另一部分通过不对称分裂得到一个子细胞和一个定向分化的细胞,这是神经元大量产生的阶段[10]。出生后,哺乳动物神经干细胞主要存在于海马的颗粒下层和室管膜下区[11-12]。小鼠室管膜下区中,具有星形胶质细胞特性的胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)阳性(GFAP+)的B 细胞属于干细胞,具有自我复制功能,是出生后产生的胶质细胞和神经元的来源[13]。此外,小鼠中GFAP+细胞既存在于活化的细胞[也表达表皮生长因子受体(epidermal growth fac‑tor receptor,EGFR),即EGFR+],也存在于静息状态的细胞中[14]。
小鼠成体神经干细胞的分离为干细胞移植治疗神经退行性疾病奠定了部分理论基础[14-16]。但是成体干细胞的分化潜能相对较低,胚胎时期的干细胞具有更强的增殖和定向诱导分化能力。然而目前对于胚胎时期神经干细胞的静息和活化状态之间的区别还知之甚少。因此,本研究从小鼠孕中期的胚胎入手,寻求一种分离胚胎时期静息和活化神经干细胞的方法,并对两类细胞进行鉴定,为有效治疗神经系统相关疾病提供参考资料。
材料和方法
1 动物
15~16 周清洁级 ICR 小鼠 20 只(雄鼠 2 只,雌鼠18 只),体重约30~40 g,来自并繁殖于温州医科大学动物学实验室,动物合格证号为SYXK(浙)2015-0009。小鼠繁育,主要通过当天晚上合笼,第2 天分笼的方式,见栓则记为胚胎0.5 d(embryonic day 0.5,E0.5)。所有操作都严格遵循温州医科大学实验动物和动物实验相关管理条例进行。
2 主要试剂
2.1 细胞培养试剂 胎牛血清、0.25% trypsin-EDTA、HBSS(Hank's balanced salt solution)、DMEM/F12 培养基和B27 添加剂购自Gibco;青、链霉素购自Sigma;碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和表皮生长因子(epidermal growth factor,EGF)购自R&D;碘化丙啶(propidium iodide,PI)购自上海生工公司。
2.2 抗体及其他试剂 PAX6 抗体购自R&D;Ki67抗体购自Millipore;GFAP 抗体购自Abcam;Olig2 抗体 购 自 Millipore;Alexa Flour 488、Cy3 和 Normal Donkey Serum 购自 Jackson ImmunoResearch;牛血清白蛋白购自 Cell Signaling Technology;甘氨酸、L-赖氨酸和Triton X-100 购自Sigma;PBS 购自福州迈新生物技术有限公司;RNeasy Mini Kit 购自QIAGEN;Power SYBR®Green PCR Master Mix 购自 Life Tech‑nologies;逆转录试剂盒购自天根公司;β-巯基乙醇购自碧云天公司;多聚甲醛购自上海凌峰化学试剂有限公司。
2.3 实验仪器 FACSCalibu、rFACSAria、二氧化碳细胞培养箱、CountessTMAutomated Cell Counter(Invi‑trogen);激光共聚焦扫描显微镜(Zeiss LSM 710),ABI 7500荧光定量 PCR 仪和PCR扩增仪(Bio-Rad)。
3 主要方法
3.1 大脑皮层单细胞悬液制备 在体式显微镜下,冰上分离小鼠E14.5 胚胎的大脑皮质,剪碎,置于适量0.05%胰酶中,37℃水浴消化8~10 min;加入等量预热的DMEM 全培,终止消化;157×g,室温离心5 min;弃上清,加入适量的DMEM;吹打数次,制成单细胞悬液;用40µm 的筛过滤悬液,去掉没有消化完全的组织。
3.2 流式细胞术 单细胞悬液转移至进样管内,上机后,细胞会分为明显的两个细胞团,分别设门,收集细胞。分选的细胞后续提取RNA,收集管接口处安装两个装有1 mL D-PBS 的15 mL 收集管;如果细胞用于培养,收集管接口处安装两个装有1 mL 培养液的15 mL 收集管,且收集管提前一天用FBS 孵育。样本制作、上机分选等过程需严格无菌技术操作。
3.3 RT-qPCR 取流式分选出的大、小细胞,利用RNeasy Mini Kit 试剂盒提取总RNA,再使用逆转录试剂盒合成cDNA。从NCBI GenBank 中查找cDNA序列,利用Primer Premier 5.0 软件设计引物,由上海华津生物有限公司进行引物合成,具体引物序列见表 1。RT-qPCR 选用 ABI 7500 荧光定量 PCR 系统。反应条件为:95℃预变性5 min;95℃变性10 s,60℃退火延伸55 s,40 个循环。反应体系如下:上、下游引物各 1.25 µL,12.5 µL SYBR Green I Master,2µL cDNA,ddH2O补足25µL。
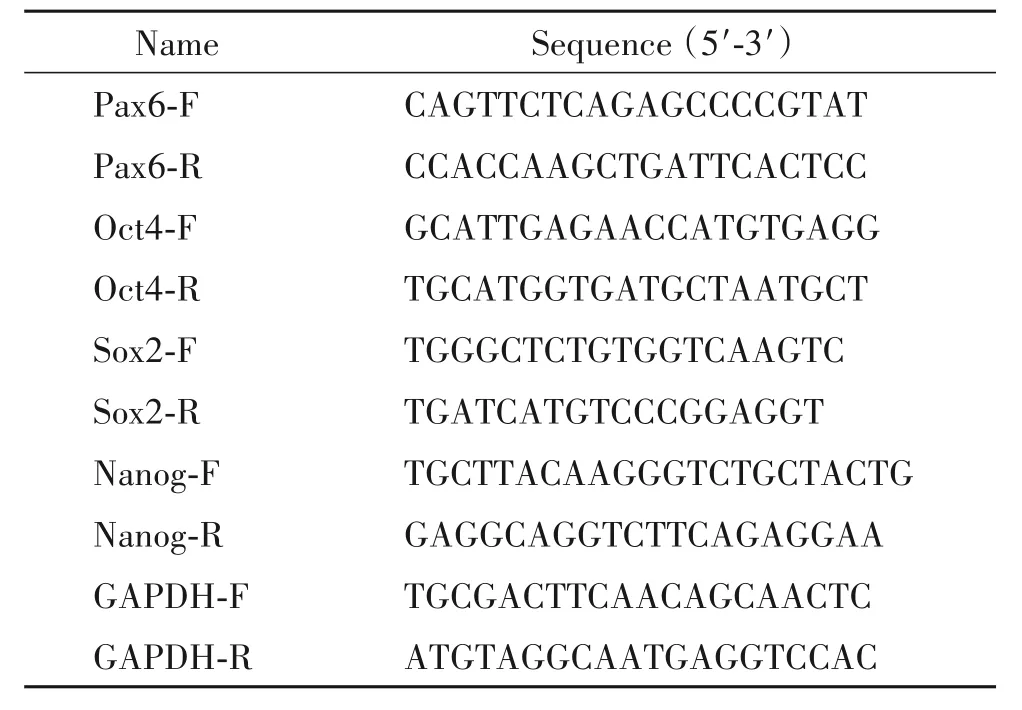
表1 RT-qPCR引物序列Table 1.Sequences of the primers for RT-qPCR
3.4 细胞周期的检测 收集流式分选出大小细胞,314×g离心 10 min,弃上清,预冷的 PBS 洗 2 次,弃上清,边震荡边缓慢加入70%乙醇至充分混匀,4℃固定细胞12 h 以上。将经过固定的细胞157×g离心5 min,重复2 次,弃上清,0.5 mL PBS 重悬细胞,加入PI 和 RNaseA 至终浓度 50 g/L 室温放置 10 min;流式细胞仪上机检测。
3.5 细胞培养 收集流式分选出的大、小细胞,以5×108/L 的密度接种到培养液中,培养液成分(体积比):86.8%DMEM/F12 培养基,10%胎牛血清,2%B27,0.1% bFGF(20 µg/L),0.1% EGF(20 µg/L),1%青、链霉素。细胞置于5% CO2培养箱中37℃培养。
3.6 免疫荧光染色 收集流式分选出的大、小细胞,经细胞甩片机制片后,4%多聚甲醛室温固定15 min,0.3% Triton X-100 破膜 5 min,PBS 洗 2 遍后加入适量的封闭液;室温孵育1 h;加入Ⅰ抗[PAX6 抗体(1∶200)和Ki67抗体(1∶300)],37℃孵育1 h;PBS洗 3 遍后,加入 Alexa Flour 488 和 Cy3 荧光Ⅱ抗(1∶500),37℃避光孵育1 h;加入抗淬灭封片剂(含DA‑PI)封片,激光共聚焦扫描显微镜下观察照相。
4 统计学处理
数据均采用均数±标准差(mean±SD)表示,显著性差异分析用SPSS 11.5 软件进行t检验。以P<0.05为差异有统计学意义。
结 果
1 小鼠E14.5 大脑皮质经流式细胞术分选为大、小两团细胞
取小鼠E14.5 大脑皮质,消化成单细胞悬液后,通过流式细胞术进行分选,存在两团体积大小显著差异的细胞群,即大细胞(big cells,B-cells,R2)和小细胞(small cells,S-cells,R1),见图1。

Figure 1.The distribution of the cells shown by flow cytometry.R1:small cells;R2:big cells.图1 流式细胞分选术的细胞分布图
2 大细胞主要为神经干细胞,小细胞部分为神经干细胞
免疫荧光染色显示,大细胞组细胞Pax6 染色阳性,小细胞组也存在部分Pax6阳性细胞;统计分析表明,大细胞组Pax6阳性率超过90%,说明大细胞几乎全部是神经干细胞,而小细胞组Pax6 阳性率约为37%,说明部分小细胞为神经干细胞,见图2。
3 RT-qPCR 检测大、小细胞团干细胞特异性标志基因的表达
如图3 所示,两组均表达干细胞特异性基因Pax6、Oct4、Sox2和Nanog,进一步说明大小细胞均有干细胞特性;小细胞组Pax6的mRNA 相对表达量比大细胞组高约60倍(P<0.05),而Oct4、Sox2及Nanog的mRNA表达水平均显著低于大细胞组(P<0.05)。
4 大、小细胞增殖特性的检测
如图4 所示,大细胞组Pax6 阳性的细胞中,Ki67染色几乎为阳性;而小细胞组Pax6 阳性的细胞中,Ki67阳性率几乎为零。
5 大、小细胞的细胞周期及周期相关蛋白的检测
如图5A 所示,处于G0/G1期的大细胞比例为85.16%,G2/M 期为6.08%;处于G0/G1期的小细胞比例为92.92%,G2/M 期为0.00%。这说明大细胞处于增殖活跃状态,而小细胞增殖几乎停滞,处于静息状态。

Figure 2.Identification of neural stem cells by Pax6 immunofluorescence staining(scale bar=20 µm).Mean±SD. n=6.**P<0.01 vs B-cells.图2 免疫荧光染色鉴定神经干细胞
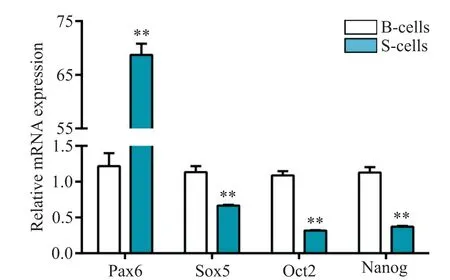
Figure 3.RT-qPCR was used to detect stem cell specific marker genes in big and small cell clusters.Mean±SD. n=3.**P<0.01 vs B-cells.图3 大、小细胞团干细胞特异性标志基因的RT-qPCR 检测结果
如图5B 所示,小细胞组细胞周期相关蛋白cy‑clin A 和cyclin B 的mRNA 相对表达量低于大细胞组,说明与大细胞组相比,小细胞组G2/M期处于相对抑制的状态;而大、小细胞组cyclin E 的mRNA 相对表达量无显著差异(P>0.05)。
6 大、小细胞体外培养特性不同
如图6A所示,第4天时,大细胞组出现了明显的微球,而小细胞组出现微球较晚;培养相同的时间,大细胞组产生的微球数量显著多于小细胞组(P<0.05)。培养至第7 天时,可以看到大细胞组形成的微球体积大,折光性好,边缘细胞界限清楚;小细胞组仅形成由几十个细胞组成的微球,呈桑葚状,体积小,见图6B。
7 小细胞在体外可以被激活成具有大细胞活性的细胞
把分选出的细胞放在干细胞培养基中,8 d 后,将微球消化成单细胞,甩片免疫荧光,检测小细胞能否转变成具活化的细胞。免疫荧光染色结果显示,Pax6 阳性的小细胞Ki67 染色也阳性,同具有活性的大细胞染色结果相同;统计显示,小细胞组Pax6 和Ki67 的共染比例与大细胞组相近,都达到了80%以上,无显著差异(P>0.05),见图7。

Figure 4.Detection of proliferation characteristics of big and small cells by immunofluorescence staining of Pax6,Ki67 and DAPI(scale bar=20µm).Mean±SD. n=3.**P<0.01 vs B-cells.图4 免疫荧光染色检测大、小细胞的增殖特性
讨 论
神经干细胞具有静息和活化两种状态,对于神经发育十分重要。Codega 等[14]研究表明,在成年小鼠中成功分离了静息及活化干细胞。胚胎时期是大脑发育的关键时期,目前有关静息状态干细胞的报道相对较少[17]。本课题着手于胚胎时期的大脑皮质,利用流式细胞术成功分离了胚胎期静息及活化的神经干细胞,并通过免疫荧光和RT-qPCR 检测特异性标记基因的表达,在体外培养系统中,分析两种不同状态的干细胞的差别以及联系,为胚胎神经干细胞移植的研究提供了部分理论基础。
E14.5脑皮质取材的操作一直在冰上快速进行,可减少细胞降解酶的降解作用,维持了细胞的原始活性。消化时,用0.05%的胰酶及不同口径巴氏管轻柔吹悬,可减少细胞碎片,保证了流式细胞分选时细胞处于较好的状态。

Figure 5.Detection of cell cycle(A)and cell cycle-related gene expression(B)in big and small cell groups.Mean±SD. n=3.*P<0.05,**P<0.01 vs B-cells.图5 大、小细胞组细胞周期及周期相关基因表达的检测

Figure 6.Different characteristics of big and small cells cultured in vitro.A:number of neurospheres;B:representative images of neurospheres after 7 d of culture(scale bar=20 µm).Mean±SD. n=3.*P<0.05,**P<0.01 vs S-cells.图6 体外培养的大、小细胞具有不同特性
流式细胞术是目前分选细胞的重要方法,把准备好的单细胞悬液上机后,呈明显不同的大、小两团细胞。分选设门时,不收集两团细胞之间界限不清楚的细胞,仅收集明显聚集的地方,保证细胞间不相互参杂,增强了实验的准确性。通过细胞大小来区分神经干细胞的静息和活化状态,可以将成分复杂的干细胞进行初步分类和分离,借此研究两类细胞的特性和差别,借此剖析干细胞移植的有效性是否与不同活化状态的细胞有关。
Pax6[18-20]、Sox2[21]、Oct4和 Nanog[22]均为干细胞调控的重要转录因子,对神经系统的发育中起着决定性作用。免疫荧光分析显示:两组细胞Pax6 染色均为阳性,说明其具有干细胞的特性。RT-qPCR 结果也进一步证实了两组细胞为神经干细胞。
两团细胞之间存在何种差异?从Codega等[14]的研究中得到启发,本研究检测了增殖细胞的特异性标志基因。免疫荧光分析表明,大细胞组的Ki67[23]染色阳性,而小细胞组的Ki67 染色为阴性。统计分析显示,大细胞组中Ki67 阳性率接近100%;而小细胞组中几乎为0,说明两种干细胞增殖状态不同:大细胞较为活跃,小细胞相对静止。
有研究表明,小鼠小肠上皮静息状态的细胞处于持续的G1期,也可能在不同于G1的细胞周期,比如非增殖的G0期[24]。Zetterberg 等[25]研究显示,血清剥夺可以使小鼠Swiss 3T3细胞所有细胞周期相关蛋白质合成受抑制,但只在G1早期,细胞退出周期并进入静息状态[26]。本研究结果显示,小细胞G0/G1期比例显著高于大细胞组,而G2/M 期为0,且小细胞组cy‑clin A 和cyclin B 的表达显著低于大细胞组(P<0.05),说明小细胞组增殖停滞。这些结果与Ki67免疫荧光结果相一致,进一步验证了小细胞是静息状态的神经干细胞,而大细胞为活化的神经干细胞。

Figure 7.Small cells can be activated in vitro.Neurospheres were digested into single cells,and then were immunostained with the Pax6 and Ki67 antibody.Scale bar=20 µm.Mean±SD. n=3.图7 小细胞在体外可以被激活
小鼠神经微球是评估体外干细胞增殖潜能的常用方法[27]。Codega 等[14]对成年小鼠大脑干细胞的研究显示,静息的神经干细胞几乎不产生神经微球或贴壁的集落,再生时也不会增加微球的形成率;反之,活化的干细胞易于形成神经微球和集落。本研究的神经微球结果表明:在同样条件下,大细胞4 d就能成典型的微球,而小细胞8 d才能看到微球的形态。统计显示,大细胞的细胞数明显高于小细胞,进一步证实了小细胞的增殖能力较差。这也从另一个方面验证了分离的两种细胞分别是静息和活化的神经干细胞。
在无脊椎动物中,当营养不足时干细胞就会转成静息状态[28];在哺乳动物中,静息干细胞受刺激后,能被激活并进入细胞周期[5]。为此,我们在体外培养两种细胞后,观察两者的状态变化,都长成神经微球后,消化成单个细胞再进行免疫荧光检测。Ki67 和Pax6 染色结果表明,小细胞具备与大细胞一样的增殖特性,说明静息状态下的小细胞可以被激活,转化成活化的大细胞。巢蛋白(nestin)是神经干细胞的标志物,在后续的实验中将验证这一指标。此外,还可以在培养的神经干细胞中加入10%的血清,去掉生长因子,观察小细胞定向分化为神经元的能力。由于细胞的调控机制复杂,目前尚不清楚小细胞具体是通过何种途径被活化的,还需要进一步研究。
综上所述,本研究利用流式细胞术分选出大小两团细胞,成功从小鼠胚胎大脑皮质中分离出静息和活化的干细胞。此方法通过简单的操作,不用借助标志物即可将干细胞这一相对混杂的细胞体系分离出不同的细胞类型,为提高胚胎干细胞移植在治疗退行性神经系统疾病中的效率提供了参考资料。
