鹦鹉热衣原体荧光环介导等温扩增(LAMP)检测方法的建立
2020-09-07
(中国动物卫生与流行病学中心,山东青岛 266032)
鹦鹉热是由鹦鹉热衣原体(Chlamydia psittaci)感染所引起的一种人兽共患病。鹦鹉热衣原体是一种专性细胞内寄生的革兰阴性菌,其发育形态有两种:一种是能二分裂增殖的网状小体,另一种是有感染能力的原生小体[1]。目前已知鹦鹉热衣原体有9 个血清型,分别为A、B、C、D、E、F、E/B、WC 和M56 型[2]。它是一种多宿主性病原微生物,能通过呼吸道或直接接触传播,可感染多种鸟类和人类。目前鹦鹉热广泛分布于世界各地,中国、美国、巴西、日本和比利时等国家都有鸟类感染鹦鹉热衣原体的报道[3-8]。
近年来鹦鹉热衣原体作为鸟类衣原体病和人类衣原体病的病原越来越受到重视,研究热点多集中在如何防止家禽感染以及感染后的治疗措施方面。对于该病的诊断大多集中在细胞培养、PCR或基因芯片等[9],而受病原分离培养和实验室条件等的限制,很多方法在实际应用中不能较好发挥作用。本研究基于环介导等温扩增的原理,针对鹦鹉热衣原体23SRNA 基因序列设计通用引物,建立一种恒温荧光扩增鹦鹉热衣原体的方法。该方法可用恒温荧光仪直接检测荧光信号强度,从而减少了肉眼判读结果的误差,既增强了准确性,也避免了开盖污染产生假阳性。本方法的建立为鹦鹉热衣原体病的快速诊断、实验室鉴定和疫情监测提供了技术支撑。
1 材料和方法
1.1 材料
1.1.1 质粒和核酸DNA 根据NCBI 中的鹦鹉热衣原体23SRNA 基因序列,运用DNAstar 软件进行同源性分析和BLAST 序列分析,筛选出23SRNA 基因高度保守序列,以筛选获得的高度保守序列作为检测目的基因片段,合成阳性质粒,质粒大小为2 781 bp,质量浓度为32.55 ng/μL。流产衣原体、动物布鲁氏菌、牛结核分枝杆菌、沙门氏菌、大肠杆菌、金黄色葡萄球菌和临床DNA 样品等的核酸DNA,由本实验室提取并保存。
1.1.2 主要仪器和试剂 引物和质粒,由北京睿博兴科生物技术有限公司合成;DNA 提取试剂盒,购自OMEGA 公司;恒温荧光检测仪Dhelix1610和DNA 恒温扩增试剂盒,购自广州双螺旋基因技术有限公司。
1.2 方法
1.2.1 引物和反应条件 使用Primer Explorer V4(http://primerexplorer.jp/e/)软件设计6 组引物组合:组合1,包括CH-1OF、CH-1OB、CH-1FIP、CH-1BIP、CH-1LF、CH-1LB;组合2,包括CH-1OF、CH-1OB、CH-2FIP、CH-1BIP、CH-1LF、CH-1LB;组合3,包括CH-1OF、CH-3OB、CH-1FIP、CH-1BIP、CH-1LF、CH-1LB;组 合4,包 括CH-1OF、CH-1OB、CH-4FIP、CH-1BIP、CH-1LF、CH-1LB;组合5,包括CH-1OF、CH-1OB、CH-1FIP、CH-5BIP、CH-1LF、CH-1LB;组合6,包括CH-6OF、CH-6OB、CH-6FIP、CH-6BIP、CH-6LF、CH-6LB(表1)。将引物进一步通过NCBI 的BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列比对分析,比较设计的引物序列与主要病原菌(流产衣原体、动物布鲁氏菌、牛结核分枝杆菌、沙门氏菌、大肠杆菌、金黄色葡萄球菌)的序列匹配度,确定引物的特异性。
1.2.2 引物筛选 通过试验筛选最优反应条件,反应总体系约为25 μL,其中反应缓冲液12.5 μL、引物1 μL、聚合酶1 μL、荧光染料0.5 μL、RNase Free dH2O 8.0 μL、DNA 模板2 μL。反应体系配好后加入甘油0.25 μL,然后63 ℃下恒温扩增1 h。以标准质粒作为模板阳性对照,双蒸水作为阴性对照进行引物筛选;阴阳对照各做2 个重复,选取反应条件最优的作为最优引物。
1.2.3 特异性试验 应用1.2.2 中筛选出的最优引物,以流产衣原体、动物布鲁氏菌、牛结核分枝杆菌、沙门氏菌、大肠杆菌和金黄色葡萄球菌等病原菌核酸作为模板进行扩增,评价该方法的特异性。
1.2.4 敏感性试验 以标准核酸为母液,将其稀释为1×106拷贝/μL后,再连续进行10倍倍比稀释,依次取100~106拷贝/μL 为模板,应用1.2.2 中筛选出的最优引物进行扩增,评价该方法的敏感性。

表1 鹦鹉热衣原体恒温荧光快速检测引物
1.2.5 临床样品检测 对实验室保存的34 份从鸡咽喉和泄殖腔拭子中提取的DNA 样品进行检测。
2 结果
2.1 引物筛选
本研究设计了6 组引物探针组合,先经BLAST 比对分析,并与常见病原菌(流产衣原体、动物布鲁氏菌、牛结核分枝杆菌、沙门氏菌、大肠杆菌和金黄色葡萄球菌)序列进行比对分析,结果显示特异性良好。通过试验筛选最优引物,结果显示6 组引物中,组合1 起峰时间早、荧光强度值高、重复性和特异性最好,故组合1 最优(图1)。
2.2 特异性试验
提取流产衣原体、动物布鲁氏菌、牛结核分枝杆菌、沙门氏菌、大肠杆菌和金黄色葡萄球菌等的核酸作为模板,以标准核酸为阳性对照,对引物组合1 进行特异性试验。结果(图2)显示,引物组合1 特异性较好。
2.3 灵敏度试验
取原浓度标准品进行梯度稀释,依次取100~106拷贝/μL 为模板,对稀释后的各浓度梯度进行检测,每个梯度做2 次重复,结果显示该方法的灵敏度为100 拷贝/μL(图3)。
2.4 临床样品检测
用建立的方法(LAMP)与QPCR 方法同时对实验室保存的临床DNA样品进行检测。结果(图4)显示,34 份临床样品中,LAMP 和QPCR 均检测到1 份阳性,其余为阴性,符合率为100%。
3 讨论
在我国,鹦鹉热衣原体被列为三类动物病原微生物,其宿主广泛,感染性强,可通过呼吸道或直接接触传播。目前实验室诊断常用的方法中,鸡胚培养或细胞培养对实验室生物安全条件要求较高,且不易分离到病原;补体结合试验和间接血凝试验操作步骤比较繁琐,容易出现结果偏差;荧光定量PCR 和基因芯片等试验则需要昂贵的仪器,成本较高。随着分子生物学和免疫学技术的飞速发展,环介导等温扩增技术、重组酶介导链替换核酸扩增技术、重组酶聚合酶扩增技术和胶体金等检测方法越来越成熟,已有很多被应用到人兽共患病的诊断中。加强鹦鹉热衣原体新型诊断技术的研发与应用,必将为该病的快速、高效诊断和防控奠定基础。
LAMP 检测方法是由日本科学家开发的[11],也被国内很多学者应用到各种疫病的检测中[12-14]。但这些方法往往需要借助肉眼观察颜色变化以及凝胶电泳实验或浊度仪等判读结果,容易出现结果偏差,而且无法有效避免开盖污染产生的假阳性。本研究建立的基于恒温荧光技术的现场快速检测诊断技术,适用于基层和现场快速筛查病原。该技术能在63 ℃恒温条件下1 h 内即可显示结果,操作简单、快速,特异性强,灵敏度可达100 拷贝/µL。此外,该技术用国产仪器通过直接检测荧光信号判读结果,既增强了准确性,也避免了开盖污染产生假阳性。该方法的建立弥补了传统检测技术的不足,也为实现鹦鹉热衣原体的现场快速诊断提供了技术支持。应用建立的LAMP 方法对实验室保存的临床DNA 样品进行检测,发现与QPCR 检测的结果相同,说明该方法可用于临床检测。

图1 衣原体6 组引物筛选结果
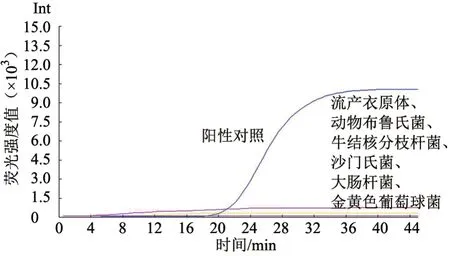
图2 特异性试验结果
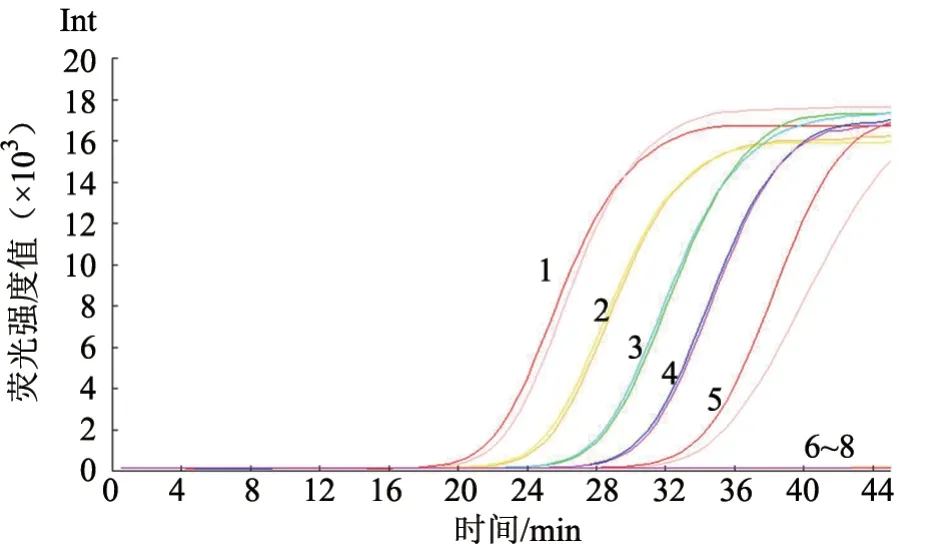
图3 灵敏度试验结果
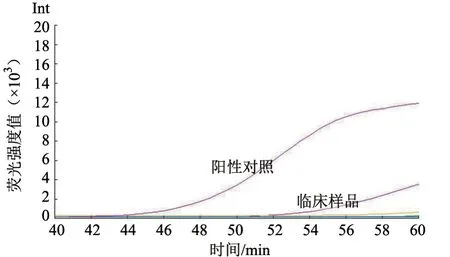
图4 部分临床样品检测结果
