猪圆环病毒2 型Cap 蛋白琼脂扩散试验检测方法的建立
2020-09-07庄金秋梅建国
庄金秋,梅建国,张 颖,董 林,李 峰
(1.山东省滨州畜牧兽医研究院,山东滨州 256600;2.滨州贝尔凯瑞生物技术有限公司,山东滨州 256600)
猪圆环病毒(porcine circovirus,PCV)为圆环病毒科圆环病毒属成员,常见基因型包括PCV1和PCV2。PCV1 无致病性,PCV2 具有致病性。PCV2 是断奶仔猪多系统衰竭综合征(PMWS)的主要病原,多发于5~16 周龄仔猪,死亡率达10%~30%,给养猪业造成严重的经济损失[1-3]。PCV2 包含两个主要的阅读框ORF1 和ORF2:ORF1 编码病毒复制相关蛋白(Rep 蛋白),ORF2编码病毒唯一的核衣壳蛋白(Cap 蛋白)。Cap 蛋白具有较强的免疫原性,适用于血清学检测[4]。由于猪群中的PCV2 混合感染、隐性感染较为普遍,因此筛选实验猪制备单一PCV2 血清抗体较为困难。为了解决这一问题,本试验利用实验室制备好的原核表达的PCV2 Cap 蛋白免疫家兔,制备出兔抗PCV2 Cap 蛋白多克隆抗体,建立了Cap 蛋白效价测定的琼脂扩散试验(AGP)检测方法,为该病的临床检测奠定基础。
1 材料与方法
1.1 材料
PCV2 Cap 蛋白,由山东省滨州畜牧兽医研究院生物技术重点实验室制备并鉴定;新西兰大耳白兔,于山东绿都生物科技有限公司实验动物中心购置;弗氏完全佐剂和不完全佐剂、聚乙二醇20000,均购自SIGMA 公司;PCV2 Cap 蛋白IgG抗体PPA-ELISA 检测试剂盒、猪瘟病毒(CSFV)IgG 抗体PPA-ELISA 检测试剂盒、猪细小病毒(PPV)IgG 抗体ELISA 检测试剂盒、猪繁殖与呼吸综合征病毒(PRRSV)IgG 抗体PPA-ELISA 检测试剂盒、猪伪狂犬病毒(PRV)IgG 抗体PPAELISA 检测试剂盒、兔瘟病毒(RHDV)IgG 抗体ELISA 检测试剂盒,PCV2、CSFV、PPV、PRRSV、PRV、RHDV病毒抗原,PCV2 标准阳性血清及阴性血清,琼脂糖和琼脂粉,梅花形打孔器(孔径3 mm、孔距5 mm),均由山东绿都生物科技有限公司提供;0.85%生理盐水、0.01 mol/L pH7.2 PBS,自制。
1.2 方法
1.2.1 家兔免疫 用0.01 mol/L pH7.2 的灭菌PBS,将实验室保存的原核表达纯化后的重组Cap蛋白抗原稀释成100 μg/mL(按蛋白含量)的悬浮液,与等体积弗氏完全佐剂(CFA)混合匀浆乳化后,免疫新西兰大耳白兔2 只,颈背部皮下多点注射1.0 mL/只(病毒蛋白含量为50 μg/只)。首次免疫10 d 和20 d 后,分别用1.5 倍和2 倍剂量蛋白抗原加等量弗氏不完全佐剂(IFA)匀浆乳化,背部皮下多点注射1.0 mL/只;加强免疫两次,第3次免疫10 d 后,以与三免相同剂量抗原(100 μg/只)不加任何佐剂强化免疫1 次。对照组2 只新西兰大耳白兔,每次用大肠杆菌菌液12 000 r/min 离心5 min 后的上清液,加等量灭菌0.01 mol/L pH7.2的PBS 混匀后,与试验组家兔同时免疫,1.0 mL/只。
1.2.2 兔抗PCV2 Cap 蛋白血清制备 实验组及对照组兔子于第4 次免疫后10、14、21 d,分别心脏采血20 mL,置37 ℃ 1 h 后,放4 ℃冰箱过夜;12 000 r/min 离心5 min,吸取上层血清,分装、编号,-80 ℃保存备用。
1.2.3 ELISA 法血清抗体效价测定
1.2.3.1 血清效价测定 将所有制备的实验组和对照组待检血清,分别按照1:100、1:800、1:1 600、1:3 200、1:6 400 及1:12 800 稀释后,按照PCV2 Cap 蛋白IgG 抗体PPA-ELISA 检测试剂盒使用说明书操作,检测制备的兔抗PCV2 Cap 蛋白多克隆抗体效价。
1.2.3.2 血清ELISA 特异性试验 将第4 次免疫后21 d 的实验组和对照组血清,按照1:100 稀释后,分别应用PCV2 Cap 蛋白IgG 抗体PPA-ELISA 检测试剂盒、CSFV IgG 抗体PPA-ELISA 检测试剂盒、PPV IgG 抗体ELISA 检测试剂盒、PRRSV IgG 抗体PPA-ELISA 检测试剂盒、PRV IgG 抗体PPAELISA 检测试剂盒、RHDV IgG 抗体ELISA 检测试剂盒,测定血清抗体效价。
1.2.4 AGP 方法建立 AGP 试验操作步骤按照《中华人民共和国农业部公告第2168 号》猪圆环病毒2 型基因工程亚单位疫苗附注3 进行。
1.2.4.1 AGP 最佳工作条件确定 采用中间孔加纯化后的PCV2 Cap 蛋白抗原(100 μg/mL),周围孔加第4 次免疫后14 d 的血清的方法,将血清抗体按照1:2、1:4、1:8、1:16、1:32、1:64 进行倍比稀释,分别采用不同质量浓度(0.8%、1.0%、1.2%)琼脂粉和琼脂糖、不同琼脂平板高度(3 mm、5 mm)、不同质量浓度高渗NaCl 溶液(8%、10%)、不同温度(25、37 ℃)以及不同观测时间(24、48、72 h),测定血清抗体效价,以确定最佳AGP工作条件。
1.2.4.2 血清抗体最佳工作浓度确定 采用最佳AGP 工作条件,测定兔抗PCV2 Cap 蛋白多克隆血清抗体效价。试验设立PCV2 标准阳性血清对照、阴性血清对照及制备的兔阴性血清对照。根据特异性沉淀线出现的明显程度,确定该血清AGP 抗体效价及其最佳工作浓度。
1.2.4.3 AGP 结果判定标准 当标准阳性血清孔与抗原孔之间出现清晰沉淀线,标准阴性血清孔与抗原孔之间不出现沉淀线时,试验成立。当标准阳性血清孔与抗原孔之间有明显的沉淀线,被检阳性血清与抗原孔之间也形成明显沉淀线,且与阳性血清的沉淀线末端吻合,判为特异性沉淀线,则被检血清判为阳性。当标准阳性血清与抗原孔之间有明显的沉淀线,被检血清与抗原孔之间不形成沉淀线,则被检血清判为阴性。以出现特异性沉淀线的抗体最高稀释倍数,作为待检血清的AGP 抗体效价。
1.2.5 AGP 特异性试验 采用中间孔加制备的兔抗PCV2 Cap 蛋白第4 次免疫后21d 的试验组和对照组血清,梅花桩周围孔加病毒抗原的方法,对应用聚乙二醇20000 作10 倍浓缩的CSFV、PPV、PRRSV、PRV、RHDV 等病毒以及PCV2 Cap 蛋白抗原进行AGP 试验,检测待检血清的特异性。
1.2.6 AGP 稳定性试验
1.2.6.1 批内重复试验 将第4 次免疫后14 d 的试验组和对照组血清,分别于血清制备后7、14、28、56 d,做重复性AGP 试验。采用中间孔加血清抗体、周围孔加同一批次不同稀释倍数的PCV2 Cap 蛋白(100 μg/mL)的方法,进行重复性试验。PCV2 Cap 蛋白稀释倍数分别为1:8、1:16、1:32、1:64、1:128、1:256。
1.2.6.2 批间重复试验 将制备的3 批次试验组血清做重复性AGP 试验。采用中间孔加血清抗体,周围孔加各批次不同稀释倍数的PCV2 Cap 蛋白方法,进行重复性试验。PCV2 Cap 蛋白稀释倍数同批内重复试验。
1.2.7 AGP 符合率试验 应用制备并建立的AGP方法,对20 份PCV2 Cap 蛋白样品进行检测,并与PCV2 标准阳性血清作对照,比较检测结果,计算两者符合率。
2 结果
2.1 ELISA 法测定血清抗体效价
PCV2 Cap 蛋白抗体PPA-ELISA 法测定血清抗体效价结果见表1。可见,对照组血清呈现PCV2 抗体阴性。试验组第4 次免疫后14 d 及21 d采血所测的血清抗体效价可高达1:12 800,各试验组抗体效价均在1:6 400 以上,高于《中华人民共和国农业部公告第2168 号》规定的1:1 600 稀释的抗体效价要求。3 批次兔免疫血清均可用于AGP试验。

表1 PCV2 Cap 蛋白抗体PPA-ELISA 法测定血清抗体效价结果
2.2 血清ELISA 特异性试验
抗PCV2 Cap 蛋白兔血清抗体ELISA 特异性试验结果见表2。可见,最后1 次采血,即第4 次免疫后21 d 的实验组和对照组血清CSFV、PPV、PRRSV、PRV、RHDV 抗体检测结果均为阴性,表明所有制备的血清均表现出较好的特异性。
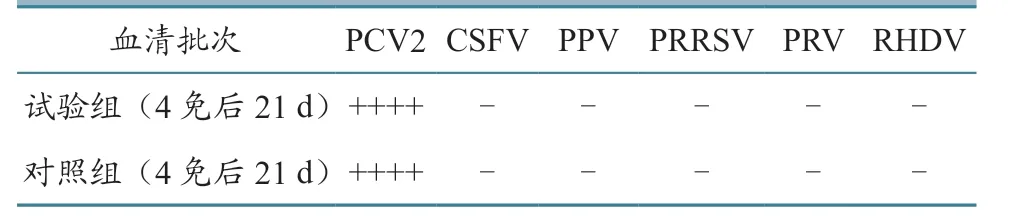
表2 抗PCV2 Cap 蛋白兔血清抗体ELISA特异性试验检测结果
2.3 AGP 最佳工作条件试验
以出现明显沉淀线的最高稀释度,作为判定AGP 抗体效价的标准。表3 可见,琼脂平板在1.0%琼脂糖、8% NaCl、3 mm 平板高度、37 ℃下观察72 h 为AGP 最佳工作条件。该条件下的沉淀线结果判定清晰、效价高,且节约抗原或抗体。
2.4 血清抗体AGP 效价测定
血清抗体AGP 效价测定结果见表4。可见,制备的抗PCV2 Cap 蛋白兔血清抗体AGP 效价最高达1:32,符合并高于PCV2 Cap 蛋白 AGP 抗体效价不低于1:4 的质量标准。所有3 批次免疫兔血清AGP 效价均在1:16 以上,均可用于AGP 试验。试验测得标准阳性血清抗体效价为1:16,与制备的多克隆兔血清抗体相符,因此确定血清最佳工作浓度为血清原液。
2.5 AGP 特异性试验
抗PCV2 Cap 蛋白兔血清抗体AGP 特异性试验结果见表5。可见最后1 次采血,即第4 次免疫后21 d 的实验组和对照组血清CSFV、PPV、PRRSV、PRV、RHDV 抗体检测结果均为阴性,表明所有制备的血清均表现出较好的特异性。
2.6 AGP 稳定性试验
2.6.1 批内重复试验 结果(图1)显示,第4次免疫后14 d,试验组血清制备后的7、14、28、56 d 测得同一批次PCV2 Cap 蛋白AGP 效价均为1:128,且特异性沉淀线清晰,对照组血清未出现沉淀线,表明所制备的抗PCV2 Cap 蛋白兔血清具有良好的批内重复性。
2.6.2 批间重复试验 3 批次试验组血清重复测3 次,测得同一批次PCV2 Cap 蛋白AGP 效价均为1:128,且特异性沉淀线清晰,表明所制备的抗PCV2 Cap 蛋白兔血清具有良好的批间重复性。
2.7 符合率试验
20 份PCV2 Cap 蛋白样品检测结果见表6。用制备的抗PCV Cap 蛋白兔血清与PCV2 标准阳性血清检测,分别检测出蛋白效价为1:64 的3 份,1:128 的17 份,二者符合率为100%。
3 讨论
近年来,PCV2 感染率呈逐年上升趋势,已成为危害我国养猪生产的重要免疫抑制性疫病之一,给养猪业造成了巨大经济损失。因此,深入了解PCV2 的免疫学特性,早发现、早治疗,已成为控制该病的关键。由于PCV2 在PK15 细胞上增殖而不出现细胞病变效应,且目前细胞系污染严重,找到纯净的细胞进行PCV2 体外培养十分困难,因此利用病毒特异性抗原进行体外大量表达,将表达产物适当纯化后作为检测抗原,取代繁琐的病毒培养、纯化,具有重要意义[5-6]。本试验以PCV2 Cap蛋白为免疫原,因其抗原成分单一,大大提高了免疫效率,也避免了用全病毒作为免疫原制备抗体过程中的大量繁琐工作和结果的不确定性。依据Cap蛋白是PCV2 的主要结构蛋白,能与PCV2 感染的血清产生特异性结合,具有中和活性的特点,本试验制备了抗PCV2 Cap 蛋白多克隆抗体,对常见猪源病毒CSFV、PPV、PRRSV、PRV、RHDV 抗体进行了检测,结果均为阴性,表明本研究制备的多克隆抗体可用于后续PCV2 的免疫学特性研究。
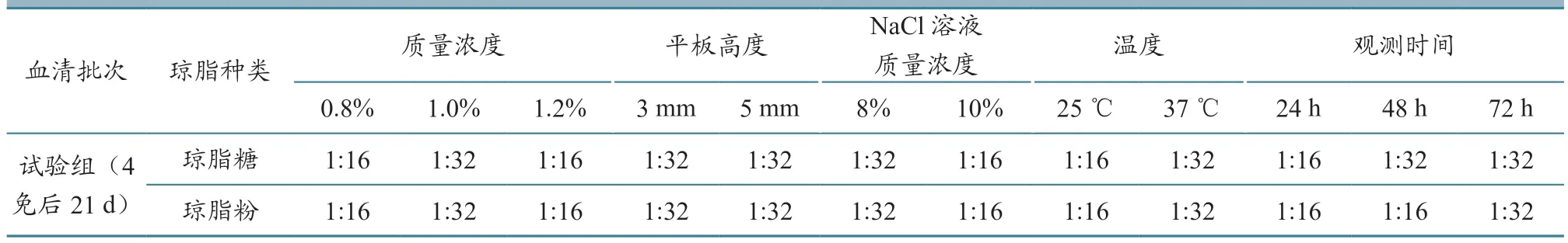
表3 不同条件下血清AGP 抗体效价结果
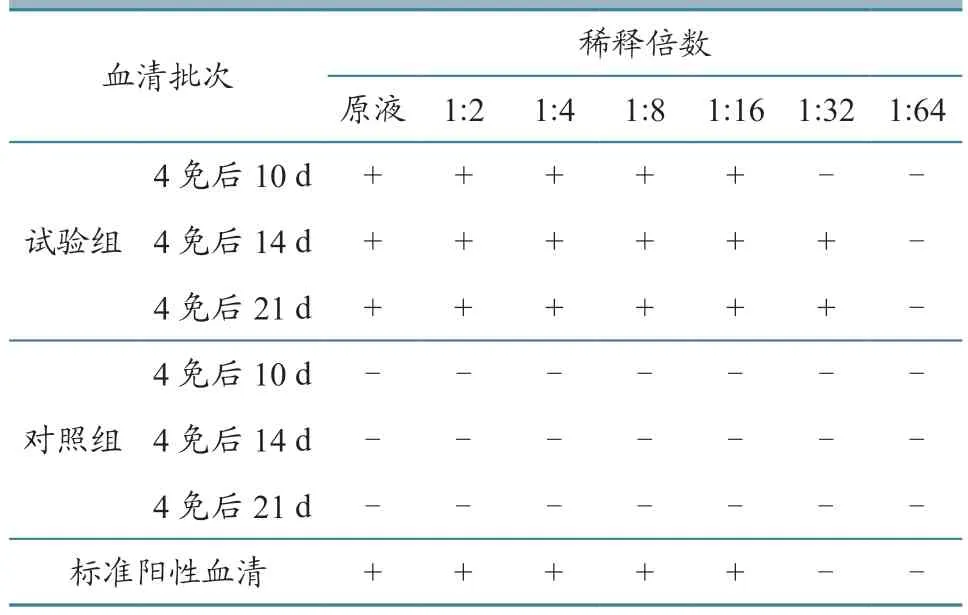
表4 PCV2 Cap 蛋白抗体AGP 法测定血清抗体效价结果
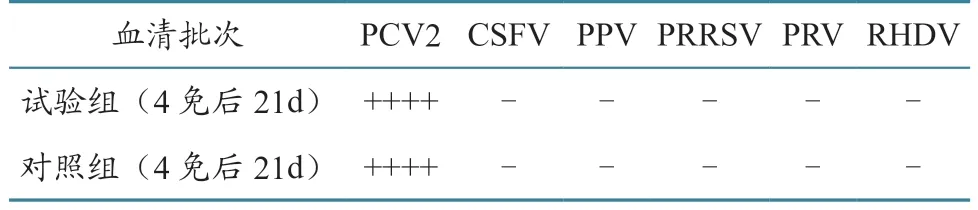
表5 抗PCV2 Cap 蛋白兔血清抗体AGP特异性试验检测结果

图1 PCV2 Cap 蛋白AGP 效价
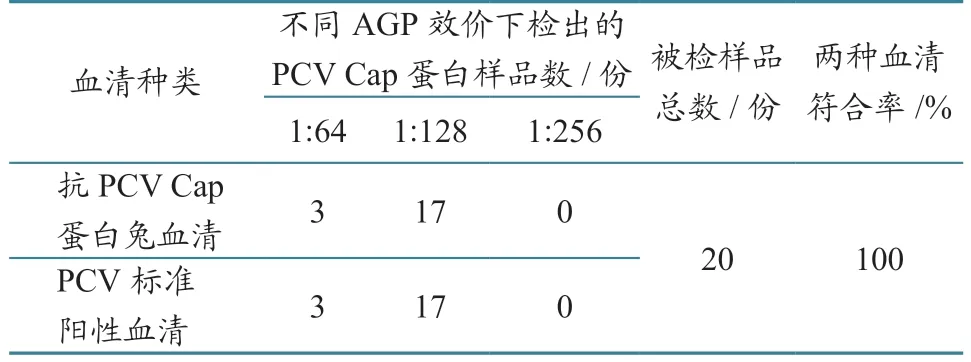
表6 抗PCV Cap 蛋白兔血清与PCV2 标准阳性血清符合率试验结果
4 结论
本试验应用实验室原核表达的PCV2 Cap 蛋白建立的AGP 检测方法,经特异性、稳定性、符合率试验,证明制备的兔抗PCV2 Cap 蛋白血清效价高,且具有良好的特异性、稳定性,与PCV2 猪阳性血清检测结果符合率为100%,可完全替代标准抗体,用于PCV2 Cap 蛋白AGP 试验检测。
