急性脑梗死合并医院获得性肺炎患者的病原菌分布变迁情况及耐药性分析
2020-09-05田敬华杨品娜刘清泉
田敬华 杨品娜 刘清泉
医院获得性肺炎(Hospital acquired pneumonia,HAP)是患者入院48 h 后由真菌、细菌等病原体感染引起的各种类型肺实质炎症[1]。HAP 在院内感染中患病率约10%~20%,病死率占据获得性感染首位[2]。急性脑梗死(Acute cerebral infarct,ACI)因发病急、病情危重,多需长期住院治疗、康复,加之此类患者生理机能降低,极易继发医院感染,成为HAP 高发群体[3]。ACI 合并HAP 不仅会加重病情,甚至危及患者生命,而其难以控制的一个主要原因是抗生素耐药。随β-内酰胺类抗菌药物广泛应用致耐药菌株迅速出现,尤其是初期抗感染的经验性治疗非常重要,若抗菌药物应用不当可引起耐药菌株出现,导致抗感染治疗失败[4-5]。感染菌谱、药敏性会随时间及抗菌药物的应用而出现变化,临床明确ACI 合并HAP 病原学特点,是早期有效实施经验性治疗,积极控制感染的前提。本研究分析ACI 合并HAP 患者的病原菌分布及耐药性,旨在为临床合理应用抗菌药物提供参考。
1 资料与方法
1.1 一般资料
以本院2018年1月至2019年12月收治的206例ACI 合并HAP 患者作为研究对象,其中男127例,女79 例,平均年龄(64.35±9.67)岁,合并高血压者67 例,合并冠心病者21 例,合并糖尿病者33例。明确ACI 诊断标准[6];入院48 h 后出现咳痰、咳嗽等症状,肺部听诊有湿罗音,且至少伴以下情况之一者,a、体温≥38 ℃;b、白细胞计数≥10×109/L;c、肺部X 线、CT 扫描示炎性浸润性病变。排除标准:入组前已伴感染性疾病者;存在免疫功能缺陷者;伴肺不张、肺水肿、心力衰竭者。
1.2 方法
①标本获取:生理盐水漱口,采集晨痰送检,若痰不易咳出或痰量较少采取咽拭子取痰;昏迷患者、气管切开或插管患者采取灭菌管吸取下呼吸道分泌物或纤支镜刷检痰标本。②细菌培养及药敏试验:采取VITEK 2 Compact 全自动微生物生化鉴定仪完成病原体鉴定,每例连续2 次培养出同一病原体即确诊为感染致病原体或同一培养皿得出2 种以上病原体,且属优势生长。药敏试验采取纸片扩散法(K-B),试验药物包含头孢呋辛、头孢唑林、环丙沙星、左氧氟沙星、庆大霉素、替卡西林/克拉维酸、头孢他啶、头孢吡肟、亚胺培南、阿米卡星、头孢替坦、妥布霉素、哌拉西林/他唑巴坦、青霉素、氨苄西林、头孢曲松、苯唑西林、头孢哌酮/舒巴坦、万古霉素等。药敏分析按中华人民共和国国家卫生健康委员会官网公布中国卫生行业标准-抗菌药物敏感性试验的技术要求标准执行。
1.3 观察指标
①统计病原菌分布情况。②2018~2019年病原菌变迁情况。③分析革兰阴性菌耐药性。④分析主要革兰阳性菌耐药性。
2 结果
2.1 病原菌分布情况
206 例急性脑梗死合并医院获得性肺炎患者,共分离出272 株病原菌,包含革兰阴性菌202 株,占74.26%;革兰阳性菌63 株,占23.16%;真菌7株,占2.57%,见表1。
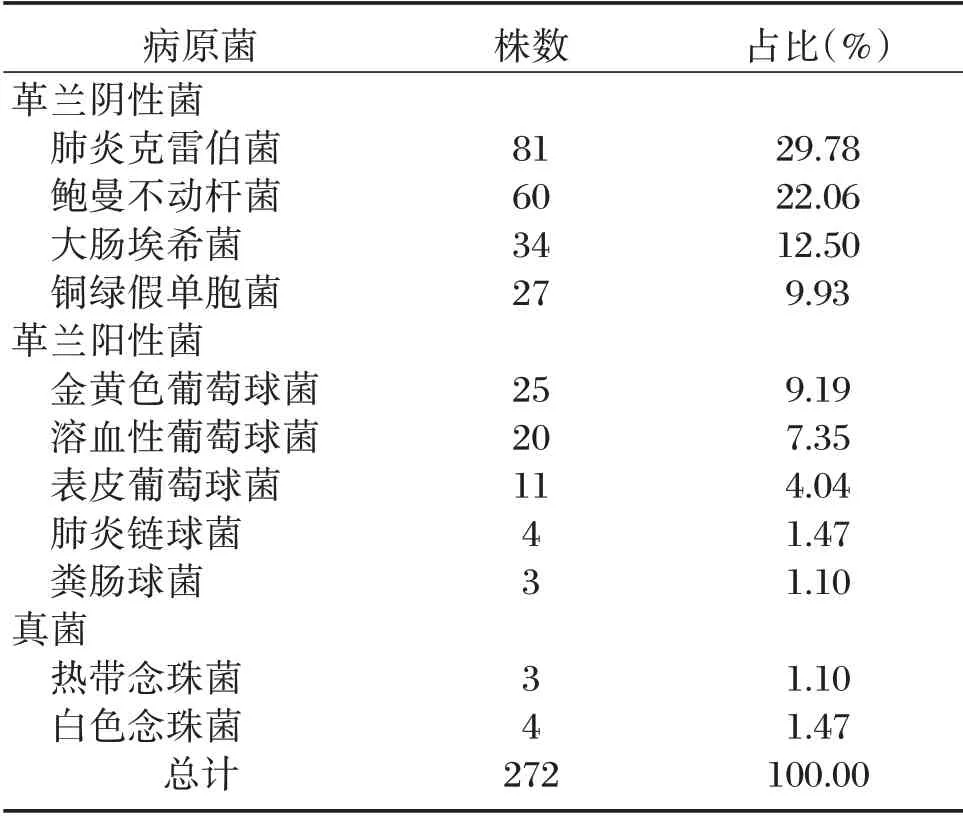
表1 病原菌分布情况Table 1 Distribution of pathogens
2.2 2018~2019年病原菌变迁情况
2018年病原菌以革兰阴性菌为主,占75.15%;革兰阳性菌次之,占22.42%,真菌占2.42%,前五位病原菌分别为肺炎克雷伯菌、鲍曼不动杆菌、大肠埃希菌、铜绿假单胞菌、金黄色葡萄球菌;2019年病原菌中革兰阴性菌比例有所下降,但仍占主要地位,占72.90%;革兰阳性菌、真菌比例有所升高,分别占24.30%、3.85%,前五位病原菌分别为鲍曼不动杆菌、肺炎克雷伯菌、大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌,其中鲍曼不动杆菌替代肺炎克雷伯菌成为最主要的细菌,具体见表2、图1~2。
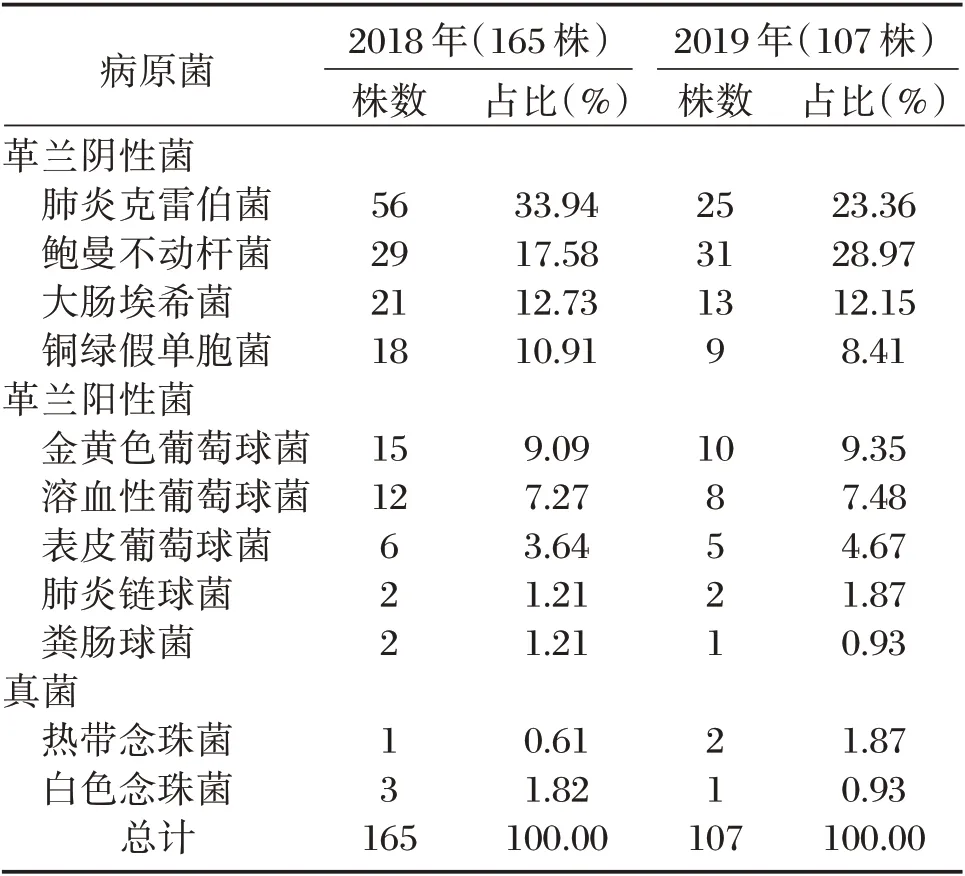
表2 2018~2019年病原菌变迁情况Table 2 Changes of pathogenic bacteria from 2018 to 2019
图1 2018年病原菌株数Figure 1 Number of pathogenic strains in 2018
2.3 革兰阴性菌耐药性
肺炎克雷伯菌对头孢呋辛、头孢唑林、环丙沙星、哌拉西林耐药率较高,鲍曼不动杆菌对哌拉西林、哌拉西林/他唑巴坦耐药率较低;大肠埃希菌对头孢呋辛、头孢唑林耐药率较高;铜绿假单胞菌对头孢呋辛、头孢唑林、头孢替坦耐药率较高。见表3。

图2 2019年病原菌株数Figure 2 Number of pathogenic strains in 2019
2.4 主要革兰阳性菌耐药性分析
金黄色葡萄球菌、溶血性葡萄球菌、表皮葡萄球菌对青霉素、氨苄西林耐药率较高,均达到90%及以上,对万古霉素无耐药性,均为0.00%,具体见表4。
3 讨论
HAP 是ACI 常见并发症之一,患病率约8%~20%[7]。ACI 合并HAP 主要机制为口咽部定植菌移位至下呼吸道所致,但口咽部定植菌种类繁多,且近年抗菌药物不规范应用致病原菌耐药性升高,提高了抗感染难度[8]。
ACI 合并HAP 具有流行病、地方病双重特征,病原谱分布依地区不同而存在一定差异,且与先期抗感染治疗、基础疾病、病原菌来源等多种因素有关,随时间变迁,病原菌谱亦发生不同变化[9]。本研究结果显示,在本院,ACI 合并HAP 致病菌主要为革兰氏阴性菌,占比74.26%。革兰阳性菌占比23.16%,真菌占比2.57%。与Baker D 等[10]报道存在一定差异,这与ACI 合并HAP 地方性特征相吻合[11]。此外,本研究还对2018-2019年病原菌变迁情况进行研究,发现2019年病原菌分布依次是革兰阴性菌、革兰阳性菌、真菌,占比分别为72.90%、24.30%、3.85%,与2018年病原菌分布75.15%、22.42%、2.42%对比,革兰阴性菌略有降低,革兰阳性菌、真菌略有升高。分析原因可能是:①临床较重视革兰阴性菌感染防控,长期应用抗菌药物致菌群紊乱,人体微生态平衡被破坏,同时造成细菌普遍性而快速出现耐药性,革兰阳性菌、真菌成为相对优势菌[12]。②ACI 患者自身生理机能降低,尤其是存在意识障碍者引起吞咽障碍致咽部分泌物、部分食物误吸诱发吸入性感染肺炎,且中枢神经系统损害多需长期卧床发生HAP 风险会显著升高。上呼吸道属致病菌第一道防线,若患者存在延髓麻痹,咳嗽反射,吸痰等侵入性操作增多可将口腔内革兰阳性菌带入下呼吸道;③已有研究证实,鼻饲是HAP 的独立危险因素[13]。胃内细菌移生会诱发HAP,有研究显示,胃液pH 与HAP 发病率关系密切,而胃内细菌除幽门螺旋杆菌外超过50%属革兰阳性菌,如葡萄球菌、链球菌等[14]。④人工气道呼吸,如气管插管、气管切开等应用呼吸机通气ACI者,易出现下呼吸道感染[15]。
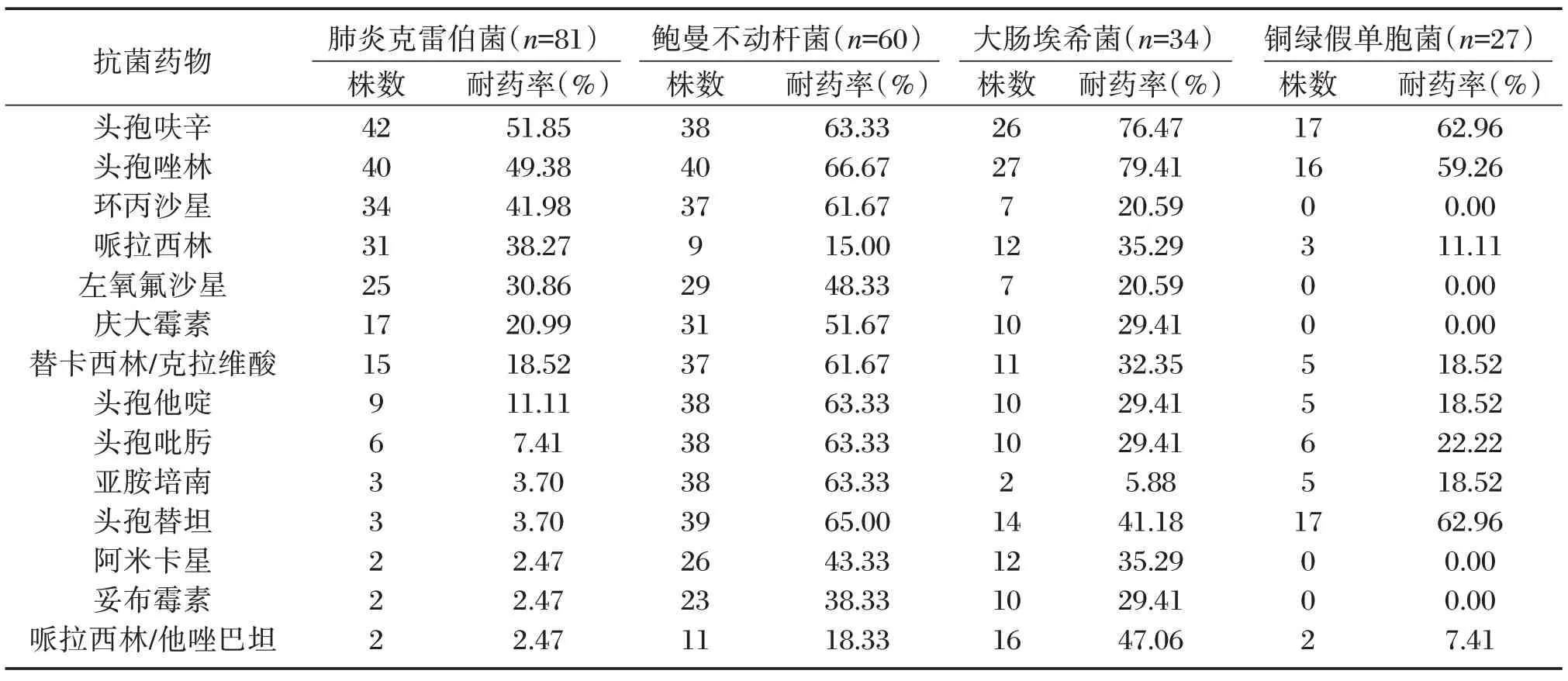
表3 革兰阴性菌耐药性分析Table 3 Analysis of drug resistance of gram-negative bacteria
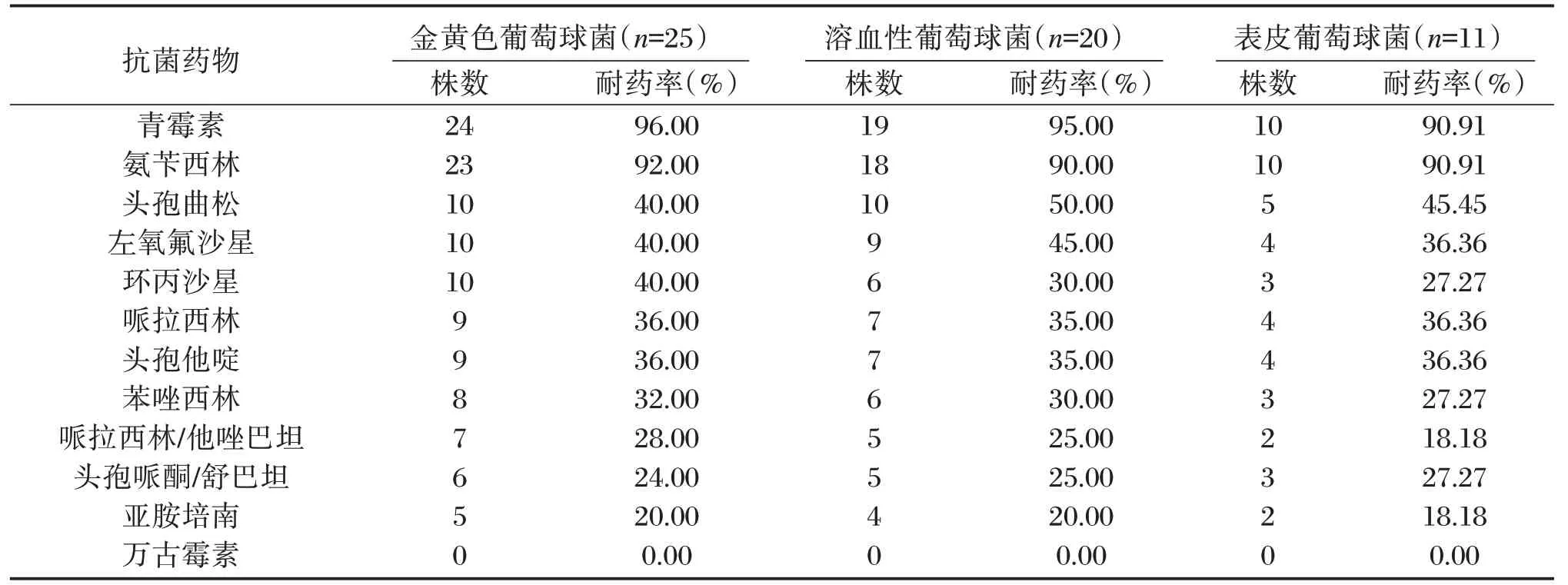
表4 主要革兰阳性菌耐药性分析Table 4 Analysis of drug resistance of main gram-positive bacteria
有研究显示,美洛培南、亚胺培南等碳青霉烯类抗生素对革兰氏阴性菌表现优越抗菌活性[16]。本研究结果显示,肺炎克雷伯菌、铜绿假单胞菌对哌拉西林/他唑巴坦具有较高敏感性。革兰氏阴性菌对头孢呋辛、头孢唑林敏感性较低。多数ACI合并HAP 感染的革兰氏阴性菌对加酶抑制剂的抗生素敏感性稍高。他唑巴坦是一种不可逆性β-内酰胺酶抑制剂,抗菌谱较替卡西林/克拉维酸广,不仅可强效抑制质粒介导β-内酰胺酶活性,且有一定染色体诱导保护作用,利于阻止耐药菌产生[17]。因此,临床选取抗菌药物时需同时兼顾药敏性及对细菌耐药基因突变选择能力方面,以延缓或避免高耐药株出现、蔓延。
综上,ACI 合并HAP 病原体以革兰阴性菌为主,且致病菌对常用抗生素均存在不同程度耐药性。
