渗透压胁迫对耐盐乳酸菌发酵特性的影响
2020-09-04毕梦迪欧阳铭珊张秀琼尹萍萍蔡林蘅李宝坤
毕梦迪,欧阳铭珊,黎 旭,张秀琼,尹萍萍,蔡林蘅,武 攀,李宝坤
(石河子大学 食品学院,新疆 石河子832000)
乳酸菌是一类能够发酵碳水化合物并且产生乳酸的无芽孢、革兰氏阳性细菌[1]。近年来,大量的研究都证实了乳酸菌具有益生特性,特别是在改善人体肠道微环境方面发挥重要作用[2-3]。食品加工过程中,特别是诸如传统发酵香肠、发酵酸鱼、火腿、酱油、奶酪、泡菜等发酵食品的制备过程中往往会加入大量的食用盐,赋予产品风味和抑制杂菌的同时延长食品的保质期[4-6],但高浓度的盐在一定程度上会抑制发酵过程中乳酸菌的生长,盐胁迫会损伤细胞膜结构,进而导致胞内各种代谢紊乱甚至细胞死亡[7-8],但是最近的研究显示,盐胁迫具有提高鼠李糖乳杆菌(Lactobacillus rhamnosus)的富硒能力的作用[9]。
新疆拥有牧草地面积约0.511亿km2,是我国重要的畜牧业大省[10],其中伊犁牧区是新疆最主要的畜牧业基地之一。新疆少数民族有收集动物乳制作发酵奶制品的传统,从牧区奶制品和环境中挖掘菌种资源并加以保护成为一项重要工作[11-12],蒋艾廷等[13]从新疆塔城传统酸奶中筛选出具有优良产酸性能的30株乳酸菌,并对其自溶度和蛋白酶活力进行了研究;金丹等[14]从新疆塔城地区酸马奶中分离了53株乳酸菌,并筛选出5株能耐受13%乙醇的乳酸菌;张亚川等[15]从新疆伊犁州乳品中初步分离纯化出71株乳酸菌,并从中筛选出3株符合酸乳发酵菌种要求的德氏乳杆菌(Lactobacillus delbrueckii)。目前研究主要集中于乳酸菌的生理特性、生理学功能及其在工业中的应用,对高渗情况下乳酸菌发酵性能的研究较少,而乳酸菌发酵剂的生产性能(包括产香性、产粘性、产酸性)和抗逆性(耐酸耐胆盐能力)直接关系到最终发酵制品的性能,同时也是影响产品质量的一个因素。
本研究利用传统分离技术从新疆牧区土壤中筛选耐盐乳酸菌,通过形态观察及分子生物学技术对其进行鉴定,并对其发酵特性,特别是在高渗环境下(7%、8%NaCl)的发酵性能(耐酸耐胆盐能力)进行研究,以期获得发酵性能好和抗逆性强的优良发酵乳酸菌菌株,为高盐发酵食品的商业发酵剂开发提供研究基础,确保发酵乳等制品有一定的活菌数,食用后能在肠道中定植。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
土样来源于新疆维吾尔自治区伊犁哈萨克自治州额敏县牧区,具体信息见表1。

表1 土样来源Table 1 Source of soil samples
1.1.2 试剂
无水乙醇(纯度≥99.7%):天津市富宇精细化工有限公司;细菌基因组总脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京天根生化科技有限公司;猪胆盐(纯度≥90%):上海麦克林生化科技有限公司;革兰氏染液:北京索莱宝生物科技有限公司。
1.1.3 培养基
MRS液(固)体培养基:青岛高科技工业园海博生物技术有限公司。含碳酸钙的MRS(CaCO3-MRS)固体培养基:MRS固体培养基中添加1.5%的碳酸钙。
1.2 仪器与设备
TC-512聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:英国Techne公司;T100 Power Pac Universal电泳仪、Universal Hood ⅡGel DOC XR凝胶成像系统:美国BioRad公司;CX21FS1光学显微镜:日本Olympus公司;LAC-5040S标准型pH计:上海精密科学仪器有限公司;Bnp-9272智能生化培养箱:上海精宏试验设备有限公司;5424R高速冷冻离心机:德国Eppendorf公司;Synergy 2多功能酶标仪:美国BIOTEK仪器有限公司。
1.3 方法
1.3.1 乳酸菌的分离
称取1.0 g土壤样品,加入10 mL无菌生理盐水,混匀,静置10 min后取上清液1 mL加至20 mL含有7% NaCl的MRS液体培养基中,37 ℃静置培养48 h。取菌液在CaCO3-MRS平板上划线,37 ℃培养48 h[16]。挑取溶钙圈较大、革兰氏染色为阳性、接触酶试验为阴性并具有乳酸菌典型形态学特征的菌落,在MRS固体培养基上再次划线分离纯化后斜面保存备用[17]。
1.3.2 筛选耐盐乳酸菌的筛选
将分离纯化得到的乳酸菌菌株进行活化并培养16~18 h后,以2%(V/V)的接种量分别接种至NaCl含量为7%、8%、9%、10%的MRS肉汤培养基中,37 ℃培养24 h,通过培养基浑浊情况的变化筛选出耐盐乳酸菌[18]。
1.3.3 耐盐乳酸菌的分子生物学鉴定
根据DNA提取试剂盒说明书步骤提取目标耐盐乳酸菌菌株的DNA,以其为模板,采用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')对筛选菌株的16S rDNA序列进行PCR扩增。PCR扩增体系:10×Buffer 2.5 μL,10 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)0.5 μL,10 μmol/L引物各0.5 μL,Taq酶1.25 U,模板2 μL,双蒸水(ddH2O)定容至25 μL。PCR扩增程序:95 ℃预变性10 min;95 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,34个循环;72 ℃再延伸10 min。采用1%琼脂糖凝胶电泳检测PCR扩增产物特异性。将电泳检测合格的PCR扩增产物送至上海生工生物有限公司进行测序。将测序基因序列提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对分析,选取同源性较高的模式菌株的16S rDNA序列,采用软件Mega5.0构建系统发育树。
1.3.4 筛选菌株在高渗环境下的生长曲线和产酸能力
按2%的接种量将活化培养至对数生长末期的菌株分别接种于含7%、8%NaCl的MRS肉汤培养基中,37 ℃恒温培养48 h,每隔2 h取样在波长600 nm条件下测定样品的OD600nm值和pH值,绘制乳酸菌的生长曲线和产酸曲线。
1.3.5 筛选菌株在高渗环境下的耐酸、耐胆盐胁迫能力
耐酸性能的测定:将活化好的筛选菌株按2%的接种量分别接种到含7%、8%NaCl,pH值为3.0、4.6的MRS液体培养基中,37 ℃条件下培养48 h,每隔2 h取样在波长600 nm条件下测定样品的OD600nm值,绘制乳酸菌的生长曲线,并且每隔2 h取样,测定pH值,绘制产酸变化曲线。
耐胆盐性能的测定:将活化好的筛选菌株按2%的接种量分别接到含7%、8% NaCl,0.10%、0.15%胆盐的MRS液体培养基中,37 ℃条件下培养48 h,每隔2 h取样在波长600 nm条件下测定样品的OD600nm值,绘制乳酸菌的生长曲线,并且每隔2 h取样,测定pH值,绘制产酸变化曲线。
1.3.6 筛选菌株耐盐性能的测定
将培养至对数末期的菌液,按2%的接种量分别接种于含10%和12%NaCl的MRS液体培养基中,37 ℃条件下胁迫3 h后进行涂布于MRS固体培养基,37 ℃培养48 h后进行菌落计数(N),同时对接种液进行菌落计数(N0),计算存活率,其计算公式如下:

2 结果与分析
2.1 耐盐乳酸菌菌株的分离与筛选
从27个土壤样品中共分离纯化得到64株疑似乳酸菌,通过筛选共获得4株耐盐乳酸菌,编号分别为a、b、c、d。4株乳酸菌均能在含8%NaCl的MRS液体培养基中生长,其中菌株c能够在含9%NaCl的MRS液体培养基中生长,在含10%NaCl的MRS液体培养基中4株菌的生长被明显抑制。
2.2 耐盐乳酸菌菌株的鉴定
2.2.1 形态观察
对筛选出的4株耐盐乳酸菌菌株进行形态学观察,结果见图1。

图1 耐盐乳酸菌的菌落形态及细胞形态Fig. 1 Colony and cell morphology of salt tolerant lactic acid bacteria
由图1可知,在MRS固体培养基上,4株耐盐乳酸菌的菌落均呈乳白色,并且中央隆起具有湿润表面,边缘整齐,呈乳白色,革兰氏染色结果均为阳性,个体微小,周身无鞭毛与芽孢,符合乳酸菌基本特征。
2.2.2 分子生物学鉴定
4株耐盐乳酸菌菌株的系统发育树见图2。

图2 基于16S rDNA基因序列耐盐乳酸菌菌株的系统发育树Fig. 2 Phylogenetic tree of salt tolerant lactic acid bacteria based on 16S rDNA gene sequences
由图2可知,菌株a、b、c与海氏肠球菌(Enterococcus hirae)聚于一支,亲缘关系最近;菌株d与植物乳杆菌(Lactobacillus plantarum)聚于一支,亲缘关系最近,因此鉴定菌株a、b、c均为为海氏肠球菌(Enterococcus hirae),菌株d为植物乳杆菌(Lactobacillus plantarum)。
2.3 耐盐乳酸菌的发酵特性
2.3.1 耐盐乳酸菌的生长特性
邬慧颖[19]研究盐胁迫响应基因对菌体分裂增殖的影响结果发现,盐胁迫响应基因膜转运体基因feoA的缺失会使迟滞期被延长并影响菌体的分裂增殖。由图3可知,L.plantarumdd在7%NaCl含量下的最终OD600nm值为1.866,而在8% NaCl含量下的最终OD600nm值为0.760,E. hiraea、b、c在7%NaCl含量下的最终OD600nm值分别为0.898、0.773、0.873,而在8%NaCl含量下的最终OD600nm值分别为0.105、0.086、0.117,结果表明,随着NaCl含量的增加,各菌株的生长受到了不同程度的抑制,其中L.plantarumdd的生长特性相对于其他三株更好,E.hiraea、b、c差别不大。

图3 在NaCl含量7%(a)及8%(b)条件下耐盐乳酸菌的生长曲线Fig. 3 Growth curves of salt tolerant lactic acid bacteria under 7% (a)and 8% (b) NaCl concentration conditions
2.3.2 耐盐乳酸菌的产酸特性
由图4可知,随着NaCl含量的升高,各菌株的产酸速率明显降低。L.plantarumd在7%NaCl含量下的最终pH值为3.48,在8%NaCl含量下的最终pH值为3.79,E.hiraea、b、c在7%NaCl含量下的最终pH值分别为4.01、4.08、3.97,而在8%NaCl含量下的最终pH值分别为4.99、5.09、4.63,结果表明,随着NaCl含量的增加,各菌株的产酸受到了不同程度的抑制。其中L.plantarumdd的产酸特性相对于其他三株更好,E.hiraea、b、c差别不大。

图4 耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的产酸曲线Fig. 4 Acid production curves of salt tolerant lactic acid bacteria under 7% (a) and 8% (b) NaCl concentration conditions
2.3.3 耐盐乳酸菌的耐酸性能研究

图5 pH3.0时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的生长曲线Fig. 5 Growth curves of salt tolerant lactic acid bacteria under 7% (a)and 8% (b) NaCl concentration conditions at pH 3.0

图6 pH4.6时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的生长曲线Fig. 6 Growth curves of salt tolerant lactic acid bacteria under 7% (a)and 8% (b) NaCl concentration conditions at pH 4.6
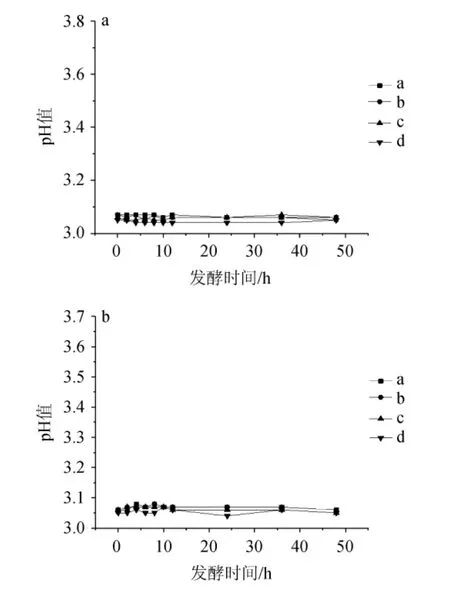
图7 pH3.0时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的产酸曲线Fig. 7 Acid production curves of salt tolerant lactic acid bacteria under 7% (a) and 8% (b) NaCl concentration conditions at pH 3.0
由图5可知,在7%和8%NaCl含量下,E.hiraea、b、c和L.plantarumd在pH 3.0的酸性环境,均未出现明显的生长。结果表明,在pH 3.0的酸性环境,7%和8% NaCl含量下,E.hiraea、b、c和L.plantarumd 生长均受到明显抑制。
由图6可知,在7%和8%NaCl含量下,L.plantarumd比E.hiraea、b、c更适应pH 4.6的酸性环境,出现明显的生长,同时8%NaCl含量使E.hiraea、b、c和L.plantarumd的生长受到抑制。
由图7可知,在7%和8%NaCl含量下,pH 3.0的酸性环境中E.hiraea、b、c和L.plantarumd几乎不产酸,生长受到明显抑制。

图8 pH4.6时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的产酸曲线Fig. 8 Acid production curves of salt tolerant lactic acid bacteria under 7% (a) and 8% (b) NaCl concentration conditions at pH 4.6
由图8可知,产酸情况的变化也应证了OD600nm值的变化结果,在7%和8%NaCl含量下,pH 4.6的酸性环境中E.hiraea、b均在24 h开始产酸,但pH下降幅度不大。E.hiraec几乎不产酸,生长受到明显抑制。L.plantarumd在培养2 h后pH值开始迅速降低,36 h后逐渐停止产酸,最终pH值分别下降至3.42和3.56。
结果表明,在7%、8%NaCl胁迫下,L.plantarumd的酸耐受性较好。
2.3.4 耐盐乳酸菌的耐胆盐性能研究
乳酸菌需能够耐受胃液中的强酸与肠道内的高浓度胆盐,并在人体内大量存活才能发挥其益生作用[20]。由图9可知,在0.10%胆盐胁迫下,在7%和8%NaCl含量条件下,E.hiraea、b、c具有较好的胆盐胁迫抗性,且均在培养24 h达到对数生长末期,而L.plantarumd未有明显生长趋势。海氏肠球菌中E.hiraec抗性最好,E.hiraeb最差,0.10%的胆盐对L.plantarumd的抑制作用明显。

图9 0.10%胆盐时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的生长曲线Fig. 9 Growth curves of salt tolerant lactic acid bacteria under 7% (a)and 8% (b) NaCl concentration conditions at 0.10% bile salt

图10 0.15%胆盐时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的生长曲线Fig. 10 Growth curves of salt tolerant lactic acid bacteria under 7% (a)and 8% (b) NaCl concentration conditions at 0.15% bile salt
由图10可知,4株菌在0.15%胆盐中的生长趋势与在0.10%胆盐中类似,海氏肠球菌均能生长而植物乳杆菌L.plantarumd未有明显生长趋势,但值得指出的是,E.hiraec在7%NaCl含量下的生长速度和对胆盐的抗性要明显优于E.hiraea和E.hiraeb,而在8%NaCl含量下E.hiraec没有表现出类似的优势,这说明在面对胆盐胁迫时,NaCl含量的改变可能会影响到菌株的胁迫抗性。
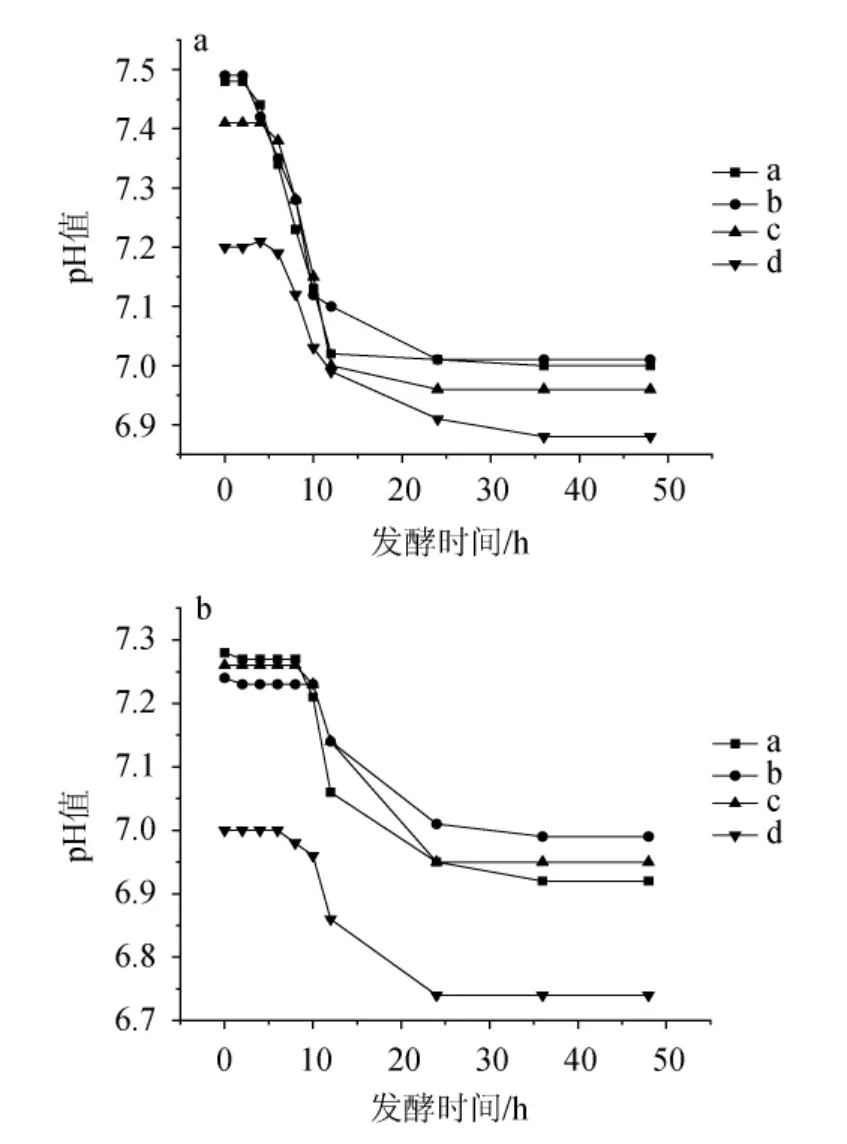
图11 0.10%胆盐时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的产酸曲线Fig. 11 Acid production curves of salt-tolerant lactic acid bacteria under 7% (a) and 8% (b) NaCl concentration conditions at 0.10% bile salt
由图11可知,在0.10%胆盐的环境中,E.hiraea、b在7%NaCl含量下培养2 h后产生大量有机酸,pH值迅速下降,12 h左右pH值趋于稳定;在8%NaCl含量下,培养10 h左右pH值迅速下降,12~24 h期间,pH值的下降速率明显减小。E.hiraec在7%NaCl含量下,培养6 h左右pH值迅速下降,24 h时产酸停止;在8%NaCl含量下,培养8 h左右pH值迅速下降,24 h左右产酸停止。L.plantarumd在7%和8%NaCl含量下产酸性能均优于海氏肠球菌,但是在8%NaCl含量时,产酸在培养24 h后即停止。
由图12可知,在0.15%胆盐的环境中,7%NaCl含量下,E.hiraea、b在8 h左右pH值开始下降,24 h产酸停止;在8%NaCl含量下,E.hiraea、b、c的产酸曲线几乎相同,12 h开始产酸,pH值迅速下降,24h左右pH值下降减缓。L.plantarumd在7%NaCl含量下,8 h左右pH值迅速下降,与其他3株菌不同的是12 h左右产酸停止,而在8%NaCl含量下,其延滞时间比海氏肠球菌更短。

图12 0.15%胆盐时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的产酸曲线Fig. 12 Acid production curves of salt-tolerant lactic acid bacteria under 7% (a) and 8% (b) NaCl concentration conditions at 0.15% bile salt
结果表明,在7%、8%NaCl胁迫下,E.hiraea、b、c胆盐耐受性较好。
2.4 耐盐乳酸菌的耐盐性能研究
对筛选出的耐盐乳酸菌分别用10%与12%的NaCl胁迫3 h,进一步考察其对NaCl的耐受性,结果见图13。由图13可知,4种耐盐乳酸菌对盐的耐受性差异显著(P<0.05)。在10%的NaCl含量下,E.hiraea、b、c、L.plantarumd的存活率分别为45.89%、60.69%、47.34%、41.58%;在12%的NaCl含量下,E.hiraea、b、c、L.plantarumd的存活率分别为43.72%、56.13%、39.24%、35.70%。由此可知,E.hiraeb对盐的耐受性最好,E.hiraec和E.hiraea次之,L.plantarumd对盐的耐受性最差。

图13 耐盐乳酸菌对盐的耐受性Fig. 13 Tolerance of salt tolerant lactic acid bacteria to salt
3 结论
从新疆维吾尔自治区伊犁哈萨克自治州额敏县的土壤样品中分离出64株乳酸菌,从中筛选出4株耐盐乳酸菌(a、b、c及d),通过形态观察及分子生物学技术鉴定菌株a、b及c均为海氏肠球菌(Enterococcus hirae),菌株d为植物乳杆菌(Lactobacillus plantarum)。在高盐胁迫(7%、8%NaCl)下,L.plantarumd的生长特性、产酸及耐酸性能最好,但耐胆盐能力最差,E.hiraea、b、c的耐胆盐胁迫能力更佳;在10%和12%的NaCl含量下胁迫3 h,4株菌的存活率均能维持在36%以上,其中E.hiraeb的耐盐能力最佳,存活率最高。
