脉冲电磁场抗骨质疏松作用及对Smurf1表达的影响
2020-09-04孙智路尹剑黄开亮谭位华刘静
孙智路 尹剑 黄开亮 谭位华 刘静
1.南华大学附属第一医院急诊部,湖南 衡阳 421001
2.南华大学附属第一医院康复医学科,湖南 衡阳 421001
骨质疏松症(osteoporosis,OP)是由多种原因导致的骨密度和骨质量下降,可引发全身性骨折[1]。目前临床治疗OP仍以药物缓解症状为主,雌激素及其受体调节剂、双膦酸盐、降钙素等药物对OP患者的骨丢失症状有一定抑制作用,但大多疗程长,有较多副作用[2-3]。近来多项研究[2,4]表明,脉冲电磁场(pulsed electromagnetic field,PEMF)可有效治疗OP,刺激骨形成,提高骨密度,改善骨强度,且该治疗方法为生物物理手段,副作用小,然而其具体作用机制尚不完全明确。泛素-连接酶E3中Smad泛素化调节因子1(Smad ubiquitin regulator 1,Smurf 1)是泛素连接酶Hect家族新成员,可独立诱导Smad1、Smad5泛素化及降解,与OP发生发展及骨代谢异常密切相关[5-9]。基于此,本研究以去卵巢骨质疏松(ovariectomy osteoporosis,OVX-OP)大鼠为模型,探究PEMF对OVX-OP大鼠的治疗作用及对Smurf1蛋白表达的影响,以期揭示其可能作用机制。现报道如下。
1 材料与方法
1.1 材料
1.1.1实验动物:选取6月龄SPF级未孕雌性SD大鼠43只(货号:J001),体重(300±10)g,购自南京君科生物工程有限公司。饲养条件:室温(24±2)℃、湿度(50±10)%,12 h/12 h光照/黑暗,自由饮水饮食环境下适应性饲养1周。本研究经本院动物实验伦理委员会批准。
1.1.2主要试剂及仪器:苯甲酸雌二醇注射液(批准文号:国药准字H44023822)购自广州白云山明兴制药有限公司;戊巴比妥钠(批准文号:国药准字H31021724)购自上海上药新亚药业有限公司;盐酸四环素荧光染料(货号:0422-100G)购自浙江联硕生物科技有限公司,钙黄绿素荧光染料(货号:FS1162)购自上海复申生物科技有限公司;蛋白抽提试剂盒(货号:P0028)、BCA蛋白定量试剂盒(货号:P0010S)均购自上海碧云天有限公司;一抗鼠源anti-Smurf1抗体(货号:ab57573)、兔源anti-β-actin(货号:ab8227)、二抗羊抗兔IgG(货号:ab6721)、羊抗鼠IgG(货号:ab205719)抗体购自英国Abcam公司;FC酶标仪购自美国Thermo Fisher公司;双能X射线实验动物骨密度测定仪(型号:InAlyzer,韩国)购自佰泰科技有限公司;Union2000型PEMF骨质疏松治疗仪(大鼠型)、半自动图像数字化分析仪购自日本尼康公司等。
1.2 方法
1.2.1模型建立:将43只大鼠用2 %戊巴比妥钠(0.2 mL/100 g)经腹腔注射麻醉后,在严格无菌条件下取腰背椎后侧正中切口,钝性分离肌肉组织,摘除33只大鼠两侧卵巢组织,逐层缝合创口,术后青霉素连续注射3 d。其中麻醉致死1只,术后创口感染致死2只,共存活30只,术后6 d将大鼠随机分为模型组(M组)、雌激素治疗组(E组)和PEMF组,每组10只。另10只大鼠只切除卵巢周围与卵巢大小相仿的脂肪组织,为假手术组(S组)。术后各组大鼠分笼饲养,在室温(24±2)℃、湿度(50±10)%、定期紫外线消毒和通风、12 h间隔照明条件下,自由摄取标准饲料和消毒的蒸馏水。术后8周除假手术组外的其他各组大鼠右肱骨骨密度显著降低,提示骨质疏松动物模型造模成功。E组于术后9周采用苯甲酸雌二醇注射液(0.2 mg/kg)进行皮下注射,每两周1次;PEMF组于术后9周采用Union 2000型PEMF骨质疏松治疗仪(大鼠型)进行治疗,设置参数:8 Hz,自动跳转周期为30 s,最大感应磁场强度3.82 mT,每次40 min,1次/d;S组、M组常规饲养,不予以任何处理。治疗8周后,进行相关数据采集及检测。
1.2.2一般状态观察:治疗期间观察各组大鼠生存状态、饮食情况等,称取治疗前后各组大鼠体重。
1.2.3右肱骨骨密度检测:治疗结束后,采用2%戊巴比妥(0.2 mL/100 g)对各组大鼠行腹腔注射麻醉后置于双能X射线实验动物骨密度测定仪平台上,测定其右肱骨骨密度。
1.2.4骨形态计量学检测:大鼠处死前第13、14天分别于皮下注射四环素(25 mg/kg)作为第一次荧光标记,注射后第3、4天分别于皮下注射钙黄绿素(5 mg/kg)作为第二次荧光标记。治疗结束后,采用2%戊巴比妥(0.2 mL/100 g)对各组大鼠行腹腔注射麻醉处死,取右前肢,剔除肌肉及软组织,取适量骨膜于液氮中冻存备用。另继续完整取出胫骨,沿纵面锯开,进行不脱钙骨包埋。采用半自动图像数字化分析仪对胫骨上1/3作静态检测。静态参数包括:骨体积分数(trabecular bone volume ratio,BV/TV)、骨小梁数(trabecular number,Tb.N)、骨小梁厚度(trabecular thickness,Tb.Th)和骨小梁分离度(trabecular separation,Tb.Sp)。
1.2.5骨组织Smurf 1蛋白表达量检测:采用免疫印迹(western blot,WB)检测各组大鼠骨组织Smurf 1蛋白表达量。严格按照蛋白提取试剂盒说明提取收集的各组大鼠骨膜组织总蛋白,并采用BCA蛋白定量试剂盒检测蛋白浓度。蛋白样品进行6 % SDS-PAGE电泳,PVDF膜转膜,5%脱脂奶粉室温封闭2 h,添加anti-Smurf1(稀释比1∶500)、anti-β-actin(稀释比1∶500)抗体4 ℃孵育过夜。TBST缓冲液洗膜,添加二抗IgG(稀释比1∶5 000)室温孵育1 h,按上述方法洗膜,显色,曝片,观察结果并拍照分析各蛋白条带灰度值,分别以靶蛋白Smurf 1灰度值与内参β-actin灰度值比值为Smurf 1蛋白相对表达量。
1.3 统计学处理

2 结果
2.1 各组大鼠一般情况比较
与S组比较,M组、E组、PEMF组大鼠精神状况欠佳,饮食、活动及大小便未见异常。治疗前,与S组比较,M组、E组、PEMF组大鼠体重均明显增加(P<0.05)。治疗后,E组、PEMF组大鼠体重较治疗前均显著降低(P<0.05);与S组比较,M组大鼠体重显著增加(P<0.05);与M组比较,E组、PEMF组大鼠体重显著降低(P<0.05);E组与PEMF组比较,大鼠体重差异无统计学意义(P>0.05)。详见表1。
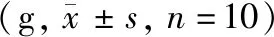
表1 各组大鼠治疗前后体重比较Table 1 Comparison of weight of rats in each group before and after treatment (g,
2.2 各组大鼠骨密度值比较
治疗前,与S组比较,M组、E组、PEMF组大鼠骨密度值显著降低(P<0.05);治疗后,E组、PEMF组大鼠骨密度值较治疗前显著升高(P<0.05);与S组比较,M组大鼠骨密度值显著降低(P<0.05);与M组比较,E组、PEMF组大鼠骨密度值显著增加(P<0.05);E组与PEMF组比较,大鼠骨密度值差异无统计学意义(P>0.05)。详见表2。
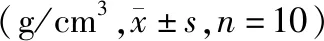
表2 各组大鼠治疗前后骨密度值比较Table 2 Comparison of bone mineral density of rats in each group before and after treatment
2.3 各组大鼠形态计量学结果比较
与S组比较,M组大鼠BV/TV、Tb.N、Tb.Th显著降低(P<0.05),Tb.Sp显著增加(P<0.05);与M组比较,E组、PEMF组大鼠BV/TV、Tb.N、Tb.Th显著升高(P<0.05),Tb.Sp显著降低(P<0.05);E组与PEMF组比较,大鼠BV/TV、Tb.N、Tb.Th、Tb.Sp差异无统计学意义(P>0.05)。详见表3。

表3 各组大鼠形态计量学结果比较Table 3 Comparison of morphometric results of rats in each group
2.4 各组大鼠骨组织Smurf1蛋白表达量比较
与S组比较,M组大鼠骨组织Smurf1蛋白表达量显著升高(P<0.05);与M组比较,E组、PEMF组大鼠骨组织Smurf1蛋白表达量显著降低(P<0.05);E组与PEMF组比较,大鼠骨组织Smurf1蛋白表达量差异无统计学意义(P>0.05),详见图1、表4。
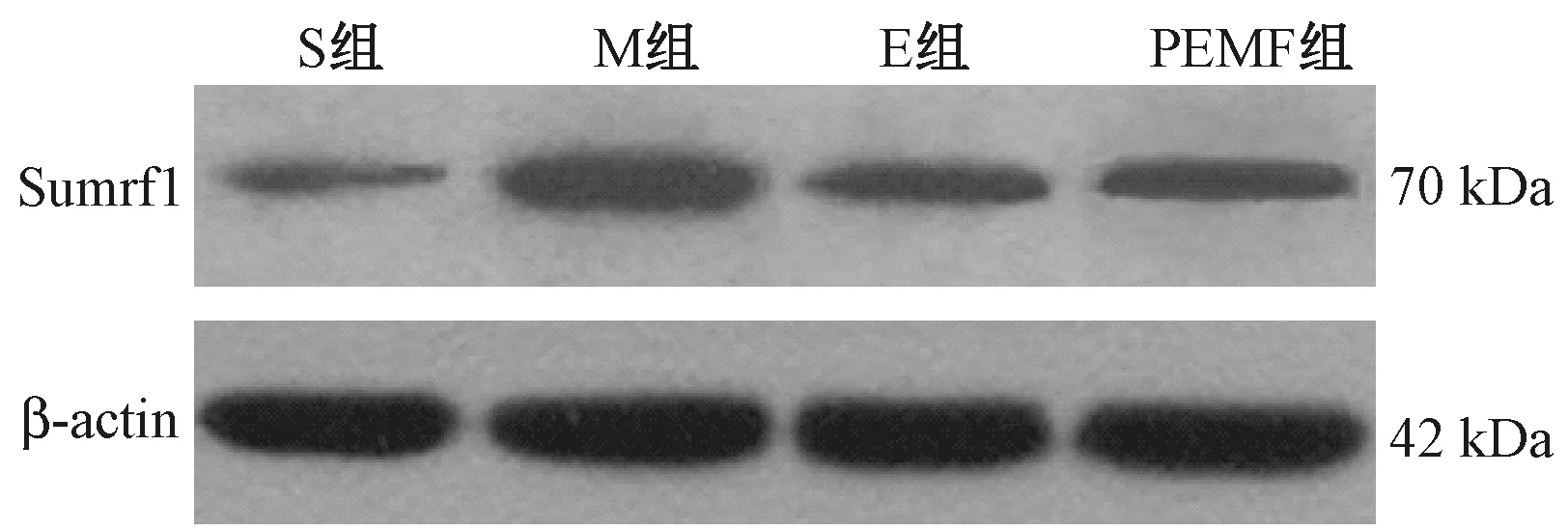
图1 WB检测大鼠骨组织Smurf1蛋白表达量Fig.1 WB detection of Smurf1 protein expression in rat bone

表4 各组大鼠治疗后骨组织Smurf1蛋白表达量比较Table 4 Comparison of Smurf1 protein expression in bone tissue of rats in each group after treatment
3 讨论
本研究采用大鼠OVX-OP模拟原发性OP,摘除卵巢后,大鼠体内雌激素显著降低,可引起破骨细胞凋亡减少,成骨细胞凋亡增加,发生OP[11]。目前国内外研究发现,PEMF对促进骨形成、抑制骨吸收、改善骨密度具有重要作用,可有效治疗OP。Lei等[13]研究报道,PEMF可提高OVX-OP小鼠椎体骨量,增强其骨结构及骨强度,与OVX组比较,OVX+PEMF组骨形成标志物骨特异性碱性磷酸酶(bone isoenzyme alkaline phosphatase,BALP)、血清骨钙素(osteocalcin,OCN)、骨保护素(osteoprotegerin,OPG)、I型前胶原n端前肽(N-terminal propeptide of type I procollagen,P1NP)明显升高,腰椎小梁骨质量下降和小梁骨显微结构的恶化减轻,可能与Wnt3a/LRP5/β-catenin和OPG/RANKL/RANK信号通路骨骼基因表达有关。刘西纺等[2]研究报道,极低频脉冲电磁场结合全身振动治疗可提高废用性OP大鼠骨密度,改善骨小梁微结构,提高骨生物力学性能,两者有协同作用,治疗效果优于单一治疗。本研究结果发现,与S组比较,M组大鼠骨密度值、BV/TV、Tb.N、Tb.Th显著降低,Tb.Sp显著增加;与M组比较,E组、PEMF组大鼠骨密度、BV/TV、Tb.N、Tb.Th显著升高,Tb.Sp显著降低,与文献报道一致;E组与PEMF组比较,各指标差异无统计学意义,BV/TV可反映骨量变化,Tb.Sp可反映骨小梁的显微结构,提示PEMF可增加骨密度、改善骨形态,与雌激素的作用相似,对OP具有一定治疗作用,提示PEMF在OP的治疗中可能有雌激素样作用。
泛素-蛋白水解酶复合体通路(ubiquitin-proteolytic pathway,UPP)是一种特异性降解胞内调控蛋白的主要途径,具有ATP依赖性,主要由泛素、泛素连接酶和26S蛋白水解酶复合体组成[14]。Smurf1是一种泛素连接酶,具有HECT结构域,属于泛素连接酶Hect家族新成员,在骨形成、胚胎发育和肿瘤发生的调控中发挥重要作用[15]。Smurf1还可优先与Smad1、5接头区域的PPXY结构域结合,诱导其泛素化和降解,而Smad可通过介导转化生长因子-β(transforming growth factor-beta,TGF-β)或骨形态发生蛋白(bone morphogenetic protein,BMP)参与骨形成和骨吸收等骨代谢调节[16-20]。Liang等[21]研究报道,抑制成骨细胞中Smurf1表达可促进年龄相关性骨质疏松小鼠模型的骨形成。尚德阳等[22]研究报道,与正常组、假手术组比较,OVX-OP大鼠骨、肾组织中Smurf1/Smurf2 mRNA表达明显降低,下丘脑中表达升高,补肾中药可改善Smurf1/Smurf2 mRNA表达,防治骨质疏松。本研究结果发现,与S组比较,M组大鼠骨组织Smurf1蛋白表达量显著升高;与M组比较,E组、PEMF组大鼠骨组织Smurf1蛋白表达量显著降低,与尚德阳等文献报道[22]不完全一致,与Liang、Zhang等文献报道一致[21,23]。Smurf1蛋白调控骨形成可能存在不同机制,综合文献报道及本研究结果,提示骨组织Smurf1蛋白表达量升高可能与骨质疏松症有关。PEMF可促进骨形成、增加骨密度,防治骨质疏松,可能与骨组织Smurf1蛋白表达下调有关,但有待进一步验证。
综上所述,PEMF可增强骨形成,提高OP大鼠骨密度,改善其骨丢失症状,发挥抗骨质疏松作用,可能与Smurf1蛋白下调表达有关,为临床OP的治疗提供了新的思路。但本研究只是进行了初步探讨,关于Smurf1蛋白下游信号的分子机制尚不明确,还有待进一步深入探究及验证。
