洛河污泥菌群分析及去除玉米赤霉烯酮的菌种筛选鉴定
2020-09-03于思颖张静博
李 旺 于思颖 程 鹏 张静博
(河南科技大学动物科技学院,洛阳 471023)
玉米赤霉烯酮(Zearalenone, ZEN)是一种特殊的生物毒素,属于二羟基苯甲酸内酯类植物雌激素,最早从发霉的玉米中分离获得的,它主要是由镰刀菌属真菌产生[1]。高低温度的交替变化和较高的湿度是感染此类真菌并产生ZEN的主要原因,玉米、小麦及大豆等粮食和饲料作物一旦感染此类真菌便会含有大量玉米赤霉烯酮而具有毒性[2]。季海霞等[3]2015对收获并入库的饲用玉米进行取样调查,结果显示全国大部分玉米中玉米赤霉烯酮检出率100%。Li等[4]连续3年调查显示中国玉米、玉米副产物及饲料产品均受到不同程度的玉米赤霉烯酮污染。玉米赤霉烯酮对动物和人类的毒性主要有生殖发育毒性、致畸致癌毒性、免疫毒性、肝肾毒性以及内分泌系统毒性等[5,6]。如果不能有效控制和去除饲料和粮食中的ZEN,再好的动物品种和饲养方案也不能发挥最大的养殖潜力,人类健康计划也会因粮食被ZEN污染而受到影响[7]。
自20世纪60年代初的首例霉菌中毒报告以来,全世界的研究人员都在研究如何有效地减少霉菌毒素带来的不良反应。然而,现有的技术手段,仍然很难对ZEN进行有效的预测和防止[8]。目前,去除ZEN的方法有物理方法,如热处理法、辐照法、吸附法;化学法,如臭氧、双氧水、碳酸钠等与玉米赤霉烯酮产生化学反应;物理法和化学法存在不易操作或破坏原料营养价值引起二次污染等弊端[9,10]。生物去除法是利用微生物产生的特异性的酶对玉米赤霉烯酮分解或者通过微生物及代谢物对毒素进行吸附。酶具有很强的专一性,不会对粮食和饲料等造成新的污染,也不会影响受污染饲料等的营养价值[11]。因此生物去除法成为脱毒、解毒研究的热门话题[12,13]。已有报道显示,去除玉米赤霉烯酮的微生物广泛存在于自然界中,但关于去除玉米赤霉烯酮的相关研究多是对单菌的筛选,对去除菌中的种群研究较少[14,15]。因此,本实验对洛河污泥样品进行去除菌种群的分析,弄清同一个区域内存在哪些毒素去除菌种及其去除能力,改良筛选策略,为后续筛选出高效玉米赤霉烯酮去除菌种和组合应用这些菌种准备材料。
1 材料与方法
1.1 材料
1.1.1 样品及来源
污泥样品:采自洛河河道枯草密集区域的河道表层至深10 cm处,随机从10个样点采集污泥样品,密封冷藏于实验室备用。
1.1.2 培养基
MRS培养基:葡萄糖4 g,胰蛋白胨2 g,酵母提取物1 g,牛肉膏2 g,MnSO4·4H2O 0.076 g,MgSO4·7H2O 0.04 g,Tween-80 0.2 mL,K2HPO40.4 g,柠檬酸胺0.4 g(固体培养基加琼脂粉3.2 g),无菌水200 mL,pH 6.2~6.4。
LB培养基:胰蛋白胨2 g,酵母提取物1 g,氯化钠2 g(固体培养基加琼脂粉3.2 g),无菌水200 mL,pH 7.0~7.2。
NA培养基:牛肉膏0.6 g,蛋白胨2 g,氯化钠1 g,无菌水200 mL(固体培养基加琼脂粉3.2 g),pH 7.2。
在各培养基中,添加5 μg/mL的玉米赤霉烯酮纯品,用以做底物筛选去除菌种。
1.1.3 主要试剂
细菌基因组提取试剂盒、玉米赤霉烯酮ELISA检测试剂盒、ZEN标准品(浓度>95%),其他生化试剂和化学试剂均为分析纯。
1.2 方法
1.2.1 污泥样品宏基因组测序分析
细菌基因组DNA的提取与质量检测:将10个污泥样品各取1 g样品混合均匀,按照细菌基因组提取试剂盒说明抽提总DNA,并对其进行质量检测;DNA样本检测合格后,将其随机片段化并筛选合适大小的插入片段进行文库构建;构建好的文库经过质检合格后,使用Qubit3.0、QPCR和Qseq100精确定量,最后上机测序。
测序获得的基因进行分类,在NR数据库进行BLAST比对,比对到的物种,采用LCA(lowest common ancestor)算法,由种级别的分类向上追溯至第一个出现的公共分类级别,以此作为其注释信息。统计样本中注释到各物种分类层级上的数量,并分析。
1.2.2 ZEN去除菌种的筛选与鉴定
在超净台中将10 g污泥样品放入90 mL无菌水混合于150 mL三角瓶中,封口膜封口,置于摇床上震荡30 min,配置10-1、10-2两种稀释梯度,取50 μL稀释液滴在MRS、NA、LB等培养基上,用涂布棒将菌液在培养基上涂抹均匀,将各种培养基在37 ℃,厌氧和好氧条件下培养24~48 h,初筛微生物。筛选到微生物后,观察菌落特征,革兰氏染色,观察菌体特征后,编号保存。
参照细菌基因组提取试剂盒说明书,提取所筛选菌种基因组DNA,扩增菌种的16SrDNA保守序列。对扩增产物进行测序,并通过NCBI Blast N进行保守序列的分析比对。PCR扩增体系为25 μL体系,包括2.5 μL 10×Ex Taq Buffer,2 μL dNTP,上、下游引物各1 μL,0.5 μL Ex Taq酶,1 μL模板(基因组DNA),17 μL ddH2O。PCR反应条件及程序为:预变性94 ℃ 2 min→35个循环(变性94 ℃ 30 s→复性 57 ℃ 30 s→延伸 72 ℃ 1 min 30 s)→终延伸72 ℃ 10 min→ 4 ℃保存。
1.2.3 ZEN含量测定和去除率计算
挑取固体培养基上初筛的菌落于相应的液体培养基中,好氧培养于37 ℃摇床210 r/min摇动培养18 h,厌氧方式于37 ℃培养箱中静置培养18 h,取出各菌种的培养液,冰箱冷藏保存。所筛菌种的培养液直接做待测样品,用50%甲醇溶液1∶1混合提取后,滤纸过滤。然后按照玉米赤霉烯酮ELISA检测试剂盒说明书的操作流程,测定培养液中玉米赤霉烯酮的含量,计算ZEN的去除率。
去除率=(添加ZEN—残留ZEN)/添加ZEN×100%
2 结果与分析
2.1 宏基因组文库的物种分析结果
利用宏基因组测序技术扩增污泥中微生物保守序列,并对基因序列进行相似性分析和比对,在“门”水平上与已有基因库物种中相似性大于95%水平的微生物物种共有53 890个。分属23个门,其中厚壁菌门物种基因丰度达99.4%,为主要优势微生物群落。基于“目”水平的分析,相似性大于95%水平的微生物物种基因信息共有51 911个,分属72个目,主要以芽孢杆菌目(Bacillales)和乳酸菌目(Lactobacillales)为主,分别占微生物菌株总数的64.5%和18.9%。基于“属”水平可分析,鉴定的47 683个菌株分属374个属,主要菌属为芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)、海洋芽孢杆菌属(Oceanobacillus、Amphibacillus)和双枝芽孢杆菌属(Virgibacillus),所占比例分别达为26.5%、14.9%、14.0%、11.0%,其中芽孢杆菌属包含了11 026个菌株基因信息,是最主要的属(图1黑点)。鉴定到“种”水平的微生物菌株共32 199株,属于1 568种微生物,其中枯草芽孢杆菌族(Bacillussubtilisgroup)、巨大芽孢杆菌(Bacillusmegaterium)、 达蒙海洋杆菌(Oceanobacillusdamuensis)、 植物乳杆菌(Lactobacillusplantarum)、大型海洋杆菌(Oceanobacillusmassiliensis)、蜡样芽孢杆菌族(Bacilluscereusgroup)、兼性芽孢杆菌(Amphibacillusxylanus)、枝芽孢杆菌(Virgibacilluspantothenticus)、解淀粉慢杆菌(Lentibacillusamyloliquefaciens)、短小乳杆菌(Lactobacillusbrevis)、粪肠球菌(Enterococcusfaecalis)为主要物种。其中枯草芽孢杆菌、巨大芽孢杆菌、达蒙海洋杆菌、植物乳杆菌分别包含2 188、1 794、1 568、1 487个菌株基因信息,是河道污泥中的主要菌种(图1白点)。

图1 基于属、种水平的主要菌群分析
2.2 ZEN去除菌种的筛选和鉴定分析
根据2.1的分析结果,设计和配制样品中主要微生物菌种的筛选培养基(MRS、NA、 LB),取10个样点的样品分别在固体培养基上用不同的培养方式初筛,筛选到47个菌落形态不同的优势菌株。所筛菌株在不同初筛培养基上均能较好生长,大部分菌落符合细菌的菌落特征。但在不同培养基和培养方式中,菌落形态差异较大。在MRS培养基上筛选到具有典型乳酸菌菌落特征的多个菌种,在NA培养基上筛选到具有杆菌属细菌特性的多个菌种,在LB培养基上筛选到具有芽孢杆菌菌落特征的多个菌种。挑取培养基上典型菌落进行革兰氏染色结果如图2所示。革兰氏染色结果显示,所筛菌种绝大部分为革兰氏阳性菌,杆状、球状和梭状形态为主,由于培养时间较短,菌体未见明显芽孢。

注:a为MRS培养基所筛典型菌种,b为NA培养基所筛典型菌种,c为LB培养基所筛典型菌种。
对在不同培养基和培养方式下所筛47株菌种中选代表性菌株25株,采用细菌16SrDNA通用引物扩增菌种的保守序列,结果如图3所示。所选菌种均能扩增出约1 500 bp的保守序列。对扩增产物进行测序并在NCBI Blast N中进行比对发现,MRS培养基厌氧条件所筛菌种与植物乳杆菌菌株(MG551233.1)的相似度达99%以上,MRS培养基好氧条件所筛菌种与乳酸片球菌菌株(KY550661.1)的相似度达98%以上;NA培养基厌氧条件所筛菌种与粪肠球菌菌株(CP028727.1)的相似度达98%以上,NA培养基好氧条件所筛菌种与海洋芽孢杆菌(KV392046.1)的相似度达98%以上;LB培养基好氧条件所筛菌种与枯草芽孢杆菌菌株(KC422328.1)相似度达到99%以上,LB培养基厌氧条件所筛菌种与巨大芽孢杆菌菌株(CM003163.1)相似度达到97%以上。可初步判断不同筛选方式所筛菌株分属不同的微生物品种。所筛菌种的菌体形态及分子鉴定分析与基因组测序分析结果相符。
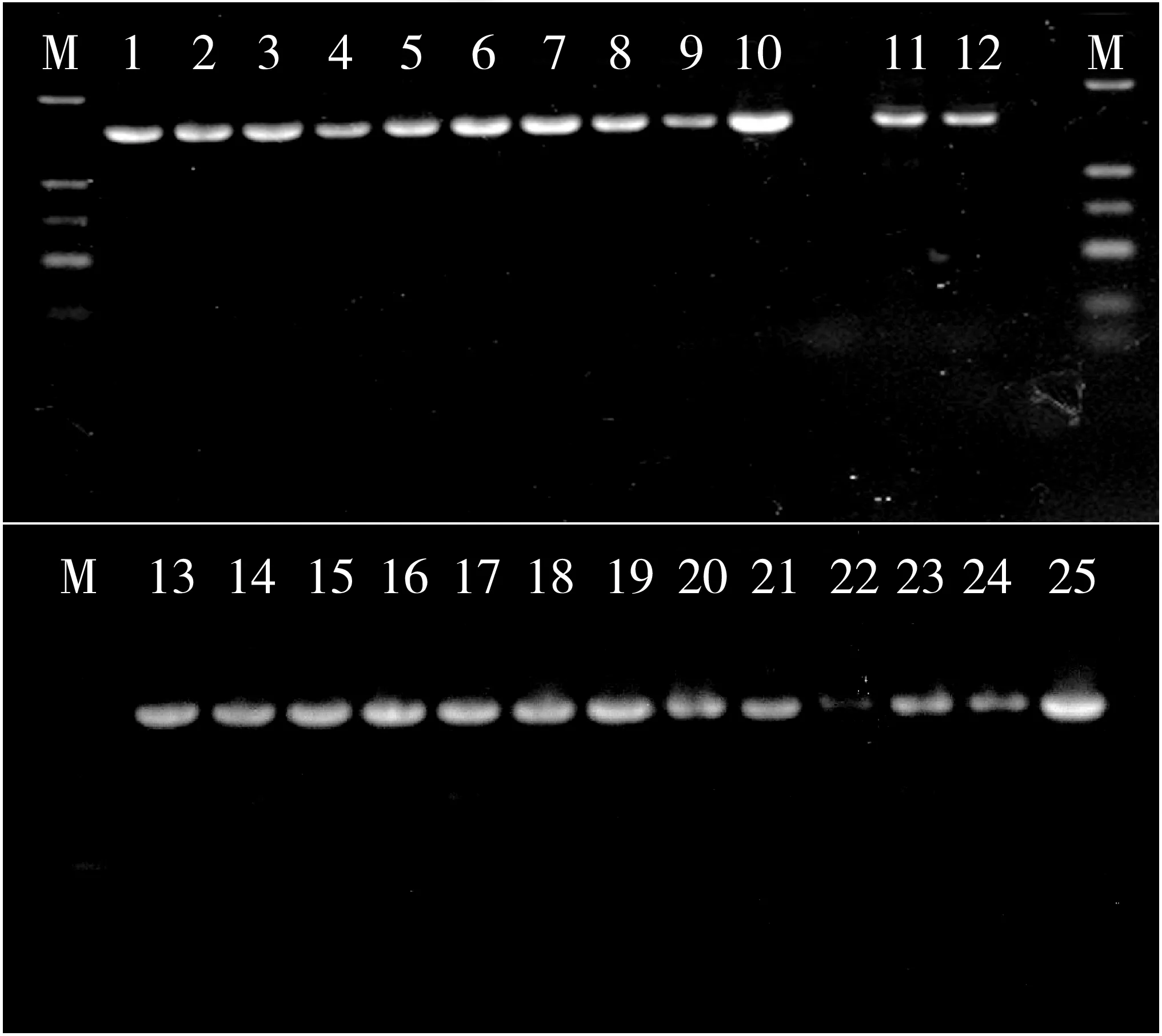
注:M为DNA marker,大小依次2 000, 1 000, 750, 500, 250, 100 bp,1~9为MRS培养基所筛微生物菌种,10~17为NA培养基所筛微生物菌种,18~25为LB培养基所筛菌种。
2.3 不同样点菌种对ZEN的去除率
对初筛的47种菌株挑取菌落于相应的液体发酵培养基进行培养,观察不同编号菌种的菌液变化情况,并在培养18 h后测定发酵液中ZEN的含量,计算培养液中ZEN去除率,结果如表1所示。在10个河道污泥样品中用3种培养基均筛选到了能够去除ZEN的微生物菌种。通过对培养基中ZEN含量的测定和统计计算,所筛微生物菌种对ZEN的去除率大部分都在60%以上。说明可去除ZEN的菌种广泛存在于洛河污泥中。
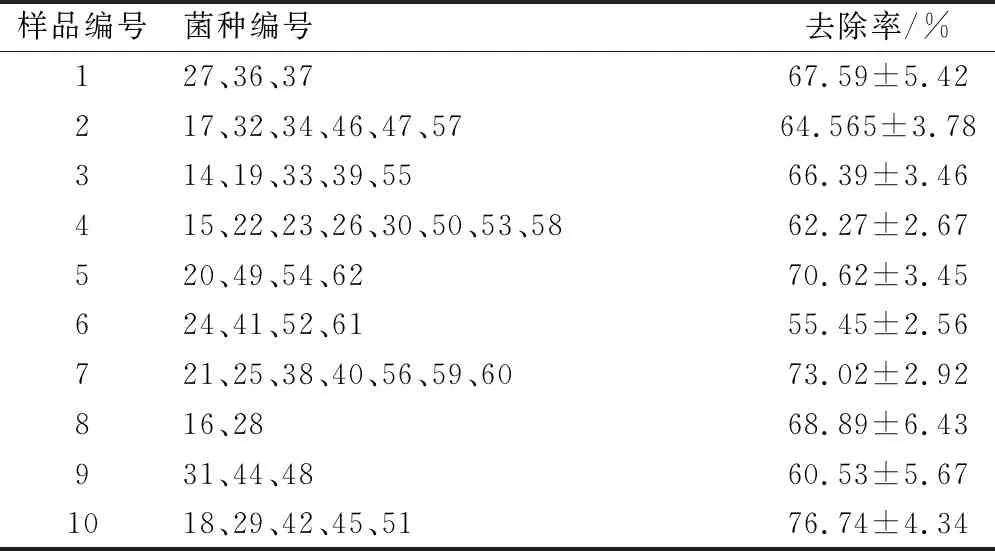
表1 不同来源样品菌种对ZEN的去除统计
2.4 不同培养方式所筛菌株对ZEN去除率
按照培养基和培养方式对47株微生物ZEN的去除率进行统计计算,结果如表2所示。LB培养基共筛选到8株去除ZEN的微生物,其中,好氧方式筛选到5株,平均去除率为79.25%,厌氧方式筛选到3株,平均去除率接近70%;NA培养基共筛选到20株去除ZEN的微生物其中好氧方式筛选到9株,平均去除率为80.65%,厌氧方式筛选到11株,平均去除率为55.82%;MRS培养基共筛选到19株去除ZEN的微生物,其中好氧方式筛选到9株,平均去除率为73.43%,厌氧方式筛选到10株,平均去除率为56.49%;3种培养基在好氧培养方式下所筛菌种的去除率显著高于厌氧培养方式所筛菌种的去除率(P<0.05)。在好氧培养方式下LB、NA培养基所筛菌种的平均去除率差异不显著(P<0.05),但显著高于MRS培养基所筛菌种的平均去除率;在厌氧培养方式下NA、MRS培养基所筛菌种的平均去除率差异不显著(P<0.05),但显著低于LB培养基所筛菌种的平均去除率(P<0.05)。说明好氧筛选和培养方式更适合ZEN去除菌种;LB、NA培养基更有机会筛选到ZEN去除率高的去除菌种。
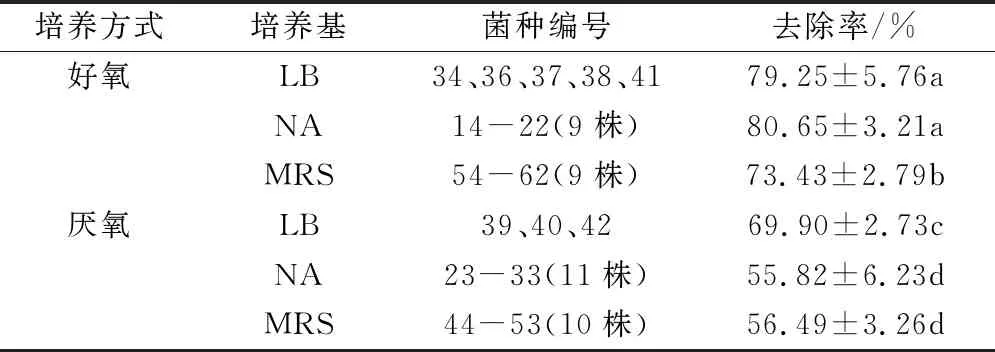
表2 不同培养方式菌种对ZEN的去除统计
3 讨论
ZEN为镰刀菌属霉菌产生的一种真菌毒素,广泛存在于霉变的玉米、小麦等谷物中。而能够降解ZEN的微生物也广泛存在于自然环境中。已有的报道成功的从玉米田、沼气污泥、河道污泥等多种自然环境中筛选到降解ZEN的细菌[16,17]。本实验从洛河污泥中筛选到了大量能够降解ZEN的微生物菌种,也验证了这一点。在筛选策略方面,大部分的成功经验是以ZEN为唯一碳源,筛选能够利用ZEN作为营养物质的微生物菌种[16,17]。本实验首先对污泥样品中的微生物种群结构进行生物信息学分析,初步查明了污泥样品中的微生物种群信息后,利用改良筛选培养基有针对性的从污泥样品的优势菌群中筛选能够去除ZEN的微生物菌种。
对已知具有降解ZEN能力的微生物菌种进行鉴定,这些微生物的种类非常丰富,大部分为细菌的芽孢杆菌属[15,18,19],主要与芽孢杆菌具有丰富的酶系和很强的环境适应性有关。也有筛选到降解ZEN的假单胞菌的报道[17]。而在霉菌菌种的报道方面,杜稳等[20]在酸性环境下筛选到了降解ZEN的黑曲霉,Liu等[12]研究了益生菌和米曲霉细胞抽提物对ZEN具有降解作用,并且对猪的生产具有明显缓解中毒症状的作用。本实验通过对样品中微生物种群分析,其中大部分为芽孢杆菌属,实验所筛选到47株去除ZEN的微生物,经形态学和分子鉴定大部分为枯草芽孢杆菌、植物乳杆菌、巨大芽孢杆菌、海洋芽孢杆菌、乳酸片球菌和粪肠球菌等细菌菌种;但本实验没有筛选到与霉菌形态相符的菌种,可能与筛选样品有关,本实验所用样品为河道污泥,有机质含量低,不易发霉,不利于霉菌滋生。
所筛菌种对ZEN的去除能力由于菌种的不同导致去除率变动范围很大,同时,降解率也与降解底物ZEN的浓度和存在状态有关,降解菌的降解率从20%多到90%以上的均有报道[17-20],降解率较高的菌株大多为芽孢杆菌类。本实验所筛菌种对培养基中5 μg/mL浓度的ZEN去除能力最高的平均去除率达到80%多,个别菌株的去除率达到95%左右,对ZEN去除率较高的菌株大部分属于芽孢杆菌。而本实验样品中的另一个主要菌群乳酸菌类,包括植物乳杆菌、乳酸片球菌和粪肠球菌,在被报道的降解菌中很少见,本实验中MRS厌氧筛选的菌种平均去除率也最低,可能是因为乳酸菌更多通过对霉菌生长的抑制来抑制真菌毒素的形成,或借助乳酸菌细胞壁与真菌毒素的物理结合来清除毒素[21]。
4 结论
洛河河道污泥中微生物菌群丰富,宏基因组物种分析结果显示在属的水平主要是芽孢杆菌属和乳杆菌属,在种的水平主要是枯草芽孢杆菌、巨大芽孢杆菌、达蒙海洋杆菌和植物乳杆菌。
能够降解ZEN的微生物菌种广泛存在,通过改良MRS、NA和LB培养基一次筛选出47株菌种,均能够去除培养基中的ZEN。经鉴定所筛菌种大部分为植物乳杆菌、乳酸片球菌、粪肠球菌、海洋芽孢杆菌、枯草芽孢杆菌、巨大芽孢杆菌等微生物菌种。
所筛选的ZEN去除菌种中,以LB、NA培养基好氧培养方式筛选的对ZEN去除率较高,说明此种方式更可能从河道污泥中筛选到对ZEN去除率高的微生物菌种。
