不同脱脂方法对椰子分离蛋白结构与理化性质影响研究
2020-09-03崔岩岩庞丽珍郭毓昕张伟敏
崔岩岩 庞丽珍 郭毓昕 向 东 张伟敏
(海南大学食品科学与工程学院,海口 570228)
椰子(CocosnuciferaL.)为多年生常绿乔木,是棕榈科椰子属植物。椰子主要用途作为原料提取椰子油[1]。椰子油具有相对较高的熔点,较窄的熔融范围,气味清香,以及一定的抗氧化活性和酸败性等特征[2]。它们含有丰富的短链脂肪酸,具有很好的消化率[3]。
传统上用于植物油提取的溶剂是正己烷,尽管其具有高稳定性和高提取率的优点,但环境和安全问题成为其用于植物油提取的主要缺点[4-6]。传统的冷压榨法尽管能够最大限度地保留油脂中的营养成分,但提取率偏低。随着科技的进步,目前植物油的工业化脱脂方法通常采用超临界或亚临界流体萃取。具有如下优点:选用高密度,高扩散性以及低黏度的溶剂[7]。在超临界/亚临界流体中的溶剂在萃取结束时可以用减压系统完全分离[8],与传统方法相比,材料的传导速率更快,导致脂质氧化速率降低,可以保护不饱和脂肪酸[9]。在椰油的生产加工过程中产生大量的废弃椰子饼粕。据报道,被视为副产品的椰子渣中蛋白质质量分数在4%~25%之间,来源丰富,清蛋白和球蛋白含量大,营养价值高,保健功能好,在食品工业中有美好的应用前景[10-11]。过去的萃取方法只考虑椰子油的出油率,忽视了椰子粕的质量,导致其营养价值降低。在加工过程中产生的高温导致蛋白质的变性,使椰子蛋白质的利用范围受到极大限制,不利于其进一步纯化利用,因此造成巨大的浪费,不符合椰子高效利用原则。所以找到一种既能保证出油率,又在能加工过程中不使椰子蛋白高温变性的低温萃取工艺是研究的方向和重点。
本研究通过对比分析溶剂萃取、液压冷压榨、亚临界丁烷萃取和超临界二氧化碳萃取四种脱脂方法得到分离蛋白质的理化性质和功能特性,以期为椰子油制备方法的选择和椰子饼粕综合利用提供参考。
1 材料和方法
1.1 材料
鲜熟椰肉(Copra)产自中国海南岛。椰肉经过预处理,如清洗,烘干(60 ℃,2 d),磨粉(40目筛),获得椰子粕。采用溶剂提取(SE),椰子粉(5 g)用200 mL正己烷(1∶40,g/mL)在80 ℃下提取10 h,获得溶剂提取椰子粕。采用Kern Kraft液压冷压机在室温10 MPa下机械冷压(CP)萃取10 min,获得冷榨椰子粕。采用CBE-5L亚临界流体萃取设备,使用丁烷提取椰子油4次,每次35 ℃,每轮提取40 min,获得亚临界丁烷萃取椰子粕。采用HSFE-35-1多功能超临界流体萃取装置,在50 ℃进行,28 MPa,2.5 h,CO2流量保持在200 L/h,获得超临界二氧化碳萃取椰子粕。对不同脱脂方法获得的椰子粕放入40 ℃烘箱进行脱溶处理。所有化学品均为分析纯。
1.2 椰子分离蛋白的提取
使用碱性溶液从椰子粕中提取蛋白质。取50 g样品,过60目筛脱脂椰子粕,加入1 000 ml的0.2 mol/L pH8磷酸盐缓冲液(1∶20),在30 ℃下搅拌40 min后于4 ℃下6 000 r/min离心15 min,收集上清液并用1 mol/L HCl调节pH至3.5~4.5之间沉淀2 h。将沉淀的蛋白质于4 ℃ 6 000 r/min离心15 min,用蒸馏水洗涤沉淀3~5次,冷冻干燥得到椰子分离蛋白。
1.3 椰子分离蛋白氨基酸组成
称取约50 mg均匀样品于密封瓶中(精确到0.000 1 g),加入10 mL 6 mol/L HCl(含1%苯酚),充氮气1 min,封瓶,110 ℃水解22 h,取出冷却,定容至10 mL,取部分90 ℃下氮吹挥干,0.01 mol/L HCl溶解定容,过膜测定。使用一级氨基酸与邻苯二甲醛(OPA)、二级氨基酸与芴甲氧羰酰氯(FMOC)衍生后过柱检测,使用Agilent110 0液相色谱仪进行色谱分析,该系统配备有DAD检测器,除脯氨酸(PRO)使用荧光检测外(EX=266NM,EM=305NM),其他氨基酸使用紫外检测(338 nm)流动相A是40mmol/L磷酸二氢钠(pH 7.8);流动相B由乙腈,甲醇,水组成。
1.4 椰子分离蛋白结构性质
1.4.1 聚丙烯酰胺凝胶电泳(SDS-PAGE)
将干燥的沉淀蛋白质溶解在蒸馏水中,使用涡旋混合1分钟并以12 000 g离心10 min。将上清液蛋白质溶液(10μL)与5μL样品缓冲液(含含有内含2%SDS,5%β-巯基乙醇,10%甘油0.02%溴酚蓝,0.01 mol/L pH8.0Tris-HCL缓冲液5%β-巯基乙醇)混合,然后在90 ℃下加热10 min。将15 mL每种样品和标记物(Precision Plus Protein All Blue标准,加载到分离胶浓度12%,浓缩胶浓度5%的预制聚丙烯酰胺凝胶上。电泳在电极缓冲液[0.05mol/L Tris,0.384 mol/L甘氨酸,0.1%SDS(pH 8.3)]中开始电泳时电压为100 V,待样品进入分离胶后改为150 V。当溴酚蓝指示剂跑到距胶底部5 mm时,停止电泳,剥下胶片后,将胶片放入固定液中固定30 min,考马斯亮蓝 R-250染色,过夜,放入脱色液中脱色,直至胶片背景蓝色完全透明状,数码照相,分析。
1.4.2 内源荧光光谱
根据Arogundade等[12]所述进行内源荧光分析,稍作修改。将椰子蛋白溶解于0.01 mol/L pH 7.0的磷酸盐缓冲液中,磁力揽拌2 h后室温10 000r/min离心20 min收集上清液。以考马斯亮蓝G-250法测定上清液中蛋白浓度,用磷酸盐缓冲液将蛋白浓度稀释到0.1 mg/mL。采用F-7 000型荧光光谱仪在激发波长280 nm下扫描300~500 nm之间的发射光谱(狭缝宽度2.5),以0.01 mol/L pH 7.0的磷酸盐缓冲液做空白。
1.4.3 傅里叶红外光谱
根据Shevkani等[13]测量红外光谱和蛋白质二级结构。取2 mg椰子蛋白样品和200 mg KBr混合,研磨均匀后制作透明薄片。使用FTIR光谱仪记录所有光谱,扫描条件:扫描范围400~4 000 cm-1,分辨率4 cm-1,每个样品扫描128次。
1.4.4 X-衍射
采用型号是bruker d8X衍射仪,角度范围为2θ:5~90°进行测定。收集滤液进样分析。
1.5 椰子分离蛋白理化性质
1.5.1 椰子分离蛋白溶解度
采用Samira等[14]的方法。将蛋白质样品(200 mg)溶于10 mL蒸馏水中,使用3 mol/L HCL溶液将 pH调节至2~11,将这些悬浮液在室温下超声30 min,然后再3 500 g下离心20 min。使用考马斯亮蓝G-250方法,测定上清液中的蛋白质含量。

(1)
1.5.2 吸水性吸油性
根据Aydemir等[15]所述进行吸水吸油性分析,稍作修改。将20 mg蛋白质样品和1.5 mL蒸馏水或大豆油在2 mL离心管中均质20 s,在30 ℃下水浴30 min,将试管在室温下以15 000 g离心20 min,使用移液管移除游离水或油,重新称重样品。吸水和吸油能力为每g蛋白质样品吸收的水或油的克数表示。
1.5.3 起泡性和泡沫稳定性
参照Coffman等[16]方法进行,稍作修改。取20 mL蛋白质溶液(10 mg/mL),并将其pH调至11,在30 ℃下搅拌30 min后,13 500 r/min下均质1 min。将均质后的蛋白溶液转移到50 mL量筒中,在0 minV0和60 minV1记录体积。
(2)
(3)
1.5.4 乳化性EAI和乳化稳定性ESI
参照Yeom、Pearce等[17-18]的方法进行,稍作修改。称取一定量的椰子蛋白加入到去离子水中,调整浓度为1 mg/mL,取15 mL蛋白溶液与5 mL大豆油混合于100 mL烧杯中,于10 000 r/min均质2 min后立即取样。取20μL椰子蛋白与大豆油混合液与5 mL0.1%十二烷基硫酸钠(SDS)溶液混合,以0.1%SDS为空白,在500 nm处测定吸光度值,记为A0,乳液静置30 min后采用相同的方法测定乳液吸光度值,记为A30。
(4)
(5)
式中:N表示稀释倍数,250;C表示样品溶解度中蛋白质浓度,0.001 g/mL;φ表示油相所占的分数,0.25。
1.5.5 表面疏水性
1.6 统计分析
除非另有说明,否则所有测量均一式3份进行,并且所得值表示为平均值±标准偏差。使用统计软件包(SPSS16.0)通过单因素方差分析评估平均值之间的差异。使用Tukey检验确定实验之间的显着差异(P<0.05)。
2 结果与讨论
2.1 氨基酸组成
不同脱脂方法的蛋白质分离物的氨基酸组成见表1,除了具有最低氨基酸总量的亚临界分离蛋白之外,椰子分离蛋白的总氨基酸含量之间没有异常的特征。亚临界具有最低的氨基酸含量可能的原因是,在萃取过程中氨基酸随着萃取剂或者高压条件下氨基酸的结构被破坏而有很大损失。冷榨所得椰子分离蛋白质的氨基酸含量最高,其中酸性氨基酸含量为84.08 mg/g,碱性氨基酸含量为86.87 mg/g,结果与2.2.1研究结果一致。在本研究中赖氨酸以8.31~20.78 mg/g呈现,可作为基础饮食的谷类蛋白质的替代。椰子蛋白中含有丰富疏水性氨基酸,占总氨基酸含量的37%左右。总体而言,椰子分离蛋白具有丰富的氨基酸含量,有利于人体健康和疾病的预防,因此可以利用椰子分离蛋白作为食品和医药成分[20-21]。

表1 溶剂脱脂椰蓉SECPI,液压冷榨CPCPI,亚临界UCCPI和超临界SECPI(CO2)椰子分离蛋白氨基酸组成
2.2 椰子分离蛋白结构性质
2.2.1 SDS-PAGE
不同脱脂方法所得蛋白质SDS-PAGE测定结果见图1,由图可知,所有样品的平均分子量在15~55 ku之间。椰子分离蛋白有大约20,35和50 ku的三个主要条带,分别是谷蛋白、球蛋白和清蛋白。该结果与Rodsamran[22]所报道的椰子蛋白一致。发现主要的高强度条带在35 ku,证明椰子分离蛋白中球蛋白的含量最高。在亚临界和超临界的分离凝胶的顶部保留较高的蛋白质分子量(250 ku),是因为蛋白质的聚集。冷榨和溶剂提取获得的椰子分离蛋白质分子量较低,可能是溶剂提取的蛋白质在高温处理中椰子分离蛋白亚基的二硫键被破坏,与报道的溶剂提取的芥子蛋白质结果相似[23]。冷榨所得蛋白质在高压处理下较大的蛋白质被降解,亚基的二硫键被破坏,结果与报道的冷榨提取的大麻籽蛋白[24]相似。溶剂提取中在27 ku有清晰的条带,可能归因于高温热处理导致蛋白质变性[25]。此外,在所有椰子分离蛋白中存在分子量为20~27 ku和30~39 ku的条带,分别代表存在碱性和酸性亚基[26]。该观察结果与我们研究中的氨基酸组成一致,其含有显着的酸性和碱性氨基酸[27]。

注:1为溶剂脱脂椰子蛋白,2为冷榨脱脂椰子蛋白,3为亚临界脱脂椰子蛋白,4为超临界脱脂椰子蛋白,M为marker。图1 椰子分离蛋白的SDS-PAGE
2.2.2 内源荧光光谱
内源荧光光谱可用于研究蛋白质三级结构的改变,因为色氨残基的内在荧光可以反映蛋白质的环境,是表征蛋白质的方法[28]。不同脱脂方法所得椰子分离蛋白的荧光光谱分析结果见图2,由图可知,不同脱脂方法所得椰蓉分离蛋白的荧光值由大到小分别是亚临界、超临界、溶剂和冷榨。对于不同脱脂方法所得椰子分离蛋白,在330 nm以上观察到最大的荧光发射,表明部分色氨酸残基位于蛋白质分子内的极性环境中[29]。超临界和亚临界的λmax在不同程度上增加,表明高压和低温处理可以增加蛋白质内更多基团暴露于极性环境。另一方面,对于溶剂,提取过程中温度过高,破坏了蛋白质分子之间的疏水键,蛋白质三级结构展开,导致分子内的色氨酸残基暴露[30]。然而,冷榨具有最低的λmax,表明液压冷处理产生压力不能改变蛋白质的微环境。因此,变性可能导致酪氨酸和色氨酸残基大量暴露于亲水(水)环境,这有助于荧光猝灭[31]。亚临界和超临界的蛋白质变性程度较低,这减少了酪氨酸和色氨酸暴露于亲水环境,因此有更高的荧光值。所有脱脂方式最大荧光值(336 nm)的波长变化非常小,这表明在样品的色氨酸微环境是相似的[32]。综上所述,不同脱脂方法可能导致椰子分离蛋白三级结构的变化。

注:在280 nm激发(对于色氨酸)。SECPI,CPCPI,UCCPI和SECPI(CO2)分别来自溶剂脱脂椰蓉,液压冷榨,亚临界和超临界提取椰子分离蛋白。图2 椰子分离蛋白的内在荧光光谱
2.2.3 傅里叶红外光谱
以投资主体一体化带动流域治理一体化,是汾河流域生态保护与修复建设管理模式的重大创新和重要实践。汾河流域投资公司主要负责汾河流域生态保护与修复项目的总体实施、投融资运作和风险防控,以市场化方式组织实施汾河流域生态保护与修复项目,统筹各级政府用于项目的资金,积极参与流域内水库、供水、污水处理、垃圾处理等项目的投资建设和经营管理。


注:SECPI,CPCPI,UCCPI和SECPI(CO2)分别来溶剂,液压冷榨,亚临界和超临界脱脂椰蓉提取椰子分离蛋白。图3 椰子分离蛋白傅里叶变换红外光谱
2.2.4 XRD
XRD用于确定蛋白质的复杂折叠行为,某些氨基酸/氨基酸序列倾向于形成特定的二级结构,如α-螺旋,β-转角,β-折叠和无规卷曲[39]。图4显示了椰子分离蛋白的XRD图谱。UCCPI和SECPI(CO2)在约16.1°和20.5°处分别显示出两个衍射峰。SECPI和CPCPI在20.6°处显示出一个较小的衍射峰。Chen等[40]报道,蛋白质X射线衍射图中2θ角接近9°和21°的峰分别属于 α-螺旋和 β-折叠结构。在所有脱脂方式中都未发现9°的衍射峰,证明在脱脂过程中的高压和高温破坏了蛋白质的α-螺旋结构。衍射曲线显示UCCPI和SECPI(CO2)的部分结晶度,其在20.5°左右的较明显的峰值表明较大比例的紧密结合结构(较小的填充距离)以牺牲结构间填充为代价,这表明UCCPI和SECPI(CO2)具有较高比例的有序二级结构。与前面的SDS-PAGE等关于蛋白质聚集程度的研究结果一致。SECPI和CPCPI衍射峰较小,其原子随意排列,没有特定的空间结构。

注:CPI,SECPI,CPCPI,UCCPI和SECPI(CO2)分别来自原始椰蓉,溶剂脱脂椰蓉,液压冷榨,亚临界和超临界提取椰子分离蛋白。图4 椰子分离蛋白的X射线衍射图
2.3 椰子分离蛋白理化性质
2.3.1 蛋白质溶解度
pH对不同脱脂方法所得椰子分离蛋白溶解度曲线的影响结果见图5。由图可知,不同脱脂方法表现出典型的PS曲线,在蛋白质等电点3.5~4.5之间观察到最低的溶解度,是因为产生了不溶性蛋白质聚集体,在pH 5.0时最低,并且随pH增加而增加,在pH 11.0下达到最高值。观察到在碱性pH椰子分离蛋白的溶解度显着高于酸性pH,是因为提高pH(高于等电点)导致净蛋白质电荷增加,这个结果与芝麻分离蛋白[41]和腰果分离蛋白[42]结果相似。不同脱脂椰子分离蛋白在pH 6.0~11.0条件下溶解度也不同,冷榨椰子分离蛋白比亚临界萃取所得椰子分离蛋白的溶解度要低,说明不同处理会对椰子分离蛋白溶解性有影响,其原因可能是液压冷压榨的高压处理增强了蛋白质之间相互作用,导致蛋白质聚集和沉淀,从而降低了蛋白质与水之间的相互作用几率,进而导致蛋白的溶解性降低,这种结果与Ivanova[43]和Ghribi[44]的研究基本一致。

注:SECPI,CPCPI,UCCPI和SECPI(CO2)分别来自溶剂,液压冷榨,亚临界和超临界脱脂椰蓉提取椰子分离蛋白。图5 蛋白质分离物的溶解度曲线
2.3.2 吸水性与吸油性
不同脱脂方法所得椰蓉蛋白吸水性与吸油性测定结果见表2,由表可知,不同脱脂方法所得椰子分离蛋白吸水性最高的是亚临界(10.43 g/g),其次是冷榨(4.43 g/g)和溶剂萃取(4.25 g/g),超临界(2.45 g/g)所得椰子分离蛋白吸水性最低。几种内在特征(蛋白质构象,亲水性,氨基酸的亲水平衡等)和环境参数(pH,离子强度,温度)被认为是影响蛋白质结合水能力的原因[45]。采用液压冷压榨的椰子蛋白的WAC高于溶剂提取的椰子蛋白,结果与Labuckas[46]报道一致。这是因为溶剂脱脂制备的椰子蛋白在较高的温度下开始变性,构象也随之发生改变,蛋白质氢键作用和离子基团水合作用减弱,导致蛋白质持水性的差异。椰子分离蛋白的吸油性的范围为3.17%~6.17%,其中最高的是亚临界,最低的是冷榨,它们之间存在显著性差异(P<0.05)。溶剂法脱脂处理的高温使蛋白质发生变性,使其持油性变差。冷榨法脱脂时的高压使肽链伸展,亲水基团暴露,导致椰子蛋白持油性变差。亚临界脱脂处理的椰子蛋白持油性最好,为6.17%,可能是整个萃取过程可以在室温或更低的温度下进行,不会对活性蛋白造成损害,可以吸收更多油脂,因而持油性好。椰子分离蛋白的WAC和OAC值与花生[47]和大豆蛋白[48]的报道值一致。
2.3.3 起泡性和泡沫稳定性
许多情况下需要蛋白质的发泡性质(FC和FS),在食品系统中用于通气和搅打[49]。不同脱脂方法对椰子蛋白起泡能力和泡沫稳定性的影响见表2,由表可知,本研究中椰子蛋白发泡能力的范围为15%~30%,不同油脂提取方法对椰子蛋白起泡性影响最大的是溶剂提取,达到30.50%,影响最小的是冷榨,低至15.30%,超临界和亚临界的起泡能力分别为28.25%和17.25%。因为溶剂提取过程中温度过高,引起蛋白质的变性导致其更大的展开结构,使更多的水气界面相互作用,产生较高的起泡性[50]。良好的发泡能力和蛋白质分子之间柔韧性之间存在联系,可以降低其表面张力,而球状蛋白质表面相对难以变性,可能导致较低的起泡能力。溶剂和超临界的泡沫稳定性之间存在显著性差异,且其泡沫稳定性较好,分别为25.25%和10.25%。来自冷榨和亚临界的两种蛋白质粉末的泡沫稳定性是相似的,在5.50%~6.75%范围内。泡沫稳定性取决于气泡周围形成的厚的内聚层。冷榨椰子分离蛋白的起泡性和泡沫稳定性最低,表明低温使其蛋白质结构展开较少,蛋白质的变性程度最低。在溶剂和超临界中观察到高FC和FS值。它们可被认为是适用于不同食品的发泡成分,例如蛋糕,面包,生奶油,冰淇淋和一些糖果产品。
2.3.4 乳化性和乳化稳定性
乳化性能主要取决于降低油水界面处的张力并通过形成吸附层来控制油滴的扩散和聚集[51]。乳化性和蛋白质溶解度,表面电荷,表面疏水性和分子灵活性相关。不同脱脂方式对椰子蛋白乳化性和乳化稳定性的影响见表2,由表可知,不同油脂脱脂方法对椰子分离蛋白乳化性影响最大的是溶剂提取,高达46.65%、其次是亚临界和冷榨,分别为42.38%和37.54%。超临界的值最低,为31.41%。由于温度的升高,蛋白质的变性程度增大,球形蛋白质的解离和部分分解折叠,变性的蛋白质暴露出疏水基团,使表面活性在油和水界面的吸附增加[52],从而溶剂提取有较高的EAI。所有椰子分离蛋白的ESI值在20.36~29.31 min之间。超临界和冷榨具有更高的ESI,是因为脱脂过程中发生了更大程度的多肽折叠,获得更大的蛋白质表面积,乳化活性增强[53]。高ESI表明它可以优选用作水包油乳液中的乳化剂。溶剂提取的ESI值最低,是由于提取温度过高使蛋白质相互交联从而有较低的乳化稳定性[54]。
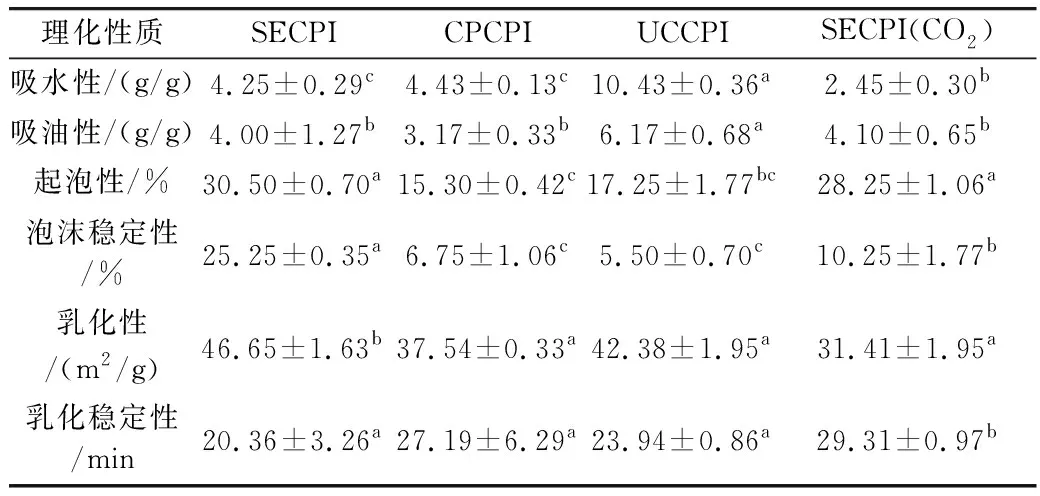
表2 来自溶剂脱脂椰蓉SECPI,液压冷榨CPCPI,亚临界UCCPI和超临界SECPI(CO2)椰子分离蛋白的功能特性
2.3.5 表面疏水性
椰子分离蛋白在pH 7.00下的表面疏水性如图6所示。结果表明H0最高的为溶剂。其次是超临界和冷榨,最低的是亚临界,它们之间存在显著性差异(P<0.05)。溶剂提取过程中温度过高,蛋白质变性程度增大,暴露出蛋白质分子的疏水性残基,是表面疏水性增强。而冷榨、亚临界和超临界具有较低的H0可能是因为蛋白质聚集[55],游离巯基的含量较低,蛋白质分子的解折叠程度较低,具有更少的疏水性残基暴露于蛋白质分子表面,导致表面疏水性降低。亚临界具有最低的表面疏水性可能因为其疏水性氨基酸含量最低(见表1)。不同脱脂方式可能会导致蛋白质与亚基分离,暴露出疏水侧链导致其H0的增加与侧链结合导致ANS的荧光强度增加(见图2)。Kato等[56]研究表明,不同的样品制备方法可以导致其构象变化,油水界面以疏水相互作用为主,界面处非极性疏水基团的暴露极大程度地影响其乳化性质。

注:SECPI、CPCPI、UCCPI和SECPI(CO2)分别来自溶剂,液压冷榨,亚临界和超临界脱脂椰蓉提取椰子分离蛋白。图6 椰子分离蛋白的表面疏水性
3 结论
本实验研究了不同脱脂方法对椰子分离蛋白变性程度的影响,结果如下:1)不同脱脂方式会影响椰子分离蛋白的结构,经SDS-PAGE图谱和FTIR分析证实。2)在具有高H0的SECPI(CO2)和具有高荧光值的UCCPI分析显示较少变性和更多折叠的构象。3)UCCPI显示出高WAC/OAC以及乳化稳定性。结果表明亚临界丁烷萃取椰子粕的蛋白质可以有效地用于食品工业。
