生物修复对多环芳烃在土壤不同有机组分中分配特征的影响
2020-09-03姚伦芳
姚伦芳
(1.贵州省环境与工程评估中心;2.贵州绿兴清源环保有限责任公司,贵阳 550002)
有机污染物(如PAHs)在土壤环境中的迁移转化和生物有效性主要取决于污染物与土壤不同组分之间的相互作用,其中黏土矿物和土壤有机质被认为是影响有机污染物在土壤环境中的行为的两个最重要因素[1]。土壤环境中的有机质一般以游离态与结合态两种形式存在,其中游离态有机质主要包括动植物残体和微生物生物量,而结合态主要是有机矿质复合体,其中的有机质主要锁定在土壤微团聚体内部或吸附在矿物表面[2]。比重分组法是研究土壤有机质常用的分组方法,Greenland等[3]首次采用该方法对土壤有机质进行了分组,将土壤中相对密度小于2.0 g·cm-3的组分定义为轻组(Light fraction, LF),而相对密度大于2.0 g·cm-3的组分定义为重组(Heavy fraction, HF)。根据腐殖质与矿物结合的松紧程度,又可将重组有机质分为松结态、稳结态和紧结态三种形态[4]。其中,轻组有机质生物活性较高,与之结合的污染物生物可利用性较高;而重组有机质一般以有机矿质复合体的形态存在,生物活性相对较低,与之结合的污染物生物可利用性也较低[5]。在本课题组前期研究基础上[6],通过对比未经生物修复和经生物修复土壤不同有机组分中PAHs含量的变化情况,研究污染物在土壤不同组分的分布特征,对正确评估污染土壤PAHs生物有效性和环境风险具有重要的理论意义。
1 材料与方法
1.1 药品与试剂
溴化锌、无水焦磷酸钠、氢氧化钠、二氯甲烷、环己烷、无水硫酸钠等均为分析纯,购于国药公司,上机用乙腈、层析硅胶为色谱纯,购于美国Tedia公司。
1.2 供试土壤
在温室条件下(25℃,12 h黑暗/光照交替),采用盆栽实验。实验设置4个处理:(1)接种灭活菌剂(将木霉菌孢子悬液(接种量10%)接种在由麦麸和橘皮(1:1)制成的固体基质中,28 ℃条件下培养72 h,制成固体菌剂),不种植紫花苜蓿(CK);(2)接种灭活菌剂,种植紫花苜蓿(A);(3)接种木霉菌菌剂,种植紫花苜蓿(TA);(4)接种木霉菌、根瘤菌复合菌剂,种植紫花苜蓿(TRA)。每个处理设置4个重复。每盆装供试土壤1.5 kg,菌剂150 g,加去离子水调节土壤水分至田间持水量的60%左右。选取催芽后的紫花苜蓿直接播种于装好供试土壤的花盆中,10 d后间苗,每盆留苗10株。试验期间土壤水分维持在田间持水量的60%左右,培养60 d后分别采集土壤和植物样品。土壤样品过2 mm筛后分成两部分,一部分冷冻干燥,用于PAHs的提取测定,另一部分4℃冷藏,用于土壤微生物活性的测定。
本研究供试土壤采用盆栽实验土壤,选取其中种植紫花苜蓿并接种木霉菌-根瘤菌复合菌剂处理的土壤(样品编号:BS,样品数:4)和无植物种植和微生物接种处理的土壤(样品编号:CK,样品数:4)进行分析。
1.3 分析测试方法
1.3.1 土壤不同有机组分的分离
称取30 g冻干土样(<2 mm)置于200 mL特氟龙离心管中,加入100 mL ZnBr2(比重为1.8 g·cm-3)溶液,将离心管置于摇床振荡60 min,静置分层,然后2500 rpm离心10 min,将悬浮固体用事先恒重的Whatman 1#滤纸过滤,并用去离子水冲洗干净。离心管中剩下的土壤再用100 mL ZnBr2重复分离一次。将两次得到的固体合并、冻干、称重,得到轻组(LF)。离心管中余下的土壤用去离子水多次冲洗,去除残留ZnBr2,冻干、称重,最终得到重组(HF)。第一步得到的重组再分离得到松结态(H1)、稳结态(H2)和紧结态(H3)。将10 g重组土壤置于200 mL特氟龙离心管中,加入120 mL 0.1 mol·L-1NaOH溶液,25℃、200 rpm振荡过夜,12 000 rpm离心15 min,将上层悬浮固体转移至棕色玻璃瓶中,重复提取4~5次,直至溶液澄清,合并提取物,得到H1。离心管中剩余土壤加入100 mL 0.1 mol·L-1NaOH+0.1 mol·L-1Na4P2O7混合溶液,方法同上,重复3~4次操作,直至溶液澄清,合并提取物,得到H2;残留在剩余土壤中的有机质则为H3。离心管中剩余的土壤用去离子水冲洗至溶液pH大约为7,冻干备用。
1.3.2 不同土壤组分中多环芳烃的提取及检测
HF、LF、H3中PAHs使用索氏提取法提取,称取2.0 g冻干土样与2.0 g无水硫酸钠混合均匀置于索氏提取管中,向茄形瓶中加入二氯甲烷70 mL,提取24 h,提取后样品于旋转蒸发仪浓缩至干(36℃),然后向茄形瓶中加入2.0 mL环己烷溶解瓶中物质,取0.5 mL溶液过硅胶柱,用正己烷和二氯甲烷混合液(v/v,1∶1)洗脱,弃去起初的 1.0 mL洗脱液,收集2 mL洗脱液于刻度试管中,用高纯氮气吹干,加 2.0 mL乙腈溶解,使用HPLC测定。H1、H2溶液分别与50 mL二氯甲烷混合置于500 mL棕色玻璃瓶中,25℃、200 rpm振荡24 h,静置分层,吸取20 mL有机相置于100 mL茄形瓶中,采用旋转蒸发仪浓缩至干(36℃),然后向茄形瓶中加入 2.0 mL环己烷溶解瓶中物质,取0.5 mL溶液过硅胶柱,用正己烷和二氯甲烷混合液(v/v,1:1)洗脱,弃去起初的1.0 mL洗脱液,收集2 mL洗脱液于刻度试管中,用高纯氮气吹干,加 2.0 mL乙腈溶解,使用HPLC测定。
HPLC为日本岛津Class-vp高效液相色谱分析系统,配荧光检测器RF-10AXL,柱温箱OT-10ASVP柱温30 ℃,二元体镀泵LC-10AT,色谱分离柱为美国Varian公司的ChromSpher 5 PAH(VPODS150_4.6mm I. D.,particlesize 5 mm,Shimadzu),流动相为乙腈/水(65:35),流速为1.5 mL·min-1,进样量20 μL,梯度洗脱程序为:乙腈的初始体积分数为80%,终点体积分数为100%,洗脱时间20 min。
土壤PAHs总量回收率按轻组和重组中PAHs含量以及它们质量比计算得出原土中PAHs总量与原土中实测的PAHs总量百分比。重组中PAHs总量回收率按松结态、稳结态和紧结态中PAHs含量以及它们质量比计算得出重组中PAHs总量与重组中实测的PAHs总量百分比。
1.3.3 数据统计分析
本研究中所有数据处理使用Office Excel 2007进行,图形采用Origin 8.0制作完成。
2 结果与讨论
2.1 土壤分组的质量回收率和多环芳烃回收率
土样BS、CK进行轻组和重组分离之后,其质量回收率分别为87.21%、90.35%(表1),表明分组过程中土壤损失量较少。BS、CK中PAHs总量回收率分别为100.64%、103.74%;重组在进行松结态、稳结态和紧结态分组之后,PAHs总量回收率分别为106.16%、124.74%(表2)。可以看出,在进行土壤分组之后,PAHs的回收率均高于100%,这可能是分组之后增加了土壤颗粒与提取溶剂的接触面积,很多锁定在土壤中的PAHs在原土中未被提取出,而在分组之后被提取出[2]。其他研究也表明,一些土样在粒径分组和有机组分分组之后组分中PAHs的含量总和也高于原土中PAHs的含量[7-8],另外土壤的基质效应也是多环芳烃回收率的影响因素[9]。

表1 土壤分组的质量回收率
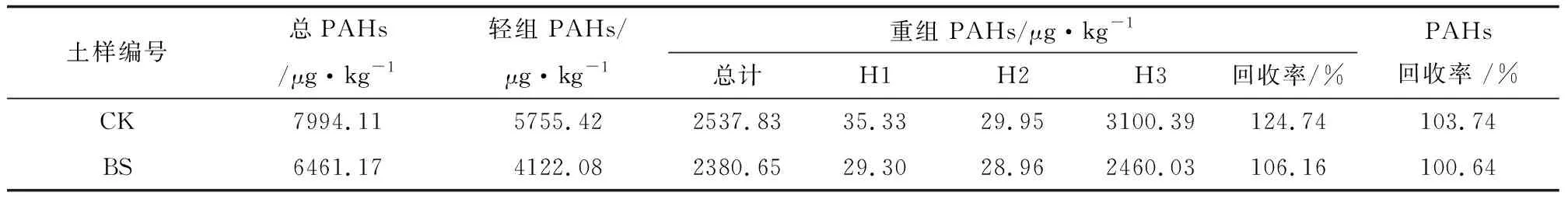
表2 土壤分组的PAHs回收率
2.2 多环芳烃在土壤轻组和重组中的分配
图1显示了两种土壤轻组和重组中PAHs含量,CK轻组中总PAHs含量为143885 μg·kg-1,重组中总PAHs含量为2643 μg·kg-1;而BS轻组中总PAHs含量为58886 μg·kg-1,重组中总PAHs含量为2559 μg·kg-1。轻组中PAHs 的含量远远超过重组中PAHs的含量,这是因为有机质是土壤中PAHs的主要吸附剂,而轻组有机质的含量远远高于重组,因而对PAHs的吸附量也高于重组[2]。图2是轻组和重组中PAHs总量占原土中PAHs总量的相对百分比,CK轻组中PAHs总量占原土中PAHs总量百分比为69%,而轻组重量只占原土重量的4%;BS轻组中PAHs总量占原土中PAHs总量百分比为63%,而轻组重量只占原土重量的7%。另外,可以看出,经不同处理的土壤轻组含量和其轻组中PAHs含量发生了一定的变化,特别是后者,相较于CK而言,BS轻组中PAHs含量降低了59%,但是重组中PAHs含量的变化则不大,仅仅降低了3%,这说明土壤轻组中的PAHs生物可利用性较高,在对污染土壤进行生物修复时,其去除的污染物主要集中在土壤轻组有机质中,而存在于重组中的PAHs由于其生物活性低,大多难以生物利用,另一方面这部分的污染物环境风险也较低。研究表明,轻组有机质被土壤矿物吸附较松,主要游离于土壤溶液中,与之结合的污染物的有效性较高,更容易被生物利用[6]。
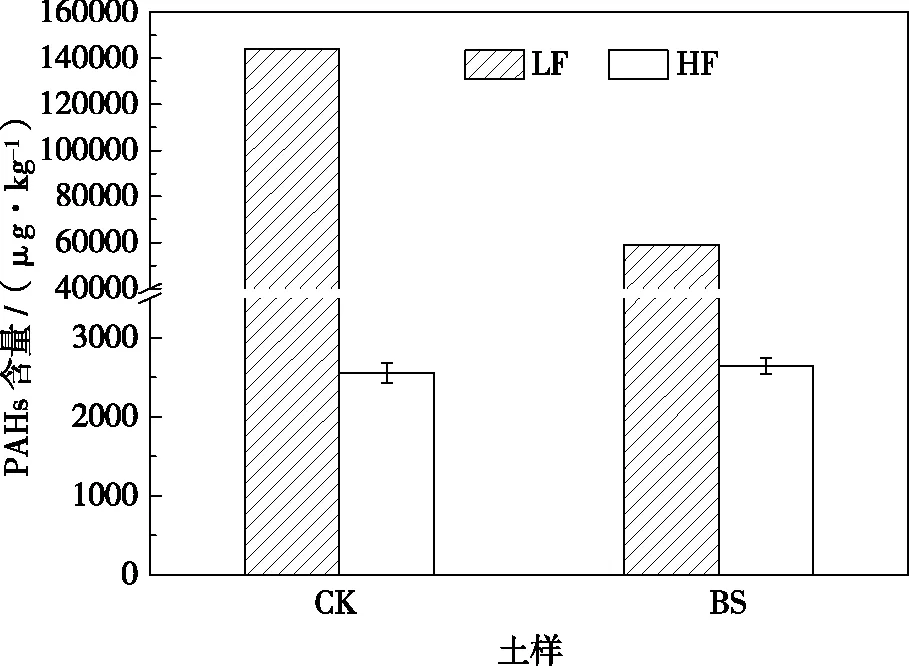
图1 供试土样轻组(LF)和重组(HF)中PAHs含量
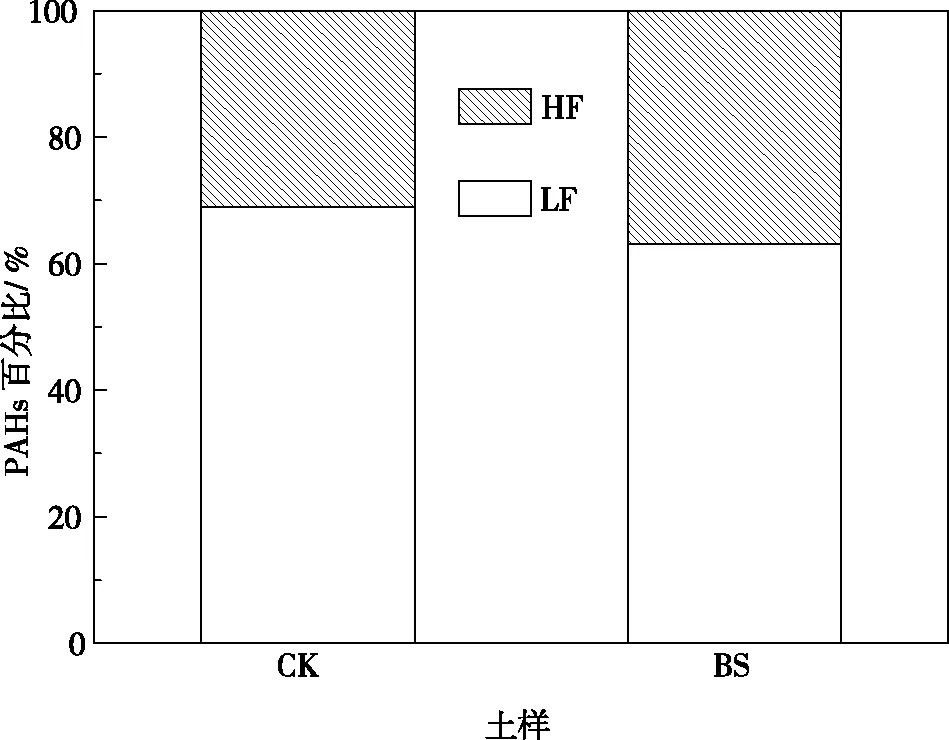
图2 轻组(LF)和重组(HF)PAHs含量占原土PAHs总量的百分比
2.3 重组多环芳烃在结合态腐殖质中的分配
图3显示了重组PAHs在结合态腐殖质中的分配情况,可以看出,BS、CK重组中PAHs主要分布在紧结态腐殖质组分中,分别占重组中PAHs总量的97.63 %、97.59%。稳结态腐殖质和松结态腐殖质结合的PAHs占重组中PAHs总量的百分比较小,CK中分别为0.95%、1.12%, BS中分别为1.16%、1.15%。根据不同结合态腐殖质与矿物结合的松紧程度,可以推断出不同结合态腐殖质的生物有效性程度大小顺序为松结态>稳结态>紧结态,那么不同结合态腐殖质结合的PAHs生物有效性程度的大小也应为松结态-PAHs>稳结态-PAHs>紧结态-PAHs。从这种角度看,PAHs污染土壤的环境风险主要在于与轻组有机质结合的PAHs,如果能够从污染土壤中分离出轻组,那么剩余重组结合的PAHs绝大部分生物有效性较低,环境风险也就相对较小。
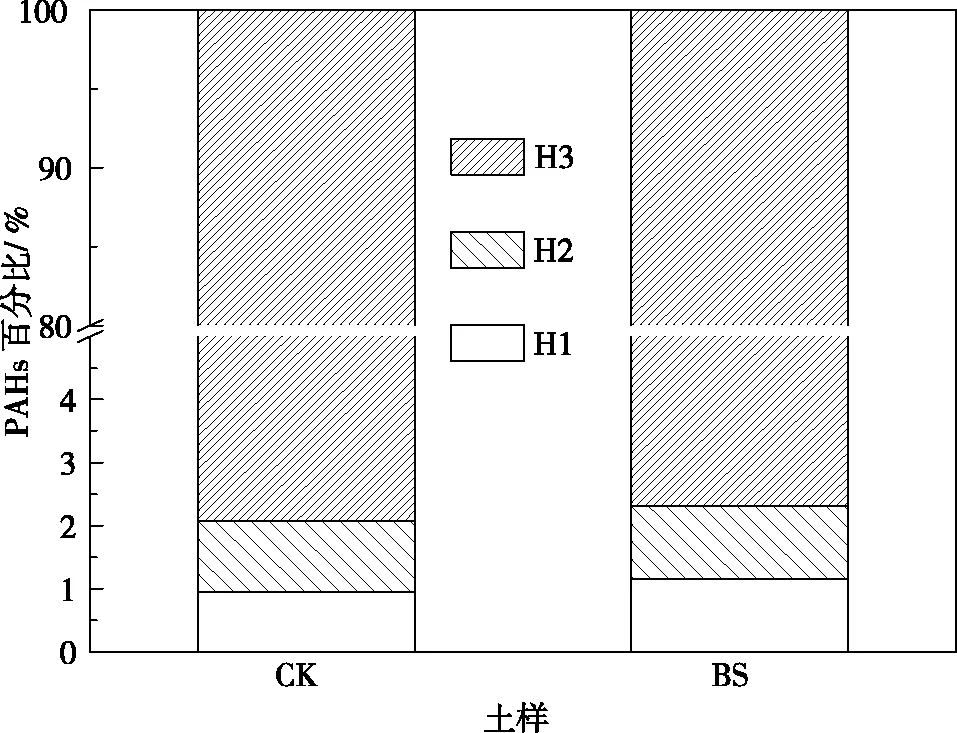
图3 松结态(H1)、稳结态(H2)和紧结态(H3)PAHs总量占重组PAHs总量的百分比
3 结论
本次研究结果表明,生物修复土壤和对照土壤中轻组含量所占比例很小,分别只有7%和4%,但它结合的PAHs量比例很大,分别达到土壤中PAHs总量的63%和69%;重组中PAHs的含量主要分布在紧结态腐殖质中,分别占重组PAHs总量的97.59%、97.63%。PAHs在土壤中的分布,主要集中在轻组组分中,其活性较大,容易被生物所利用,而重组组分中的PAHs由于结合紧密,活性小,难以被生物利用;生物修复对PAHs污染土壤有较好的修复效果,但不会对PAHs在土壤不同有机组分中的分布产生较大影响。从土壤中PAHs在不同有机质组分中的分配来看,PAHs污染土壤的环境风险可能主要在于和轻组有机质结合的PAHs。
