射干麻黄汤对慢性阻塞性肺疾病大鼠肺组织的保护作用及对EGFR/PI3K信号通路的调节
2020-09-02谢丽媛刘莲荆晶安娜
谢丽媛 刘莲 荆晶 安娜
[摘要] 目的 研究射干麻黃汤对慢性阻塞性肺疾病大鼠内皮生长因子受体(EGFR)/磷脂酰肌醇-3激酶(PI3K)信号通路的调节及气道平滑肌保护作用。 方法 75只SD大鼠按照随机数字表法分为5组,分别为对照组,模型组,射干麻黄汤低、中、高剂量组,每组15只。除对照组外其余大鼠均建立慢性阻塞性肺疾病大鼠模型,射干麻黄汤低、中、高剂量组分别灌胃给予大鼠10、20、40 g/kg的射干麻黄汤,1次/d。8周后,测定大鼠肺泡灌洗液肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-6及IL-1β水平、肺指数、肺组织超氧化物歧化酶(SOD)活性及丙二醛(MDA)水平、大鼠肺组织及气道组织病理学变化、肺组织中PI3K、EGFR mRNA水平及PI3K、EGFR蛋白水平。 结果 与模型组比较,射干麻黄汤各剂量组大鼠肺泡灌洗液TNF-α、IL-6及IL-1β水平、肺指数、肺组织MDA水平及PI3K、EGFR mRNA水平及PI3K、EGFR蛋白水平均显著降低,肺组织SOD活性显著升高(P < 0.05),肺组织及气道平滑肌组织病理学明显改善。 结论 射干麻黄汤明显降低慢性阻塞性肺疾病大鼠肺泡灌洗液炎症因子水平,改善大鼠肺组织氧化应激损伤及气道平滑肌病理学变化,其机制可能与调节EGFR/PI3K信号通路有关。
[关键词] 射干麻黄汤;慢性阻塞性肺疾病;EGFR/PI3K信号通路;气道平滑肌保护
[中图分类号] R56 [文献标识码] A [文章编号] 1673-7210(2020)07(c)-0012-06
Protective effect of Shegan Mahuang Decoction on lung tissue of rats with chronic obstructive pulmonary disease and regulation of EGFR/PI3K signaling pathway
XIE Liyuan1 LIU Lian2 JING Jing3 AN Na4
1.Department of Teaching, Xinjiang Uygur Autonomous Region Hospital of Traditional Chinese Medicine, Xinjiang Uygur Autonomous Region, Urumqi 830000, China; 2.Department of Emergency, the First People′s Hospital of Urumqi, Xinjiang Uygur Autonomous Region, Urumqi 830011, China; 3.Clinical Research Center, Xinjiang Uygur Autonomous Region Hospital of Traditional Chinese Medicine, Xinjiang Uygur Autonomous Region, Urumqi 830000, China; 4.School of Basic Medicine, Xinjiang Medical University, Xinjiang Uygur Autonomous Region, Urumqi 830011, China
[Abstract] Objective To study the effect of Shegan Mahuang Decoction on endothelial growth factor receptor (EGFR)/phosphatidylinositol-3 kinase (PI3K) signaling pathway and airway smooth muscle protection in rats with chronic obstructive pulmonary disease. Methods According to the random number table method, 75 SD rats were divided into five groups, namely, the control group, the model group, the low-dose, medium-dose and high-dose Shegan Mahuang Decoction groups, 15 rats in each group. Except for the control group, all the other rats established the rat model of chronic obstructive pulmonary disease. The rats in the low-dose, medium-dose and high-dose Shegan Mahuang Decoction groups were given 10, 20, 40 g/kg Shegan Mahuang Decoction by gavage respectively, once per day. Eight weeks later, the levels of tumor necrosis factor-α (TNF-α), interleukin (IL)-6 and IL-1β in bronchoalveolar lavage fluid, lung index, the lung tissue superoxide dismutase (SOD) activity and malondialdehyde (MDA) level, histopathological changes of lung tissue and airway tissue in rats, PI3K, EGFR mRNA levels and PI3K, EGFR protein levels of lung tissue were measured. Results Compared with the model group, the levels of TNF-α, IL-6 and IL-1β in bronchoalveolar lavage fluid, lung index, the levels of MDA, PI3K, EGFR mRNA and PI3K, EGFR protein in lung tissue were significantly decreased, SOD activity in lung tissue was significantly increased (P < 0.05), and histopathology of lung tissue and airway smooth muscle was significantly improved. Conclusion Shegan Mahuang Decoction can significantly reduce the level of inflammatory factors in bronchoalveolar lavage fluid and improve the oxidative stress injury of lung tissue and histopathological changes of airway smooth muscle in rats with chronic obstructive pulmonary disease. The mechanism may be related to the regulation of EGFR/PI3K signaling pathway.
[Key words] Shegan Mahuang Decoction; Chronic obstructive pulmonary disease; EGFR/PI3K signaling pathway; Airway smooth muscle protection
慢性阻塞性肺疾病是以不完全可逆的气流受限为特点的呼吸系统疾病。主要表现为咳嗽、咳痰、胸闷、气短等症状。由于目前临床上治疗慢性阻塞性肺疾病的药物有限,且伴有治疗效果不佳、不良反应多等特点,所以对于治疗慢性阻塞性肺疾病药物的研发仍是当前亟需解决的问题之一[1-2]。射干麻黄汤是基于中医理论指导下的中药成方制剂,用于治疗哮喘等多种呼吸系统疾病,且在临床应用中已表现出显著疗效[3-4]。然而射干麻黄汤对慢性阻塞性肺疾病大鼠的作用及机制,目前鲜见明确报道。本文通过研究射干麻黄汤对慢性阻塞性肺疾病大鼠EGFR/PI3K信号通路的调节及气道平滑肌的保护作用,以期为慢性阻塞性肺疾病的临床治疗提供新的参考和依据。
1 材料与方法
1.1 动物
75只清洁级成年雄性Sprague-Dawley(SD)大鼠,6~8周龄,平均体重(180±20)g,购买于新疆医科大学实验动物中心(生产许可证号:SCXK(新)2018-0002,合格证号:NO.650100400011222),动物房温度20~24℃,湿度40%~60%,适应性喂养1周后进行实验。动物实验设计计划严格经过新疆维吾尔自治区中医医院医学伦理委员会审查(批准号:IACUC201806)。实验过程中遵循“3R”原则。
1.2 药品及试剂
射干麻黄汤中药配方颗粒购自江阴天江药业有限公司(批号:20191105);脂多糖(LPS)购自北京索莱宝科技有限公司(货号:L8880);RIPA蛋白裂解液(货号:P0013B)、超敏ECL化学发光试剂盒(货号:P0018M),肿瘤坏死因子α(TNF-α)(货号:PT516)、白细胞介素(IL)-6(货号:PI328)及IL-1β(货号:PI303)酶联免疫吸附法(ELISA)检测试剂盒,超氧化物歧化酶(SOD)活性检测试剂盒(货号:S0103),丙二醛(MDA)检测试剂盒(货号:S0131),PI3K(货号:AF7749)、内皮生长因子受体(EGFR)(货号:AF1330)及GAPDH(货号:AF1186)抗体购自碧云天生物科技有限公司;RNA提取试剂盒(货号:AM1924)、cDNA逆转录试剂盒(货号:4374966)购自赛默飞世尔科技(中国)有限公司;氯化钠注射液(生理盐水)(500 mL,批号:2019120211)购自中国大冢制药有限公司。
1.3 主要仪器及设备
ECLIPSETS100-F型倒置显微镜购自日本Nikon公司;MRZ14M010型高速冷冻离心机购自美国Beckman公司;SpectraMax190型多功能酶標仪购自上海美谷分子仪器有限公司;ChemiDoc XRS型凝胶成像仪购自美国Bio-Rad公司;BX50/BX-FLA/DP70型光学/荧光显微镜购自日本Olympus公司。
1.4 慢性阻塞性肺疾病大鼠模型的建立
除15只大鼠作为对照组外,其余60只大鼠参照文献[5]方法建立慢性阻塞性肺疾病大鼠模型,具体方法为:将大鼠置入玻璃熏烟染毒箱内熏香烟烟雾,1次/d,10支/次,每熏烟5 d间歇2 d观察,并于第14、42、70天向大鼠气管注入0.2 mL的LPS溶液,然后立即将大鼠直立并旋转1周,使LPS在肺内均匀分布。对照组大鼠每只气管注入200 μL生理盐水,无特殊处理。以大鼠肺组织病理学改变及肺功能下降视为大鼠造模成功。将造模完成后的大鼠按照随机数字表法分为模型组、射干麻黄汤低、中、高剂量组,每组15只,射干麻黄汤低、中、高剂量组参照文献[6]根据大鼠体重按照10、20、40 g/kg的剂量灌胃给予大鼠射干麻黄汤中药配方颗粒(以生理盐水配置成混悬液),对照组及模型组灌胃给予等量生理盐水,1次/d,连续给药8周[6],各组大鼠最后1次给药24 h后,进行后续实验。
1.5 大鼠肺泡灌洗液TNF-α、IL-6及IL-1β水平的测定
每组取6只大鼠,腹腔注射10%水合氯醛麻醉后,从气管小口处分别用6 mL生理盐水灌洗左右肺各2次,回抽收集肺泡灌洗液,4℃下以1500 r/min,离心半径10 cm,离心15 min,取上清液,按照ELISA试剂盒说明书方法检测大鼠肺泡灌洗液TNF-α、IL-6及IL-1β水平。
1.6 大鼠肺指数测定
每组取6只大鼠,颈椎脱臼法处死后,将大鼠称重记为W1,迅速分离大鼠肺组织,对大鼠肺组织称重后记为W2,按照公式计算大鼠肺指数。大鼠肺指数=W2(g)/W1(g)×100%。
1.7 大鼠肺组织SOD活性及MDA水平的测定
每组取6只大鼠的肺组织,组织匀浆器匀浆,采用BCA法测定匀浆液中蛋白量,按照ELISA试剂盒说明书方法检测并计算大鼠肺组织SOD及MDA水平。
1.8 大鼠肺组织病理学检查
每组取6只大鼠进行实验,取大鼠肺组织,在10%中性甲醛中固定24 h后转移至75%的酒精中,脱水、透明处理,石蜡包埋后5 μm切片,水浴展开,捞片,沥干,置于烘箱中烤2 h,常规苏木精-伊红染色(hematoxylin-eosin staining,HE染色),在显微镜下进行组织病理学观察;切片常规脱蜡至水,进行masson染色,观察大鼠气道组织病理学变化。
1.9 实时定量PCR检测大鼠肺组织中PI3K、EGFR mRNA水平
每组取6只大鼠进行实验,取大鼠肺组织,采用RNA提取试剂盒提取大鼠肺组织中总RNA,然后逆转录成cDNA,荧光定量PCR检测各组大鼠肺组织中PI3K及EGFR mRNA表达。各检测基因的实时定量PCR引物见表1,以β-actin为内参,实时定量PCR结果采用2-△△Ct法计算相对表达量。
1.10 免疫组化检测大鼠肺组织中PI3K、EGFR蛋白表达
每组取6只大鼠,颈椎脱臼处死后分离肺组织,用4%多聚甲醛固定,石蜡包埋,进行3 μm切片。切片常规脱蜡至水,3%双氧水室温封闭20 min,枸橼酸盐缓冲液加热抗原修复,5%胎牛血清(BSA)封闭,37℃下放置30 min,滴加稀释的PI3K、EGFR一抗(1∶200),4℃过夜。次日使用磷酸缓冲盐溶液(PBS)冲洗后,依操作顺序加入二抗(1∶100稀释),37℃孵育15 min,PBS液冲洗;滴加辣根酶标记链霉卵白素(试剂C),37℃孵育15 min,PBS液冲洗;室温DAB显色,封片后应用显微镜观察,每一标本随机选取5个视野,在细胞浆内或细胞核内出现黄、棕色颗粒为阳性细胞,并计算免疫组化积分。将阳性细胞按染色强度评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;再按阳性细胞所占的百分比进行评分,0分为阴性,1分为0%<阳性细胞比例≤10%,2分为10%<阳性细胞比例≤50%,3分为50%<阳性细胞比例≤75%,4分为75%<阳性细胞比例≤100%;两者的乘积为免疫组化表达积分。
1.11 Western blot检测大鼠肺组织PI3K、EGFR蛋白水平
每组取6只大鼠进行实验,取大鼠肺组织放入玻璃匀浆器中,加入RIPA蛋白裂解液,用匀浆器匀浆,充分裂解,置于4℃离心机以12 000 r/min,离心半径15 cm,离心10 min,取上清液,加入SDS loading buffer,混匀后放入100℃水浴5 min,采用BCA法测定蛋白浓度,取50 μg蛋白进行SDS-PAGE电泳分离,转膜,将分离的蛋白电转移至PVDF膜上。封闭液室温封闭1 h,经PI3K、EGFR及GAPDH抗体(1∶1000)4℃孵育过夜。PBST充分洗膜后,加入二抗(1∶2000)室温孵育1 h,PBST清洗后显色液显影,利用凝胶成像仪成像后,应用Image J软件进行免疫印迹灰度值检测及定量分析。
1.12 统计学方法
采用SPSS 19.0统计学软件对所得数据进行分析及GraphPad Prism 5进行作图,计量资料采用均数±标准差(x±s)表示,组间比较采用单因素方差分析,两两比较采用LSD检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肺泡灌洗液TNF-α、IL-6及IL-1β水平比较
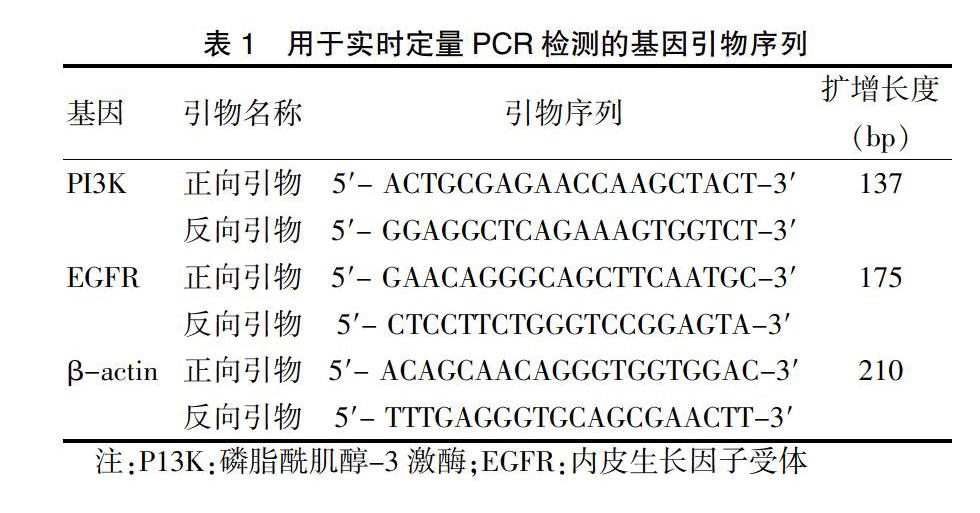
与对照组比较,模型组大鼠肺泡灌洗液TNF-α、IL-6及IL-1β水平均显著升高(P < 0.05);与模型组比较,射干麻黄汤各剂量组大鼠肺泡灌洗液TNF-α、IL-6及IL-1β水平均显著降低(P < 0.05)。见图1。
与对照组比较,*P < 0.05;与模型组比较,#P < 0.05。TNF-α:肿瘤坏死因子α;IL:白细胞介素
2.2 各组大鼠肺指数比较
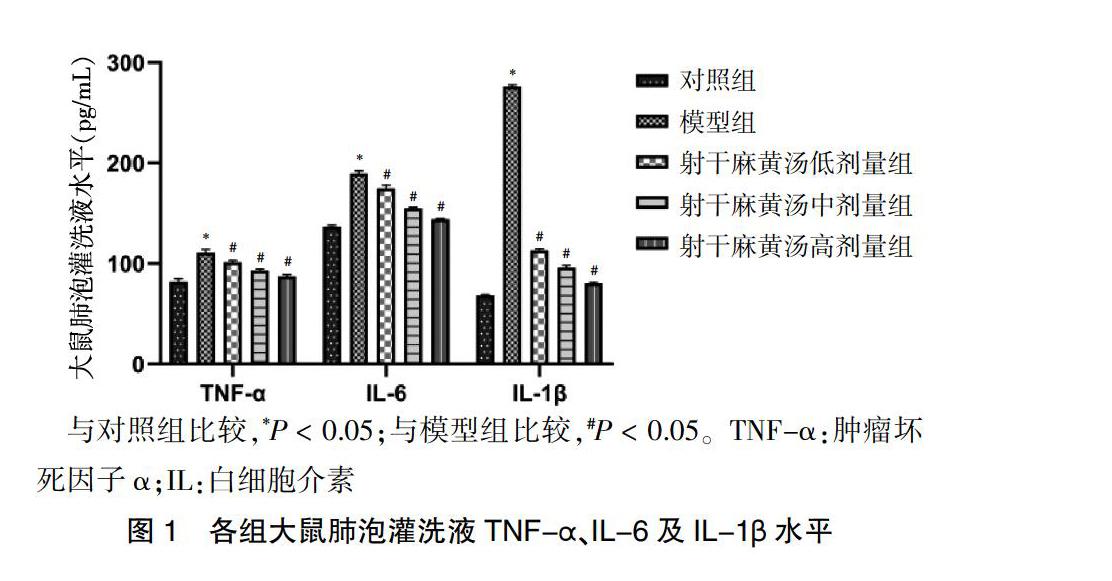
与对照组比较,模型组大鼠肺指数显著升高(P < 0.05);与模型组比较,射干麻黄汤各剂量组大鼠肺指数均显著降低(P < 0.05)。见图2。
2.3 各组大鼠肺组织SOD及MDA水平比较
与对照组比较,模型组大鼠肺组织SOD活性显著降低,MDA水平显著升高(P < 0.05);与模型组比较,射干麻黄汤各剂量组大鼠肺组织SOD活性显著升高,MDA水平显著降低(P < 0.05)。见表2。
2.4 各组大鼠肺组织病理学检查
对照组大鼠肺组织未见明显病理性改变,与对照组比较,模型组大鼠肺组织组织细胞排列不整齐,可见大量炎症细胞浸润及坏死细胞脱落,支气管管壁厚度及支气管平滑肌层厚度均明显增加;与模型组比较,射干麻黄汤各剂量组大鼠肺组织胶原沉积减少,炎症细胞浸润明显减轻,支气管壁厚度及支气管平滑肌厚度降低。见图3(封四)。
2.5 各组大鼠肺组织EGFR、PI3K mRNA水平比较
与对照组比较,模型组大鼠肺组织EGFR、PI3K mRNA水平显著升高(P < 0.05);与模型组比较,射干麻黄汤各剂量组大鼠肺组织EGFR、PI3K mRNA水平显著降低(P < 0.05)。见图4。
2.6 各组大鼠肺组织EGFR及PI3K蛋白水平比较
与对照组比较,模型组大鼠肺组织EGFR及PI3K蛋白水平及免疫组化表达评分均显著升高(P <0.05);与模型组比较,射干麻黄汤各剂量组大鼠肺组织EGFR及PI3K蛋白水平及免疫组化表达评分均显著降低(P < 0.05)。见图5、图6(封四)。
3 讨论
中国传统医学理论认为慢性阻塞性肺疾病可归于“肺胀”“咳嗽”等范畴内。中医古典医学著作《内经·灵枢》中记载,“肺胀者,虚满而喘咳”,肺胀之因,内有郁结,先伤肺气,复感外邪,肺气不得发泄,则成肺胀[7-8]。由于肺脏感邪,迁延不愈,失治误治,痰瘀稽留,从而損伤人体正气,致使风寒等邪气易于反复入袭[9]。
EGFR是表皮生长因子受体家族成员之一,主要分布于哺乳动物上皮细胞、成纤维细胞等细胞表面[10]。研究表明[11],机体内EGFR信号通路的异常表达与肺癌、乳腺癌等多种疾病的发生密切相关。PI3K是参与细胞增殖、分化等生理过程的重要信号通路[12],肺组织细胞PI3K的异常激活也会引发并加重肺组织病变[13]。陈英等[14]发现慢性阻塞性肺疾病大鼠发病机制与EGFR相关信号通路的异常激活有关,同时抑制EGFR等相关蛋白的表达能够显著改善大鼠的病理状态;李敏静等[15]研究发现慢性阻塞性肺疾病大鼠的发病机制与PI3K信号通路的异常有关,抑制PI3K及相关蛋白的表达能够显著抑制慢性阻塞性肺疾病大鼠气道平滑肌细胞的增殖;吴中华等[16]报道了鱼腥草素钠能够减轻慢性阻塞性肺疾病大鼠肺组织损伤,其机制也与抑制PI3K信号通路及相关蛋白的异常激活密切相关。
射干麻黄汤是以中医理论为指导,由射干、麻黄、生姜等多种中药材组成的中药成方制剂,记载于我国著名中医古典名著《金匮要略》,主要用于寒痰郁肺结喉等症状[3-4]。射干麻黃汤由射干(9 g),麻黄(12 g),生姜(12 g),细辛、紫菀、款冬花(各9 g),五味子(12 g),大枣(7枚),半夏(12 g)组成,是临床治疗肺疾病的常用方,方中射干、麻黄解表发汗,为君药;紫菀、款冬花温肺平喘为臣药;生姜、细辛可温肺化饮,五味子敛肺止咳,共为佐药;甘草止咳,调和诸药,为使药;全方同用,可使痰饮内消,进而缓解肺病患者症状。现代研究表明[17-18],射干麻黄汤对上呼吸道感染、哮喘等疾病有明显的改善作用。射干麻黄汤在支气管哮喘、小儿肺炎、难治性哮喘等临床应用中已取得显著疗效[19-24];齐红侠[25]研究报道射干麻黄汤联合常规西药治疗慢性阻塞性肺疾病能够显著提高效果,改善患者慢性阻塞性肺疾病评分,减少不良反应的发生。
TNF-α、IL-6及IL-1β水平是重要的炎症因子指标,TNF-α、IL-6及IL-1β水平的升高提示机体组织器官的炎症加重[23-24],SOD活性降低及MDA水平升高反映机体氧化应激损伤加重[26-29]。本实验结果提示,与模型组比较,射干麻黄汤各剂量组大鼠肺泡灌洗液TNF-α、IL-6及IL-1β水平、肺指数、肺组织MDA水平及PI3K、EGFR mRNA水平及PI3K、EGF蛋白水平降低,肺组织SOD活性显著升高,提示射干麻黄汤能够降低慢性阻塞性肺疾病大鼠肺组织炎症因子水平,缓解肺组织氧化应激状态及气道平滑肌病理性改变。
综上所述,射干麻黄汤明显降低慢性阻塞性肺疾病大鼠肺泡灌洗液炎症因子水平,改善大鼠肺组织氧化应激损伤及气道平滑肌病理学变化,其机制可能与调节EGFR/PI3K信号通路有关。
[参考文献]
[1] 王猛,唐志宇,曹文富.经方治疗慢性阻塞性肺疾病研究进展[J].实用中医药杂志,2020,36(3):405-407.
[2] 张文江,侯春艳,樊长征.从“虚-瘀-毒”论治慢性阻塞性肺疾病合并睡眠呼吸暂停综合征[J].中国医药导报,2018, 15(22):112-114.
[3] 朱金鑫.射干麻黄汤治疗难治性哮喘患者98例疗效观察[J].临床合理用药杂志,2014,7(17):47-48.
[4] 赵阳,王谦,刘会平,等.射干麻黄汤治疗小儿咳嗽变异性哮喘的Meta分析[J].中国实验方剂学杂志,2013,19(15):324-328.
[5] 李四维,张玲,李春雷,等.熏香烟加气管注入脂多糖和结合臭氧暴露法建立大鼠慢性阻塞性肺病模型[J].北京中医药大学学报,2014,37(5):321-324,364.
[6] 陈豪,陈军红,沈旭波,等.射干麻黄汤对哮喘性肺炎大鼠肺部炎症反应及免疫反应的影响[J].广州中医药大学学报,2020,37(2):317-323.
[7] 吕客,赵莹,丁惠卿,等.肺康复训练联合中药补肾固本冲剂在慢性阻塞性肺疾病患者稳定期的短期疗效观察[J].中医临床研究,2019,11(31):89-92.
[8] 叶玲,林小妹.金匮肾气丸联合玉屏风散补肾益气对慢阻肺大鼠IL-8、TNF-α、MMP-9、P-P65和IKB-α的影响[J].中国免疫学杂志,2019,35(15):1835-1839.
[9] 毛娅,李丹,蒋伟.清金化痰汤对慢阻肺模型大鼠气道炎症及气道粘液高分泌影响[J].四川中医,2019,37(1):44-47.
[10] 董盈妹,赵霞.粘蛋白5AC-EGFR通路与哮喘关系及中医药研究进展[J].浙江中医药大学学报,2014,38(12):1447-1450.
[11] 王均鹏,包明威.培哚普利对慢性阻塞性肺疾病大鼠肺组织PI3K及肺功能的影响[J].中国呼吸与危重监护杂志,2015,14(3):260-263.
[12] 张柳琴,陈颖,潘雪,等.EGFR敏感突变中晚期肺腺癌患者外周血中可溶性程序性死亡配体1的水平及其临床意义[J].中华医学杂志,2016,96(48):3870-3874.
[13] 林祥博,石文静,杨志一,等.间质表皮转化因子通过PI3K/AKT/MMPs信号通路促进肺腺癌细胞的侵袭转移[J].中国生物化学与分子生物学报,2019,35(6):648-654.
[14] 陈英,冯淬灵,李根茂,等.解毒清肺合剂对慢性阻塞性肺疾病气道黏液高分泌模型大鼠EGFR/MAPK信号转导通路的影响[J].中华中医药杂志,2016,31(5):1996-2001.
[15] 李敏静,陈晔,蔡宛如,等.温肾益气颗粒对慢性阻塞性肺疾病大鼠气道平滑肌细胞增殖及PI3K/AKT/mTOR信号通路表达的影响[J].中华中医药杂志,2019,34(4):1711-1714.
[16] 吴中华,闫玲玲,杨爱东,等.鱼腥草素钠对慢性阻塞性肺疾病模型大鼠肺组织PI3K、AKT1及mTOR mRNA表达的影响[J].中国实验动物学报,2018,26(1):8-12.
[17] 姚贇.射干麻黄汤联合孟鲁司特治疗感染后咳嗽疗效观察[J].实用中医药杂志,2016,32(11):1109-1110.
[18] 关登明.中药射干麻黄汤联合复方甲氧那明胶囊治疗咳嗽变异性哮喘的疗效观察[J].实用心脑肺血管病杂志,2012,20(10):1686-1687.
[19] 刘秀芳,丁辉,鲁珊,等.自拟射干麻黄汤治疗急性发作期慢性支气管炎的临床效果[J].中国医药导报,2018, 15(36):109-112.
[20] 戴磊,阮穗侨,姚丁铭.射干麻黄汤治疗支气管哮喘的随机对照试验的Meta分析[J].内蒙古中医药,2017,36(9):145-147.
[21] 连晓玲,郑泽亮,郑泽凯,等.射干麻黄汤联合沙丁胺醇治疗支气管哮喘发作期的临床研究[J].中国医药科学,2019,9(12):32-34,71.
[22] 蔡永德,陈有明.射干麻黄汤治疗小儿肺炎随机平行对照研究[J].实用中医内科杂志,2016,30(7):20-22.
[23] 肖宗浩.西药联合射干麻黄汤治疗小儿咳嗽变异性哮喘(寒性哮喘)的疗效及对血清IgE、IL-4、TNF-α水平的影响[J].中國医药科学,2019,9(4):40-42.
[24] 刘梅.射干麻黄汤联合西药对肺部感染后咳嗽老年患者的疗效观察[J].辽宁中医杂志,2016,43(4):795-797.
[25] 齐红侠.射干麻黄汤加减治疗慢阻肺急性加重期(寒饮伏肺型)的疗效分析[J].系统医学,2019,4(23):1-3.
[26] 宋敏,李清林,孙定平,等.活血定眩胶囊对椎动脉型颈椎病模型大鼠血清TNF-α、IL-6及IL-1β的影响[J].中华中医药杂志,2017,32(7):3174-3177.
[27] 巩子汉,王强,段永强,等.白及多糖对胃溃疡模型大鼠胃组织TNF-α、IL-1β、IL-6及JNK、p38 MAPK基因蛋白表达水平的影响[J].中药药理与临床,2019,35(4):90-95.
[28] 马林,章小梅,黄德裕.穴位埋线对慢性萎缩性胃炎大鼠胃黏膜形态及血清SOD、MDA含量的影响[J].广州中医药大学学报,2020,37(5):910-914.
[29] 尹彩星,龚清安,司小萌.不同浓度七氟醚对急性心肌缺血再灌注老龄大鼠血清、心脏5-HT、白细胞介素和海马组织SOD、MDA的影响[J].药物评价研究,2020, 43(4):700-705.
(收稿日期:2020-04-15)
