奶牛TLR4基因编码区生物信息学分析
2020-09-02高成宏文亮马博妍任稳稳李宏旭彭帅刘丽霞张丽
高成宏,文亮,马博妍,任稳稳,李宏旭,彭帅,刘丽霞,张丽
(1.西北民族大学生命科学与工程学院,兰州 730030;2.宁夏农垦贺兰山奶业有限公司,银川 750001)
Toll样受体(Toll-like receptors,TLRs)在哺乳动物及人类中已经发现了TLR1~TLR11等11个家族成员,其可通过区别不同病原体(Pathogen associated molecular pattern,PAMP)而激活免疫细胞,在先天性免疫和适应性免疫防御中发挥着重要作用。其中TLR4不但可以结合革兰氏阴性菌细胞壁上的脂多糖以及革兰氏阳性菌的磷壁酸的受体,诱导促炎症因子IL-1、IL-6、IL-8等基因的表达,还能够结合白色念珠菌、烟曲霉菌、结核分枝杆菌及新生隐球菌等相关的调控受体,在宿主免疫应答中发挥作用。此外,TLR4还可以识别如纤连蛋白、热应激蛋白、透明质酸及纤维蛋白原的低聚糖等宿主的致炎因子。当金黄色葡萄球菌及大肠杆菌感染泌乳期奶牛乳房时,会使牛乳中的TLR4介导因子浓度增加。因金黄色葡萄球菌感染而引起的奶牛乳房炎中,TLR4基因的表达量也较高。由此发现,TLR4在宿主乳房内感染免疫应答中有着非常重要的作用。
TLR4基因位于牛的8号染色体上,遗传多态性较丰富[1]。Goldammer等采用RT-PCR的方法分离出TLR4基因mRNA,利用荧光PCR及原位杂交的技术,得出乳房炎患牛乳中TLR4基因表达的丰度超过正常奶牛3倍以上[2]。鉴于此,本试验拟采用DNA池PCR和直接测序法对奶牛TLR4基因编码蛋白质的理化性质和结构功能进行预测,旨在为中国荷斯坦牛抗病育种提供分子生物学基础。
1 材料与方法
1.1 材料
在宁夏贺兰山乳业有限公司第三奶牛场,使用医用采血管采奶牛血10mL,低温保存。采用苯酚-氯仿抽提法从血样中提取总基因组DNA,用去离子水溶解稀释后,-20℃保存备用。
用Primer 5.0软件设计引物,引物序列为F-AGCCGATGGTATCTTCGAG;R-TTCTGAGTCTTCTCCAGAAGACAGG。扩增体系为20μL:去离子水7.4μL,Taq PCR Master 11μL;上下游引物各0.4μL;DNA模板0.8μL。PCR扩增体系为:94℃预变性5min,94℃变性30s,60℃退火30s,72℃延伸30s,35个循环;72℃延伸10min,4℃保存。PCR产物纯化后送苏州金唯智生物有限公司测序。
1.2 方法
运用在线软件对奶牛TLR4基因编码产物的氨基酸序列、蛋白质功能结构域进行预测,研究中所用的各种工具软件与网址见表1。

表1 蛋白结构功能预测方法及相关网址
2 结果与分析
2.1 碱基组成和编码氨基酸组成
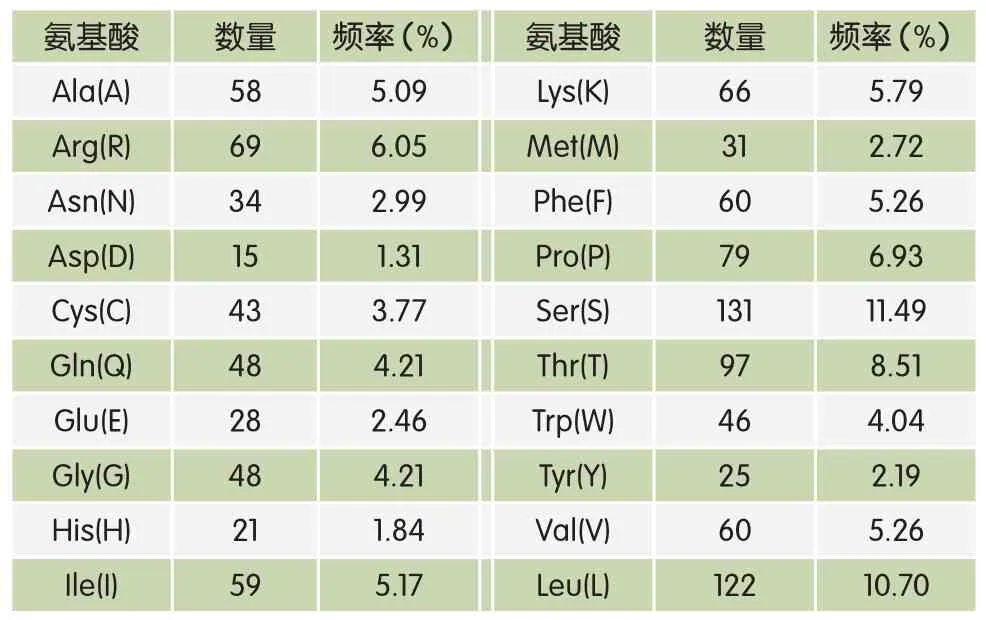
表2 编码氨基酸组成
奶牛TLR4基因编码区长3 738bp,共编码1 246个氨基酸残基(如表2)。A碱基有1 016个(27.18%),G碱基有795个(21.27%),T碱基有1 035个(27.69%),C碱基有889个(23.78%),其中A+T含量高于G+C含量;Ser(S)最多,为131个(11.49%),Asp(D)含量最少,为15个(1.31%)。
2.2 蛋白质二级结构
蛋白质二级结构(secondary structure)一般是指蛋白质多肽链沿主链骨架方向的空间走向、规则性循环式排列,或某一段肽链的局部空间结构[3],如图1结果显示α-螺旋(Hh)为329bp,延伸链(Ee)为30bp,无规卷曲(Cc)为378bp。
2.3 蛋白质三级结构

图1 蛋白质二级结构
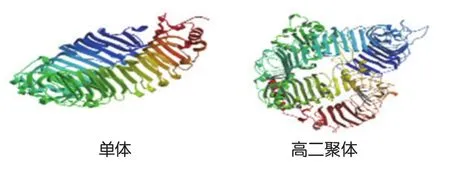
图2 蛋白质三级结构
蛋白质三级结构是指基于二级结构的构型,借助各种不同的二级键将其卷曲成特定空间分子结构。构建蛋白质三级结构立体表现蛋白结果显示(图2),该蛋白的覆盖率为0.72。无规卷曲较多,β-折叠较少。在细胞内、跨膜区、细胞外都有分布。
2.4 编码蛋白质的功能预测

表3 编码蛋白质的功能
在线预测奶牛编码蛋白质的功能结果(表3)表明,奶牛TLR4编码蛋白原子数为13 521个,其中H原子较多,分数正残数为0.09,等电点为6.74,说明该蛋白显酸性。分子体积为115 841.00V/M,脂肪族指数为105.75,其疏水性残基只有0.02,所以该蛋白可能为亲水性蛋白。
3 讨论
TLRs已经被证明是调控天然免疫反应与后天免疫调控的关键因子。TLR4可以依据细胞激活不同的信号通路,在病原体识别受体中有着重要作用[4]。生物信息学分析在分子生物学中的重要性不言而喻,可用计算机手段和生物学实验方法等识别DNA序列中的生物学特征。基因识别的主要对象是能够编码蛋白质的基因,也能识别拥有其他生物学功能的因子。研究表明,TLR4基因的表达与呼吸道炎症、呼吸系感染反应、肺炎等的产生、发展都有很大关系[5,6]。王兴平等[7]发现TLR4基因外显子由从C突变到T产生3种不同的基因型,其中AA型基因在抗乳房炎中表现为优势基因。刘文娇等研究表明CC型比TT型体细胞评分的均值要高出0.82[8]。在本课题组研究中也发现T基因型比C基因型略高。林宝山等[9]对牦牛TLR4编码蛋白质的二级结构进行描绘发现,其编码蛋白的α-螺旋占总量的38.29%;无规卷曲占总量的46.01%;延伸链占总量的15.70%。而本研究却发现序列长度为329bp的延伸链(Ee)为30(5.53%)。以上结果不同可能是由于所测群体不同所致。牛乳中的体细胞数(SCC)可以反映乳房炎的发病程度[10],Shook等[11]也发现乳房炎遗传力为0.02~0.04。
Wu等[12]发现通过微小RNA-146a(miR-146a)的TLR4炎症信号通路能够降低血管中肿瘤坏死因子受体相关因子6(TRAF6)而被调节。有研究发现,通过降低TLR4的表达可以有效减少心肌组织释放活性氧、产生炎性因子和发生炎症反应[13]。Awemu等[14]研究证明,牛乳腺、上皮细胞系(MAC-Tcells)和浓度不同的LPS共培养,TLR4与TLR2mRNA可以显著上调,而且MAC-T细胞内由TLR4信号所转导的MyD88依赖与非依赖途径被一起激活。Shi等[15]发现,游离的脂肪酸变多时巨噬细胞和脂肪细胞中TLR4的编码蛋白也会增多,Lien等[16]研究发现,当乳房被金黄色葡萄球菌与大肠杆菌感染时,牛乳中由TLR4所介导的可溶性CD14与脂多糖结合而编导蛋白的浓度会显著增加,TLR4的变异会引起宿主对与某些病原体特异性免疫发生变化,而TLR4基因在奶牛中的多态性一直具有高度性,TLR4基因的表达与乳房感染则具有较高的关联性。因此,TLR4基因可能成为辅助标记,选择作用于奶牛乳房炎抗性研究的候选基因,从而提高奶牛整体对乳房炎的抗病能力,降低奶牛乳房炎发病率。
