肾小管胆固醇结晶对IgA肾病预后的影响
2020-09-02梁少姗梁丹丹李溪玥曾彩虹
吴 丹 梁少姗 徐 峰 梁丹丹 李溪玥 朱 莹 汤 雯 杨 帆 曾彩虹,
动脉粥样硬化斑块内胆固醇结晶(cholesterol crystals,CCs)脱落随血流进入肾脏组织,可沉积于肾小动脉中,直接阻塞血流和(或)引起炎症致肾单位丢失[1-3]。由于CCs在常规组织学制备过程中被有机溶剂溶解,使其光镜下常表现为狭长、两头尖、腰部凸的梭形空隙这一独特的形态学改变。有关肾脏血管中CCs对组织及炎症的影响已多有报道。在肾小管中亦可见到与动脉中相似形态的结晶物,考虑为肾小管CCs。有关肾脏疾病伴肾小管CCs则缺乏研究。IgA肾病(IgA nephropathy,IgAN)是我国最常见原发性肾小球肾炎,多项临床(高血压、持续蛋白尿、活检时的肾功能受损和高尿酸血症)和病理指标(牛津分类)与预后相关。本研究旨在探讨肾小管CCs在肾脏疾病尤其是IgAN中的发生率,及伴CCs的IgAN的临床病理特点及预后。
研究对象与方法
研究对象(1)常规阅片观察2019年3月至2019年12月于国家肾脏疾病临床医学研究中心住院行自体肾活检患者的光镜切片5 025例,肾小管内见CCs者纳入研究,最终纳入34例患者。 (2)收集2006年1月至2010年12月于我中心进行IgAN牛津分类验证研究的患者,以及2018年1月至2019年12月我中心住院治疗经肾活检明确诊断为IgAN的患者共3 784例。
纳入标准:(1)肾脏病理明确诊断为IgAN;(2)活检时年龄≥18岁;并具有完整的临床病理资料。排除标准:(1)过敏性紫癜、类风湿性关节炎等继发性IgAN;(2) IgAN合并其他肾脏病,如糖尿病肾病、肥胖相关性肾病等;(3)合并有严重心、脑、肝、肺等疾病患者或影响其生存的严重疾病。最终纳入肾小管CCs阳性的IgAN患者147例,根据1∶ 3的比例在余下人群中随机选择(由电脑生成随机数根据病理号抽取)同期肾活检明确为IgAN的患者446例作为对照组。
资料收集(1)基本特征:性别、年龄、身高、体重并计算体质量指数(BMI)、高血压病史;(2)肾脏损害的临床表现及辅助检查:血清肌酐(SCr)、血清白蛋白(Alb)、三酰甘油(TG)、总胆固醇(CH)、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、尿酸(UA),24h尿蛋白定量、尿沉渣红细胞计数、肾小管功能指标等;(3)随访记录:治疗方法[是否应用血管紧张素转换酶抑制剂(ACEI)/血管紧张素Ⅱ受体拮抗剂(ARB),是否使用免疫抑制剂]、总随访时间、末次SCr,是否进展为终末期肾病(ESRD)及时间。
定义
病理 肾活检穿刺术采用B超定位负针吸引,标本常规送光镜、免疫荧光及电镜检查。观察项目包括:(1)肾小管急性病变:肾小管上皮细胞扁平、刷状缘脱落;(2)肾间质炎细胞浸润:炎细胞浸润程度;(3)嗜酸性细胞浸润:间质中见嗜酸性粒细胞;(4)小动脉透明变性;(5)肾间质泡沫细胞(interstitial foam cell,IFC);(6)袢坏死(N);(7)牛津评分由2名肾脏病理医师参照最新版IgAN牛津分型完成。
相关指标 CCs:光镜下肾组织可见狭长、两头尖、腰部突、边缘清晰的梭形空隙(图1);肾功能受损:活检时估算的肾小球滤过率(eGFR)<60 ml/(min·1.73m2);本研究采用EPI公式估算eGFR;低蛋白血症:Alb<30 g/L;高胆固醇血症:CH>6 mmol/L;高尿酸血症:男性UA>420 μmol/L,女性UA>360 μmol/L;尿N-乙酰-β-D-葡萄糖苷酶(NAG)升高:>9.7 U/(g·Cr);尿视黄醇结合蛋白(RBP)升高:>0.7 mg/L;慢性肾脏病(CKD)定义以及分期参考KDIGO标准;ESRD:eGFR<15 ml/(min·1.73m2)或开始肾脏替代治疗3个月。
统计分析本研究采用《SPSS 24.0》统计软件进行数据分析,符合正态分布的数据以均数±标准差表示,偏态分布数据以中位数(四分位间距)表示,组间比较采用t检验或者秩和检验;计数数据以频数、百分率表示,采用Pearson卡方检验或Fisher精确检验;采用Kaplan-Meier计算肾脏累积生存率。采用COX回归模型计算肾脏预后相关危险因素的风险比值(hazard rations,HR)。统计学检验均为双侧检验,P<0.05为差异有统计学意义。
结 果
胆固醇结晶的病理形态特点肾小管内结晶多孤立出现,有时一处管腔内可见多个CCs,少数亦见多处肾小管腔内存在CCs。肾小管内的结晶形态与血管中相似,表现为狭长、两头尖、腰部突、边缘清晰的梭形空隙,周围肾小管上皮细胞扁平,结晶周围炎症反应,偶见多核巨细胞,小管周围炎细胞浸润(图1)。未见肾动脉和肾小管同时存在CCs的病例。

图1 肾组织中胆固醇结晶(↑)A:肾脏小动脉内胆固醇结晶(PAS,×400);B、C:肾小管内胆固醇结晶,周围见炎细胞浸润(B:PAS,×400;C:Masson三色,×400);D:胆固醇结晶肉芽肿形成,肾间质纤维化(HE,×400)
不同疾病胆固醇结晶的发生和流行病学特征2019年3月至2019年12月自体肾活检患者共5 025例,CCs阳性患者共34例(0.68%),男性26例,活检时中位年龄31.5岁。7例在活检前诊断为高血压病,平均BMI为23.1±3.0 kg/m2。CCs在IgAN及具有肾脏意义的单克隆免疫球蛋白病(MGRS)中发生率显高于其他疾病(表1)。MGRS:AL型淀粉样变性37例,增生性肾小球肾炎伴单克隆IgG沉积11例(其中CCs1例),轻链沉积5例。
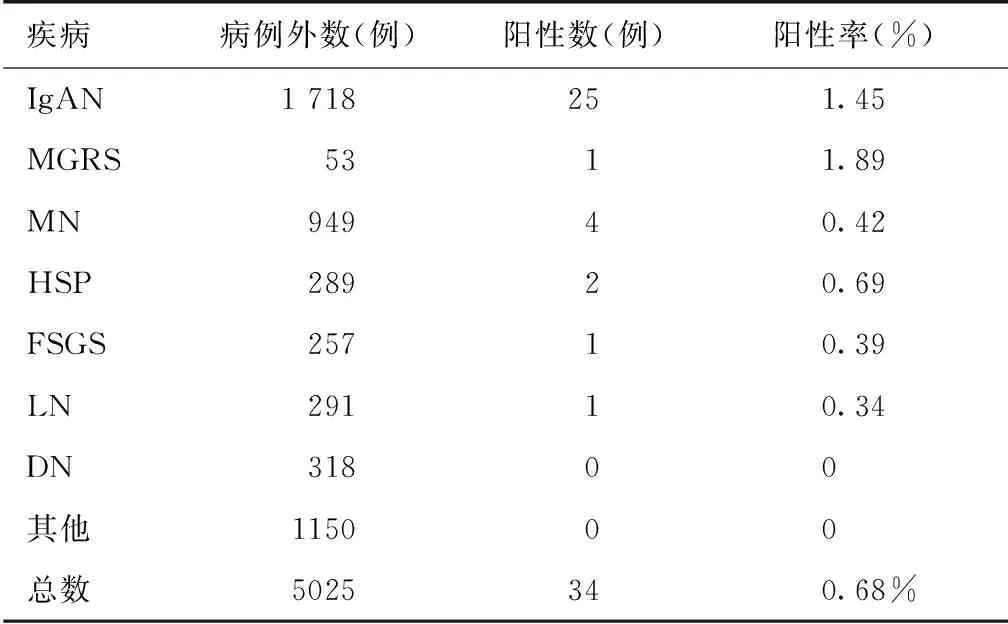
表1 不同肾脏疾病中胆固醇结晶阳性率
伴或不伴肾小管胆固醇结晶的IgAN患者的临床经筛查3 784例IgAN患者,伴肾小管CCs组中78例(78/147)肾活检前即出现高血压,显著高于对照组(138/446),两组IgAN患者基线资料比较见表2,伴肾小管CCs组男性比例更高(73.6%),病程更短,SCr、CH、TG、UA、尿蛋白定量、尿红细胞计数、肾小管损伤标志物等指标均高于对照组,Alb低于对照组,提示伴CCs的IgAN患者临床表现更加严重。
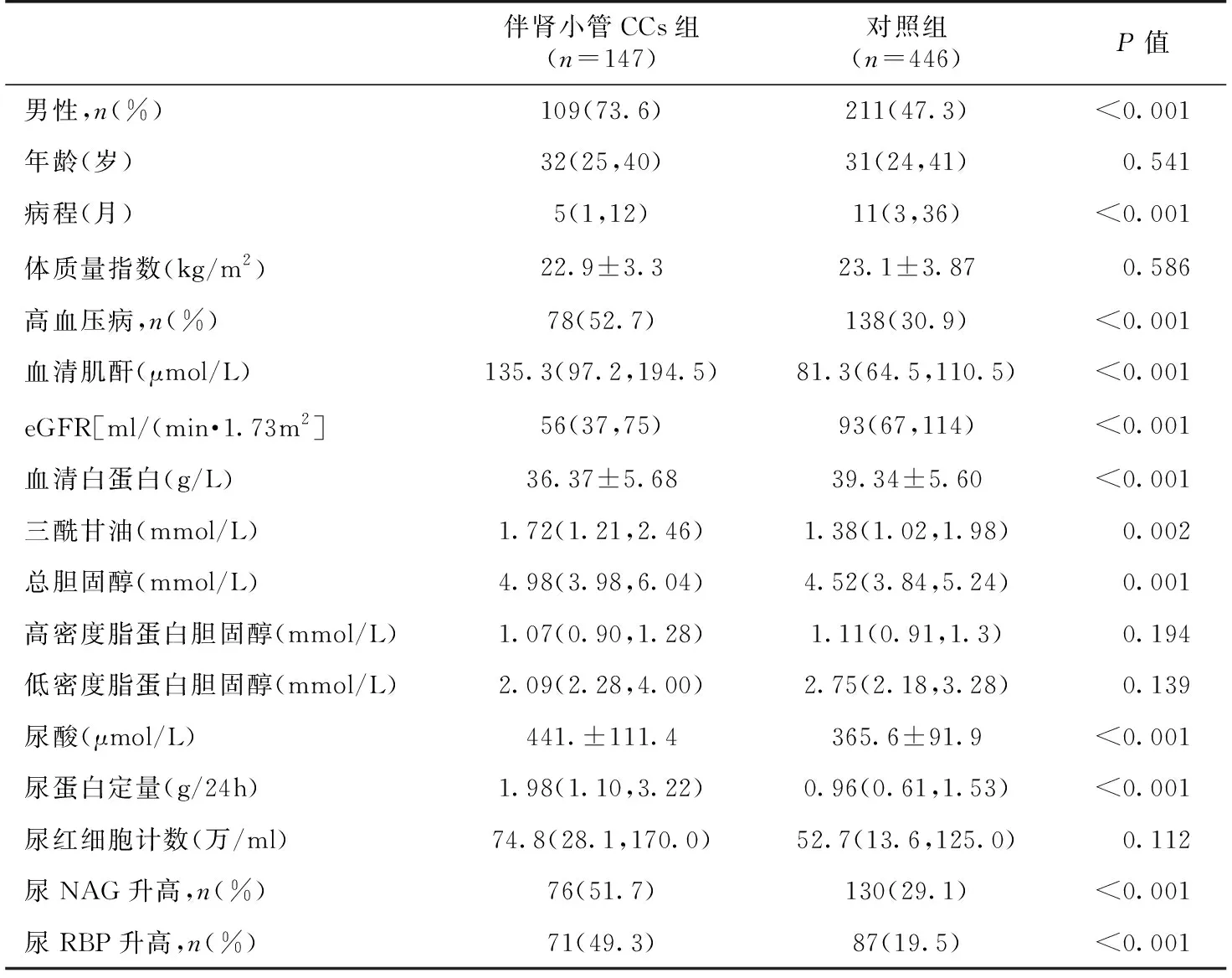
表2 IgA肾病患者中结晶阳性组与对照组基线资料比较
伴肾小管胆固醇结晶的IgAN患者病理表现 伴肾小管CCs的IgAN和无CCs的IgAN患者组织学特点比较见表3。伴肾小管CCs组在肾组织更易出现肾小管急性病变、间质炎细胞浸润、嗜酸性粒细胞浸润及肾间质泡沫细胞。而在IgAN牛津评分中,伴肾小管CCs组的系膜增生、节段硬化、新月体、肾小管萎缩/间质纤维化积分较对照组增高(表3)。

表3 伴或不伴肾小管胆固醇结晶IgA肾病患者组织学特点
伴肾小管胆固醇结晶的IgAN随访及预后伴肾小管CCs组中位随访时间 15.3月(7.1,100.5),对照组中位随访时间18.4月(10.9,90.8),无统计学差异。至本研究截止时间,共75例患者进入ESRD(伴肾小管CCs组38例,对照组37例),其中2例活检时eGFR<15 ml/(min·1.73m2),后续随访肾功能未恢复。根据随访资料绘制肾脏生存曲线(图2),Log Rank检验P<0.001,两组患者肾脏生存时间存在明显差异。在IgAN中,尿蛋白水平、肾功能受损程度、血压状态、高尿酸血症、T病变评分是患者进展至ESRD的独立危险因素,应用ACEI/ARB可改善患者预后。本研究对CCs及上述临床特征及病理指标进行单因素COX风险回归分析。并将有意义的变量纳入多因素COX回归模型后发现,CCs阳性(HR=1.83,P=0.047)、高胆固醇血症(HR=1.92,P=0.018)、肾活检时肾功能受损(HR=5.20,P<0.001)是影响肾脏预后的独立危险因素,而ACEI/ARB的使用则降低患者进入ESRD的风险(HR=0.29,P=0.001)(表4)。
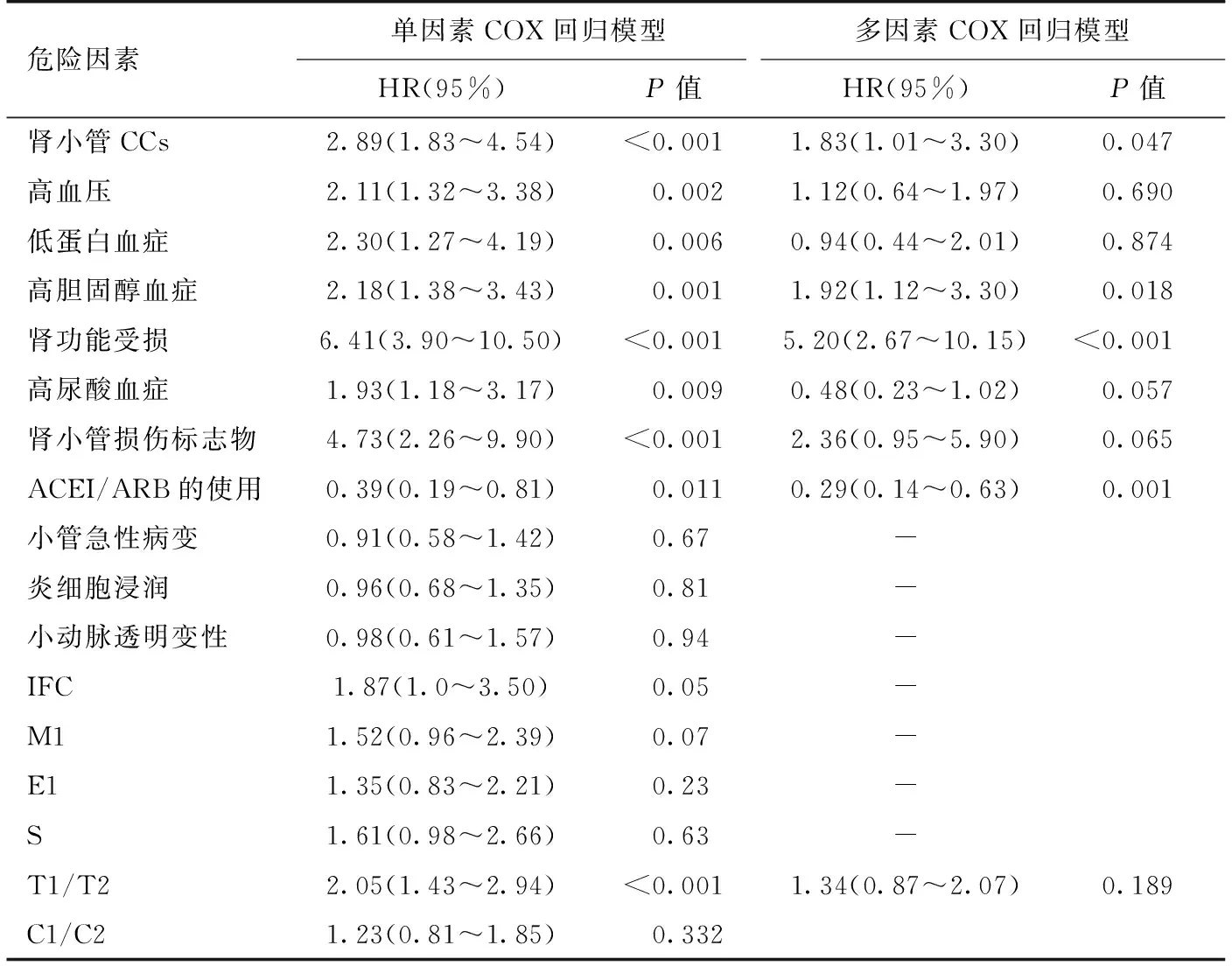
表4 肾活检临床指标与长期预后的关系
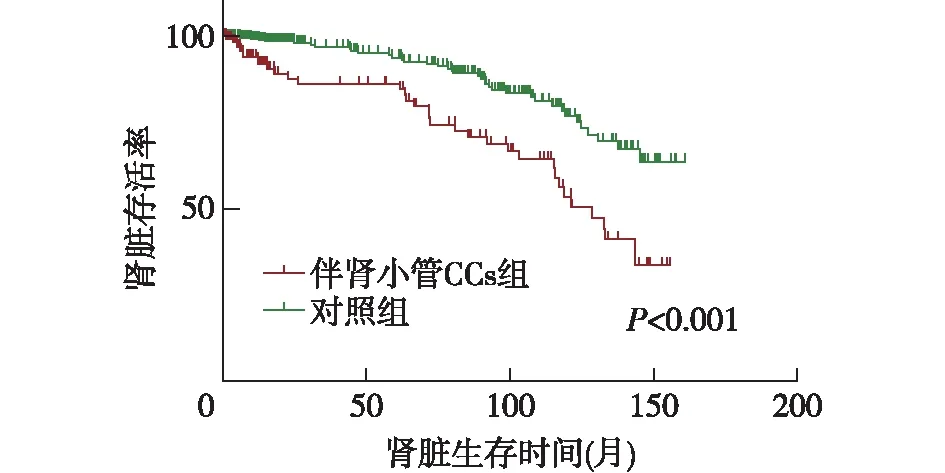
图2 伴肾小管CCs组与对照组患者的肾脏生存曲线比较CCs:胆固醇结晶
讨 论
胆固醇具有广泛的生理作用,在血液中绝大多数都是和脂肪酸结合的胆固醇酯,不到10%为游离胆固醇。胆固醇本身具有形成结晶的特性[4]。常见的CCs见于动脉粥样硬化斑块中,斑块破裂后结晶随血流可栓塞至肾脏。1986年Nast等[5]首次报道肾小管中CCs,该作者观察785例肾病综合征接受肾活检的病例,83例(10.5%)存在肾小管CCs,其中5例(0.6%)伴肾小管CCs肉芽肿性病变,2例为IgAN,2例为膜性肾病,1例为膜增生肾小球肾炎。但此后相关研究极少。本研究中肾小管CCs的总体发生率为0.68%,MGRS中仅1例出现CCs,其阳性率高与MGRS病例数少有关,而DN患者中是否可见肾小管CCs仍需进一步研究。
肾小管CCs多数在肾小管内孤立存在,不伴细胞反应(图1B),仅少数存在肉芽肿样病变(图1D)。此外,未发现肾小管和动脉CCs同时存在的病例。本中心曾报1例多发肾小动脉CCs,亦未见肾小管CCs同时存在[6],提示肾小管和肾小动脉CCs在形成机制和影响因素上可能存在差异。
IgAN以青壮年发病为主,在亚裔人群中,男女比例接近1∶ 1。本中心乐伟波观察12年间IgAN患者中男性比例为49.3%[7],本研究伴肾小管CCs的IgAN患者男性比例高达74.1%,提示肾小管CCs更易在男性IgAN中出现。伴肾小管CCs的IgAN高达52.7%的患者在活检时已出现高血压,高于同期对照组的30.9%(P<0.001)及本中心以往的IgAN报道[7]。本研究还发现伴和不伴肾小管CCs的IgAN患者相比,前者Alb更低,蛋白尿更多,SCr、血脂、血尿酸明显升高,CKD 3~5期的患者更多。病理形态学改变方面,伴CCs的IgAN患者,则表现为更多的病例肾小球存在M1、S1病变;肾小管间质急性病变更明显,包括间质炎症,其中嗜酸细胞的浸润明显高于对照组,间质泡沫细胞也更常见。提示伴肾小管CCs的IgAN临床和病理表现更重。
多因素分析还发现CCs阳性、高胆固醇血症、肾活检时肾功能受损是影响肾脏预后的独立危险因素,而ACEI/ARB的使用则降低患者进入ESRD的风险。我们前期的研究发现基线尿蛋白≥1g/d、高血压、肾功能不全、高尿酸血症等与IgAN预后明显相关[7],临床应加以重视。
有关肾小管内CCs形成机制,因肾小管上皮细胞接触复杂的蛋白尿成分,考虑两种来源,一是胆固醇在肾小管腔内积聚形成结晶,二是在肾小管胞浆内形成释放进管腔中。管腔内逐渐扩大的晶体可穿入肾小管上皮细胞和基底膜,引起间质单核细胞浸润,部分摄取晶体,转化为多核巨细胞。肾小管上皮细胞可以吞噬<10 μm的晶体进入细胞内,与溶酶体结合并试图通过蛋白水解酶消化晶体[8]。当溶酶体不能消化晶体时,引起膜破裂后溶酶体损伤。形成的CCs也可激活补体系统释放促炎细胞因子,并经炎症小体依赖的途径介导促炎性细胞因子白细胞介素1β(IL-1β)的活化和分泌。IL-1β进一步活化巨噬细胞和淋巴细胞,促进其他炎性因子和趋化因子释放。这些机制的研究多集中在动脉斑块中的CCs。也有研究人肾小管上皮细胞在高糖条件下培养24h即出现胆固醇蓄积现象[9],重组补体c1q/肿瘤坏死因子相关蛋白3(CTRP3)蛋白干预也能够抑制高糖条件下肾小管上皮细胞胆固醇蓄积[10]。本研究发现伴肾小管CCs的患者间质炎症浸润明显高于不伴CCs者,提示肾小管中的胆固醇促发炎症机制可能和肾动脉中CCs类似,但因为肾动脉的三层结构,其内结晶更常是脱落至小动脉,堵塞管腔。而肾小管上皮细胞为单层细胞,结晶突破肾小管基底膜,造成间质炎症反应,肾小管损伤也很明显,结晶作为异物,可以伴嗜酸细胞浸润。虽然有研究观察肾小管胆固醇负荷,但本研究未观察伴肾小管CCs的IgAN患者肾小管胆固醇水平,由于取材有限,也未在电镜观察肾小管中是否存在CCs。但间质泡沫细胞浸润增多提示巨噬细胞处理脂质存在异常,具体的机制需要更进一步的研究。
总之,肾脏疾病可伴发肾小管CCs,IgAN发生率高于其他疾病,伴肾小管CCs的IgAN临床病理表现重,预后更差,临床应加以重视,以期改善预后。
