1,25二羟维生素D3通过PI3K/Akt信号通路调控自噬抑制足细胞凋亡
2020-09-02张雅飞宋志霞
师 朗 张雅飞 方 旭 宋志霞,2
糖尿病肾病(DN)是糖尿病的一种严重并发症,是导致糖尿病患者死亡的主要原因之一。有研究表明,足细胞损伤是DN发生发展的重要因素[1-2]。有关足细胞损伤的机制尚未完全明确,仍缺乏有效的干预手段。因此,积极探寻高糖环境下足细胞的损伤机制,寻找特效治疗方法显得尤为重要。
自噬是真核细胞中普遍存在的细胞生物学过程。研究证实,一定水平的自噬对维持正常人足细胞的结构、功能以及代谢稳态有重要作用[3]。已有大量研究证实自噬异常与足细胞损伤密切相关。在阿霉素诱导的足细胞损伤模型中,自噬活化可以抑制足细胞的损伤,而在足细胞特异性敲除Atg7的小鼠足细胞损伤加重,该研究结果证实自噬在减轻足细胞损伤中发挥重要作用[4],亦有研究在糖尿病肾病中模型中观察到自噬活性能够减轻糖尿病肾病尤其足细胞损伤[5-6]。这些研究结果提示足细胞自噬活性的失调可能是DN足细胞损伤的关键因素[5]。因此,寻找有效的调节足细胞自噬的药物可能是防治DN足细胞损伤的关键。
活性维生素D3具有调节钙磷代谢以外的肾保护作用[7]。临床研究结果提示,缺乏1,25(OH)2D3是影响2型糖尿病患者预后的独立危险因素[8]。在1型及2型糖尿病动物模型也发现,维生素D干预可减少足细胞损伤,显著降低蛋白尿[8-9]。我们及其他学者前期研究发现1,25(OH)2D3可能通过上调磷脂酰肌醇3激酶/蛋白激酶(PI3K/Akt)信号通路,进而维持肾小球足细胞结构稳定[10-11]。本研究将进一步探讨活性维生素 D3是否通过PI3K/Akt调控肾脏足细胞自噬和足细胞损伤。
材料与方法
材料和试剂小鼠永生系足细胞MPC-5由上海酶研科技有限公司提供。1,25(OH)2D3(罗盖全)购于瑞士罗氏公司。
胎牛血清(北京百奥莱博科技有限公司);RPMI-1640培养液(杭州吉诺生物医药技术有限公司);抗体LC3Ⅱ、PI3K、Akt、Bcl-2、Bax和caspas-3(美国CST公司);PI3K抑 制剂LY294002(赛默飞科技有限公司);3-MA(美国Sigma-Aldrich公司);胰酶细胞消化液、青霉素-链霉素溶液、Triton X-100、DAPI(武汉碧云天生物公司);羊抗兔二抗(美国Santa Cruz公司);细胞计数试剂盒(CCK-8)(上海尚宝生物科技有限公司)。
方法
足细胞培养和分组 将永生性小鼠足细胞系MPC-5在含有10% FBS和100 U/ml γ干扰素(IFN-γ)的PMI-1640培养基中在33℃,5%CO2条件下培养增殖,然后在37℃,5% CO2条件下在无IFN-γ的RPMI-1640中孵育14d,诱导细胞分化。实验分组:(1)正常浓度葡萄糖(NG)组:葡萄糖 5 mmol/L;(2)高糖(HG)组:葡萄糖30 mmol/L;(3)甘露醇(NG+M)组:25 mmol/L甘露醇+葡萄糖5 mmol/L;(4)高糖+1,25(OH)2D3(HG+VD)组:葡萄糖 30 mmol/L+1,25(OH)2D3组[按照 1,25(OH)2D3浓度再分为1 nmol/L、50 nmol/L、100 nmol/L、200 nmol/L 组];(5)高糖+1,25(OH)2D3+自噬抑制剂 3-甲基腺嘌呤(HG+VD+ 3-MA)组:葡萄糖30 mmol/L + 1,25(OH)2D3100 nmol/L + 3-MA 5 mmol/L;(6)高糖+1,25(OH)2D3+PI3K 抑制剂 LY294002(HG+VD+ LY294002)组:葡萄糖30 mmol/L + 1,25(OH)2D3100 nmol/L + LY294002 20 μmol/L。以上各组均培养72h,实验至少重复3次。
Western印迹 MPC-5细胞在冷RIPA缓冲液中裂解,用10%SDS-PAGE分离蛋白,然后转移到PVDF膜(Thermo Fisher,Waltham,MA,USA)。再用含5%脱脂奶粉的PBS在4℃孵育3h,4℃与PI3K、Akt、Bcl-2、Bax、caspas-3、Beclin-1和P62一抗孵育过夜,再与荧光标记的二抗在37℃孵育1h,化学发光法进行检测并采用Image-Pro plus软件(Media Controbernetics Inc,Rockville,MD)分析相关蛋白的表达,并以GAPDH作为内参照。
CCK-8法检测细胞存活率 取对数生长期的MPC-5细胞,2×103个/皿接种于96孔培养板中,37℃、5%CO2培养箱培养12h,待细胞贴壁后弃去培养液,然后加入含不同浓度1,25(OH)2D3的培养基200 μl。1,25(OH)2D3的浓度分别1 nmol/L,50 nmol/L,100 nmol/L,200 nmol/L,500 nmol/L;每组均设6个复孔,在1,25(OH)2D3加入72h后,于每个时间点每孔加入10 μl CCK-8,37℃培养箱继续孵育1h,用酶联免疫检测仪450 nm波长检测各孔吸光度(OD值),细胞存活率=实验组OD/对照组OD×100%。
免疫荧光观察足细胞自噬情况 用30 mmol/L高糖诱导MPC-5细胞损伤,将损伤的细胞铺在特定的培养皿中,用100 nmol/L的1,25(OH)2D3处理细胞72h,使用10%甲醛(北京化工厂)室温固定细胞10 min,固定后用PBS洗3次,每次10 min。0.5%Triton X-100室温透化5 min,PBS洗3次。封闭血清封闭30 min,去除非染色质结合的蛋白质,10%血清室温封闭1h,PBS洗3次。加LC3-Ⅱ一抗4℃过夜,PBS洗3次,每次10 min。滴加FITC标记山羊抗兔IgG荧光抗体避光孵育1h,PBS洗3次。用75%甘油封片后,激光共聚焦显微镜下观察并拍照。
统计学分析使用《GraphPad 8.0》软件(美国加利福尼亚圣迭戈)进行统计分析。两组之间的P值是使用Studentt检验计算的,三组以上的P值是通过单向方差分析(ANOVA)来计算的。P<0.05为差异有统计学意义。
结 果
高糖诱导MPC-5细胞凋亡通过CCK-8法检测并计算MPC-5细胞存活率,其结果显示,与NG组比较,NG+M组无明显差异,但HG组细胞存活率下降(图1A)。Western印迹结果显示,与HG组相比,HG组细胞中Bcl-2蛋白表达水平下降、Bax和Caspase-3蛋白表达水平明显升高(图1B、C)。以上结果表明,高糖可诱导足细胞凋亡。

图1 高糖干预足细胞72h对细胞存活率(CCK-8)、Bcl-2/Bax及Caspase-3表达的影响(Western 印迹)NG:正常对照组;NG+M:甘露醇渗透压对照组;HG:高糖组;**P<0.01;n=3
1,25(OH)2D3减少高糖诱导的足细胞凋亡CCK-8检测结果显示,0~500 nmol/L 的1,25(OH)2D3对MPC-5细胞均无明显毒性(ns)(图2A)。不同浓度的1,25(OH)2D3可减轻高糖诱导的MPC-5细胞存活率下降,其中100 nmol/L的1,25(OH)2D3MPC-5对细胞存活率影响最大,且达到平台期(图2B)。故本研究选用100 nmol/L的1,25(OH)2D3为实验浓度。Western 印迹检测结果显示,相对于HG组,HG+VD组MPC-5细胞中抗凋亡蛋白Bcl-2表达升高,凋亡蛋白Bax、caspase-3表达水平降低(图2C、D)。上述结果提示,1,25(OH)2D3减轻高糖诱导的足细胞凋亡。

图2 1,25(OH)2D3 对高糖干预足细胞后72h细胞存活率(CCK-8)、BcL-2/Bax及Caspase-3表达的影响(Western 印迹)NG:正常对照组;HG:高糖组;HG+VD:高糖+1,25(OH)2D3;**P<0.01,*P<0.05;n=3
1,25(OH)2D3逆转高糖诱导的足细胞自噬下调Western印迹结果显示,与NG组相比,HG组Beclin-1蛋白表达减少,P62蛋白表达明显增多;与 HG组相比,HG+VD组细胞中Beclin-1蛋白表达增多,P62蛋白表达减少(图3A、B)。细胞免疫荧光结果显示,与NG组相比,HG组LC3-Ⅱ蛋白表达减少;与 HG组相比,HG+VD组细胞中LC3-Ⅱ蛋白表达增多(图3C、D)。上述提示1,25(OH)2D3可逆转高糖诱导的足细胞自噬的下调。
3-MA阻断活性维生素D对高糖诱导的足细胞损伤的保护作用与NG组相比,HG组细胞nephrin、podocin表达减少,Desmin表达明显增多;与HG组相比,HG+VD组细胞nephrin、podocin表达增加,desmin表达减少;与HG+VD组相比,HG+VD+3-MA组细胞nephrin、podocin表达减少,Desmin表达增多(图4C、D)。上述提示3-MA阻断了活性维生素D对高糖诱导的足细胞的损伤的保护作用。
1,25(OH)2D3对PI3K、Akt信号通路的影响与NG组相比,HG组细胞PI3K、p-AKT/t-AKT表达减少;与HG组相比,HG+VD组细胞PI3K表达增多、p-AKT/t-AKT表达增多(图5)。上述提示1,25(OH)2D3通过PI3K/Akt信号通路发出信号。

图3 1,25(OH)2D3 对高糖干预足细胞后Beclin-1、P62(Western 印迹)和LC3-Ⅱ(细胞免疫荧光)表达的影响NG:正常对照组;HG:高糖组;HG+VD:高糖+1,25(OH)2D3;**P<0.01,*P<0.05;n=3

图4 3-MA对高糖+1,25(OH)2D3干预足细胞后nephrin、podocin及desmin 蛋白表达的影响(Western 印迹)NG:正常对照组;HG:高糖组;HG+VD:高糖+1,25(OH)2D3;HG+VD+3-MA:高糖+1,25(OH)2D3+3-甲基腺嘌呤;**P<0.01,*P<0.05;n=3
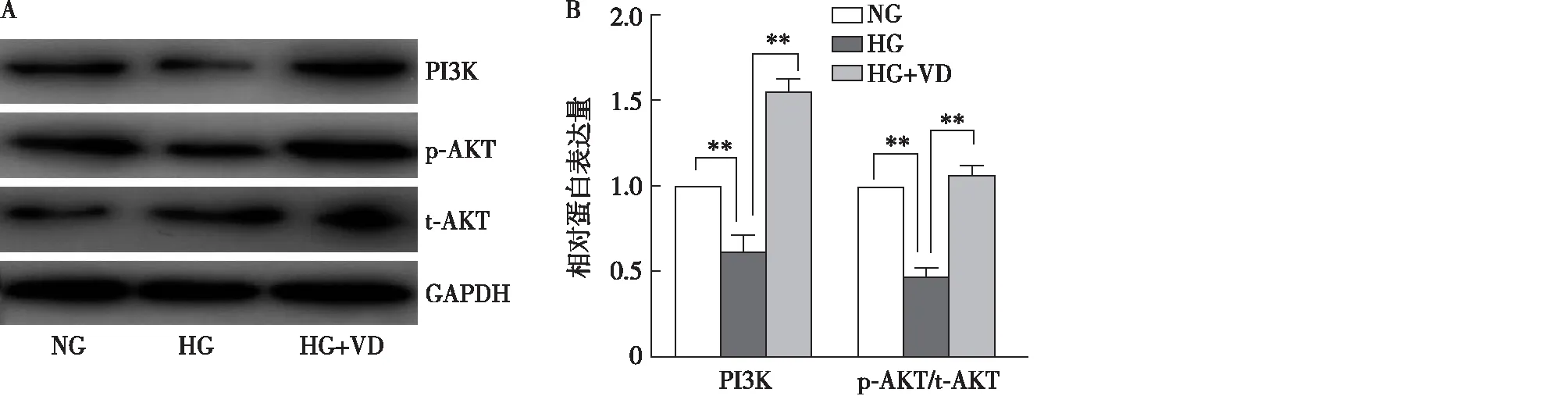
图5 1,25(OH)2D3 对高糖干预足细胞后PI3K及p-AKT/t-AKT表达的影响(Western 印迹)NG:正常对照组;HG:高糖组;HG+VD:高糖+1,25(OH)2D3;**P<0.01,*P<0.05;n=3
LY294002阻断1,25(OH)2D3对足细胞的保护和上调自噬的作用Western印迹结果显示,与NG组相比,HG组细胞nephrin、podocin表达减少,desmin表达明显增多;与HG组相比,HG+VD组细胞nephrin、podocin表达增加,desmin表达减少;与HG+VD组相比,HG+VD+LY294002组细胞nephrin、podocin表达减少,desmin表达增多(图6A、B)。上述提示LY294002阻断了1,25(OH)2D3对高糖诱导的足细胞的损伤的保护作用。另外,与NG组相比,HG组Beclin-1蛋白表达减少,P62蛋白表达明显增多;与 HG组相比,HG+VD组细胞Beclin-1蛋白表达增多,P62蛋白表达减少。与HG+VD组相比,HG+VD+LY294002组细胞Beclin-1蛋白表达减少,P62蛋白表达增多(图6C、D)。细胞免疫荧光结果显示,与NC组相比,HG组LC3-Ⅱ蛋白表达减少;与HG组相比,HG+VD组细胞LC3-Ⅱ蛋白表达增多。与HG+VD组相比,HG+VD+LY294002组细胞LC3-Ⅱ蛋白表达减少(图6E、F)。上述提示LY294002阻断了活性维生素对上调自噬的作用。

图6 LY294002对高糖+1,25(OH)2D3干预足细胞后nephrin、podocin、Beclin-1及P62蛋白表达(Western 印迹)和LC3-Ⅱ(细胞免疫荧光)表达的影响NG:正常对照组;HG:高糖组;HG+VD:高糖+1,25(OH)2D3;HG+VD+LY294002:高糖+1,25(OH)2D3+LY294002;**P<0.01,*P<0.05;n=3
讨 论
DN是糖尿病常见的微血管并发症,可引起肾小球滤过率(GFR)的进行性下降,最终进展至终末期肾病[12]。目前,临床上常通过控制血糖及使用ACEI和ARB改善肾功能等治疗手段,但仍不能完全有效地阻断终末期肾病的进展。因此,积极寻求新的、安全的治疗方法来进一步延缓DN的发展势在必行。
DN进展的主要标志是蛋白尿和GFR降低,其肾脏损害是由于肾小球滤过屏障在高度分化的足细胞水平上的损害所致[13]。足细胞在DN的发病机制中起关键作用[1-2]。有研究证实DN早期足细胞凋亡在其数量减少过程中发挥关键作用[14]。本研究显示,高糖环境可引起足细胞凋亡明显增加,这与既往研究结果一致[15]。
细胞自噬也称Ⅱ型程序性细胞死亡,是一种复杂的生理调控机制,其功能的行使受一系列相关基因产物的精密调节[16]。在糖代谢紊乱的代谢应激状态下,细胞主要依靠线粒体氧化脂肪酸和氨基酸作为主要能量来源,从而产生危险的活性氧,脂质和葡萄糖代谢的变化导致氨基酸缺乏进而影响自噬[17]。自噬作为一种保守的细胞内分解代谢途径,在足细胞对抗细胞损伤和维护自身结构和功能完整性的过程中发挥着重要作用[10]。有研究证实,足细胞可表现出很高的基础自噬活性,通过降解晚期糖基化终末产物(AGEs)来抑制炎症[18]。同时足细胞自噬活性的降低是DN足细胞损伤的关键因素[4-5]。本研究结果显示,足细胞在高糖环境中培养72h后足细胞自噬活性下降。由此可见自噬作为对抗足细胞损伤的主要保护机制的重要性,自噬活性增强对肾小球疾病具有一定的细胞保护作用。自噬活性降低增加了DN的易感性。
对糖尿病人群的进一步调查表明,维生素D缺乏症与DN之间存在独立的联系[19],其中一个大型队列研究AusDiab显示维生素D缺乏与eGFR受损之间存在显著相关性[20]。另外,发现维生素D及其类似物在临床的治疗中可使患者肾功能改善,尿白蛋白肌酐比率(UACR)降低,eGFR得以改善[21]。表明维生素D在延缓慢性肾脏病进程中可能发挥作用。Yao等[22]研究发现,1,25(OH)2D3相关受体能够对心肌缺血再灌注损伤小鼠模型心肌有保护作用,其机制是通过抑制心肌细胞凋亡和调节自噬实现的。我们课题组前期也发现,活性维生素D3可通过上调维生素D3受体(VDR)水平增强自噬活性[6]。上述研究表明,1,25(OH)2D3对于细胞凋亡及自噬功能的维持具有重要作用。本研究证实,活性维生素D可逆转高糖诱导的足细胞自噬的下调,自噬抑制剂3-MA可阻断活性维生素D对高糖诱导的足细胞损伤的保护作用。
多种信号转导通路参与足细胞自噬的调节,目前已有研究发现自噬的发生主要受到雷帕霉素靶蛋白(mTOR)、Ⅰ型磷脂酰肌醇三磷酸激酶(P13KC1)-蛋白激酶B(PKB)和PI3KC3等途径的调控[16]。mTOR是自噬的负性调控因子。高迁移率族蛋白1可通过抑制Akt/mTOR通路,减少足细胞自噬[23]。另外有研究表明影响PI3K/Akt信号通路可保护肾小球足细胞并改善蛋白尿[10,24]。目前有研究发现胰岛素、胰岛素样生长因子等与受体结合后可通过活化PI3K/Akt及其下游的复合物,抑制mTOR的激酶活性,对自噬发挥正向调节作用[24-25]。我们在实验中观察到,1,25(OH)2D3处理后,PI3K、p-Akt被激活,1,25(OH)2D3可通过MPC-5细胞的PI3K/Akt轴传递信号。通过LY294002阻断PI3K /Akt信号通路,减弱1,25(OH)2D3对足细胞的保护作用及上调自噬的作用。
综上所述,本研究发现1,25(OH)2D3可诱导足细胞自噬,抑制高糖诱导的足细胞损伤和凋亡,进而保护肾脏损伤,这一过程是可能通过PI3K/Akt信号通路实现的。本研究为活性维生素D治疗DN提供了证据,但其疗效机制及安全性仍需更多的研究证实。
