降亚硝酸盐乳酸菌筛选及榨菜汁发酵性能评价
2020-09-01陈晓镇周青青
郦 萍 陈晓镇 周青青 顾 青
(浙江工商大学食品与生物工程学院 浙江省食品微生物技术研究重点实验室 杭州310018)
中国传统的榨菜、欧洲的酸黄瓜、西德的甜酸甘蓝, 被称为世界三大著名腌菜, 深受消费者喜爱。传统工艺腌制榨菜大都采用固态高盐发酵,存在榨菜生产周期较长,食盐含量高,安全品质不稳定等问题。大量研究发现,榨菜在腌制过程中会产生大量的亚硝酸盐[1],人体摄入后,易与胃部食物中含有的仲胺类物质相互反应, 形成致癌物——亚硝胺,严重危害健康[2]。 我国国家标准对不同食品中亚硝酸盐的含量有不同规定, 榨菜中亚硝酸盐的含量最高限量为30 mg/kg(GB15198-94)[3]。
目前, 降解亚硝酸盐的方法主要包括生物降解、化学降解、物理降解等方法。 生物降解法因安全、高效而备受关注。 其中,乳酸菌是降解亚硝酸盐最有效的微生物[4-9]。 乳酸菌发酵榨菜不仅显著降低榨菜产品中亚硝酸盐的含量, 而且有助于改善自然发酵生产周期长,杂菌污染严重,品质不稳定等问题,提高榨菜产品的安全性[10-11]。 有研究表明, 不同乳酸菌菌株的亚硝酸盐能力存在显著差异。 本研究筛选1 株高效降解亚硝酸盐的乳酸菌菌株,对其在榨菜汁培养基中的生长、产酸特性进行研究, 为研制适于榨菜发酵的乳酸菌菌剂及生产应用奠定基础。
1 材料与设备
1.1 菌种来源
试验菌种,从健康新生婴儿粪便、鲜牛奶、发酵果蔬、发酵乳制品等分离获得。
1.2 主要试剂和药品
无水葡萄糖、柠檬酸铵、牛肉浸提物、酵母提取物、胰蛋白胨、琼脂粉、MgSO4·7H2O、CH3COONa、Tween-80、NaCl、MnSO4、K2HPO4,浙江常青化工有限公司;对氨基苯磺酸、乙酸锌、亚硝酸钠、盐酸萘乙二胺、硼酸钠、亚铁氰化钾,国药集团化学试剂有限公司。
1.3 培养基
MRS 液体培养基: 酵母提取物5 g/L、K2HPO42 g/L、牛肉膏10 g/L、柠檬酸氢二铵2 g/L、蛋白胨10 g/L、 无水葡萄糖20 g/L、CH3COONa 5 g/L、Mg-SO4·7H2O 0.2 g/L、MnSO40.05 g/L、Tween-80 1 mL/L,分装后121 ℃灭菌15 min。在固体培养基中添加2%琼脂。 含2%碳酸钙的MRS 培养基:在MRS 基础上添加2%碳酸钙。
1.4 主要仪器和设备
尤尼柯2000 可见分光光度计,尤尼柯(上海)仪器有限公司;pH 酸度计(PB-10),梅特勒-托利多仪器(上海)有限公司;生物安全柜,美国Thermo;恒温培养箱SPX-150B-Z,上海博讯实业有限公司医疗设备厂;全自动灭菌锅,美国Tuttnauer;小型离心机, 美国Thermo; 一次性无菌注射器,浙江常青化工有限公司。
2 试验方法
2.1 分离纯化
将不同来源的样品(健康新生婴儿粪便、鲜牛奶、发酵果蔬、发酵奶制品等)用MRS 液体培养基培养,稀释成梯度浓度后涂布,于37 ℃培养。 筛选溶钙圈明显的菌落,用20%甘油4 ℃保存。经生理生化试验及16S rDNA 序列鉴定分析, 确定菌株分类。
2.2 亚硝酸盐标准曲线的绘制
按照国标GB 5009.33-2010 《食品中亚硝酸盐与硝酸盐的测定》中盐酸萘乙二胺法[12]绘制亚硝酸盐的标准曲线。
2.3 降解亚硝酸盐乳酸菌的筛选
筛选获得的乳酸菌于MRS 液体培养基中活化,接种至MRS 培养基(50 mL 培养基/250 mL 三角瓶), 接种量为体积分数3%,37 ℃静置培养48 h。 用1 mol/L 氢氧化钠将培养基pH 值调至6.0,加入配制好的无菌NaNO2标准液,使培养基中最终含量为125 μg/mL,静置培养(37 ℃,黑暗),发酵液中NaNO2含量在24 h 后测定。空白试验组用无菌水接种。 每个试验重复3 次。
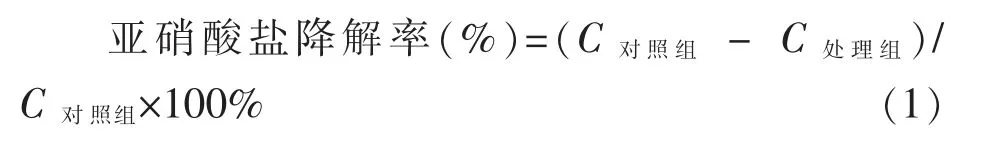
式中:C对照组——对照组(未处理组)NaNO2的浓度,mol/L;C处理组——乳酸菌处理后NaNO2的浓度,mol/L。
2.4 榨菜汁培养基的制备
榨菜经洗净、打浆、抽滤,取榨菜汁250 mL,加蒸馏水250 mL、氯化钠20 g、葡萄糖20 g,混匀,于121 ℃,15 min 灭菌,备用。
2.5 降亚硝酸盐乳酸菌的发酵特性研究
对植物乳杆菌LZ227、ZFM228 和ZJ316 的发酵特性进行研究。
2.5.1 接种量的确定 将筛选到的植物乳杆菌LZ227、ZFM228、ZJ316 分别以1%,2%,3%,4%,5%接种量接种到灭菌的榨菜汁培养基中,37 ℃培养24 h 后测定活菌数。
2.5.2 菌株生长曲线和产酸特性测定 植物乳杆菌LZ227、ZFM228、ZJ316 的接种量(体积分数)分别为3%,4%,3%, 接种至灭菌的榨菜汁培养基,37 ℃培养,每隔6 h 测定波长600 nm 处的吸光度值(细菌细胞生长量),并测定pH 值及产酸率。 以培养时间为横坐标, 以对应时间点的吸光度值、pH 值和产酸率为纵坐标,绘制菌株生长曲线和产酸特性曲线。 以酚酞为指示剂,用0.10 mol/L 氢氧化钠溶液滴定酸,测定产乳酸率。
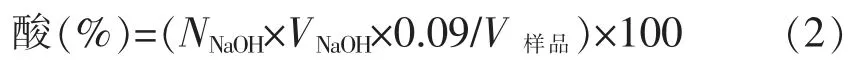
式中:NNaOH——滴定酸所用NaOH 的浓度,mol/L;VNaOH——滴定酸所用NaOH 的体积,L;V样品——样品体积,L。
2.5.3 榨菜汁培养基中乳酸菌发酵产生的挥发性风味物质测定
2.5.3.1 样品处理 将植物乳杆菌LZ227、ZFM228、ZJ316 按3%,4%,3%的体积分数接种至灭菌的榨菜汁培养基,37 ℃培养。24 h 后取10 mL装入15 mL 顶空进样瓶中,将顶空进样瓶放入50℃水浴锅内加热30 min,备用。
2.5.3.2 顶空固相微萃取条件 将已老化处理的萃取头插入进样瓶的顶空部分,50 ℃温度下平衡吸附30 min 后插入GC 进样口, 启动仪器采集数据,解吸20 min。
2.5.3.3 GC-MS 分析条件 7890A/5975 GC/MS联用仪,色谱柱:HP-5MS 型 (30 m×0.250 mm×0.25 μm);进样温度:230 ℃;进样量:1 μL;升温程序: 初温45 ℃保持2 min,5 ℃/min 上升至180 ℃,保持1 min,25 ℃/min 升至230 ℃,保持5.5 min;载气:氦气。 由计算机质谱系统NSIT 检索未知化合物, 将匹配度大于70%的结果采用面积归一法计算含量。
2.6 榨菜汁培养基中乳酸菌对亚硝酸盐的降解率
在含NaNO2(125 μg/mL)的榨菜汁培养基中培养植物乳杆菌LZ227、ZFM228 和ZJ316, 每隔12 h 测定亚硝酸盐降解率,按公式(1)计算。 将NaNO2添加至已灭菌的榨菜汁培养基作为空白对照。 重复试验3 次。
2.7 植物乳杆菌ZJ316 的亚硝酸盐耐受性
将植物乳杆菌ZJ316 接种到含一系列质量浓度梯度的NaNO 培养基中(0,0.4,0.8,1.2,1.6,2.0,……,10.0 mg/mL),37 ℃培养48 h,测定OD600。
3 结果与讨论
3.1 亚硝酸盐标准曲线
按照2.2 节方法, 分别准确吸取一系列亚硝酸钠标准使用液(0.00,0.20,0.40,0.60,0.80,1.00,1.50,2.00,2.50 mL), 使亚硝酸盐含量分别为0.00,1.00,2.00,3.00,4.00,5.00,7.50,10.00,12.50 μg 亚硝酸钠,绘制亚硝酸盐标准曲线(图1)。其线性方程式为y=0.0241x+0.0001(R2=0.9999),标准曲线线性良好,可用于测定亚硝酸盐含量。
3.2 降亚硝酸盐乳酸菌的筛选
筛选培养基平板上钙溶圈直径及钙溶圈直径与菌落直径比均特别大的菌落, 挑取单菌落并活化培养,经生理生化试验及16S rDNA 测序分析,确定菌种分类。 按2.3 节方法研究单菌株对亚硝酸盐的降解能力。 其中9 株具有亚硝酸盐降解能力。 结合亚硝酸盐标准曲线方程求得各菌株的亚硝酸盐降解率,其降解亚硝酸盐能力见表1。 对初始含量为125 μg/mL 的亚硝酸盐降解率在90%以上的菌株有5 株,降解率80%~90%之间的菌株2株,降解率70%~80%和60%~70%之间的菌株各1株。 其中植物乳杆菌LZ227、ZFM228 和ZJ316 对亚硝酸盐降解率达93%以上,NaNO2残留量分别为8.28,8.69 μg/mL 和4.14 μg/mL,表现出强降解亚硝酸盐的能力。将其作为重点研究菌株,对生长特性及在榨菜汁中的发酵特性进行深入研究。
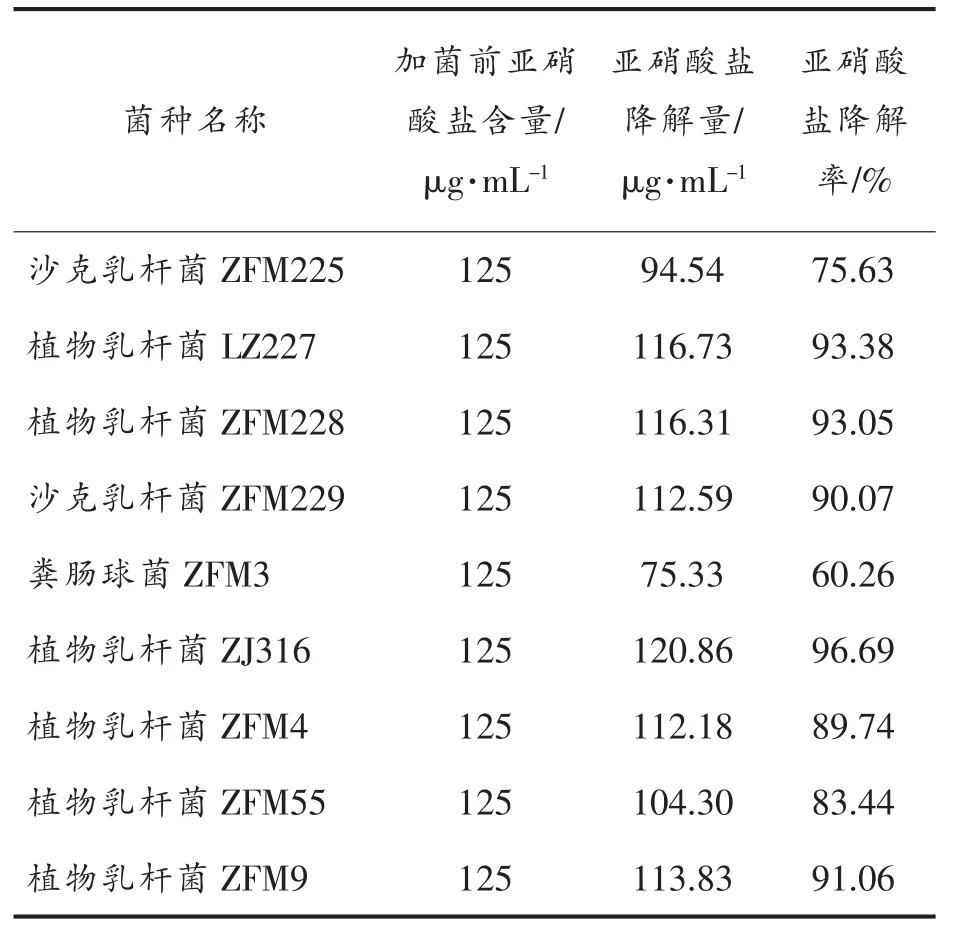
表1 菌株发酵液中亚硝酸盐降解率Table 1 Nitrite degradation ability of different lactic acid bacterium strains
3.3 降亚硝酸盐乳酸菌的生长特性
3.3.1 3 株乳酸菌(LZ227、ZFM228、ZJ316)接种量的确定 接种量对乳酸菌的生长有一定影响,接种量过少不利于乳酸菌高密度生长, 而接种量过高,会导致乳酸菌短时间内生长旺盛,后期因营养缺乏而致部分菌体死亡。 由图2 可知3 株菌种的最适接种量为: 菌种LZ227 3%, 菌种ZFM228 4%,菌种ZJ316 3%。
3.3.2 3 株乳酸菌(LZ227、ZFM228、ZJ316)在榨菜汁培养基上的生长曲线和产酸特性 3 株乳酸菌都能很好地适应榨菜发酵环境, 在榨菜汁培养基中生长情况良好, 其中以植物乳杆菌ZJ316 生长情况最好(图3)。 在榨菜发酵过程中,主导发酵的乳酸菌会分泌乳酸、乙酸等有机酸,在赋予榨菜产品独特风味的同时,致环境pH 的下降,抑制好氧杂菌的生长,这对保证榨菜的安全性至关重要。考察3 株乳酸菌利用榨菜汁培养基发酵产酸的情况,衡量乳酸菌发酵性能。由图4 和图5 可知3 株乳酸菌均能利用榨菜汁培养基产酸, 植物乳杆菌ZJ316 在榨菜汁培养基中产酸速度最快, 培养至24 h 发酵液的pH 值降至4.10, 可滴定酸度达0.14%,低pH 值有利于减少亚硝酸盐的富集,从而减少发酵榨菜中亚硝酸盐的含量[13]。
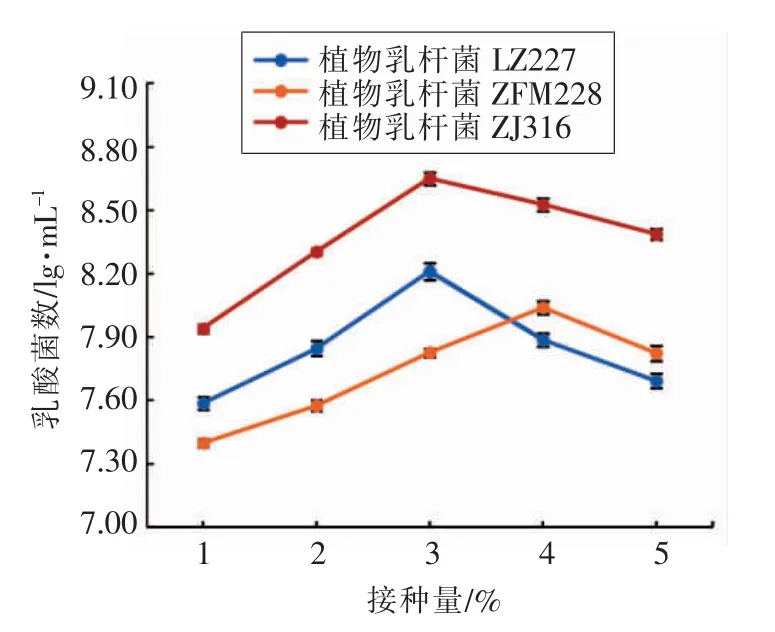
图2 初始接种量对乳酸菌生长的影响Fig.2 Effect of initial inoculation on growth of lactic acid bacteria
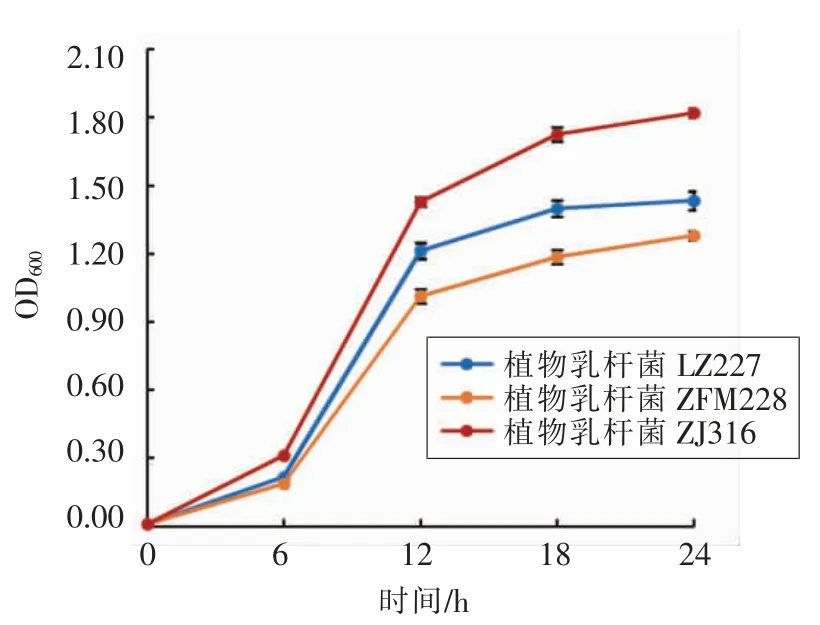
图3 榨菜汁培养基上乳酸菌的生长曲线Fig.3 Lactic acid bacteria growth curve on mustard juice medium
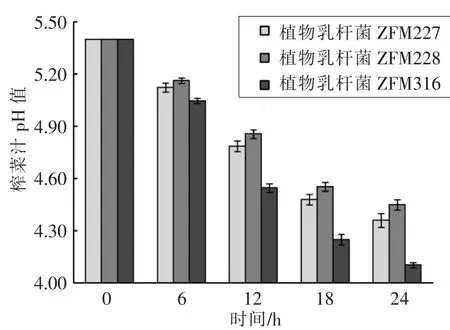
图4 榨菜汁培养基上乳酸菌pH 值变化Fig.4 Changes of pH of lactic acid bacteria in mustard juice medium

图5 榨菜汁培养基上乳酸菌可滴定酸的变化Fig.5 Changes of titratable acid of lactic acid bacteria in mustard juice medium
3.4 榨菜汁培养基上3 株乳酸菌对亚硝酸盐的降解率
菌株LZ227、ZFM228 和ZJ316 在榨菜汁培养基上降解亚硝酸盐的复筛结果见图6。 3 株菌经36 h 的培养,亚硝酸盐降解率在80.00%以上。72 h时亚硝酸盐降解率分别为90.30%,89.60%和95.23%, 其中植物乳杆菌ZJ316 降解亚硝酸盐速度较快,降解能力最强。
3.5 植物乳杆菌ZJ316 的亚硝酸盐耐受性
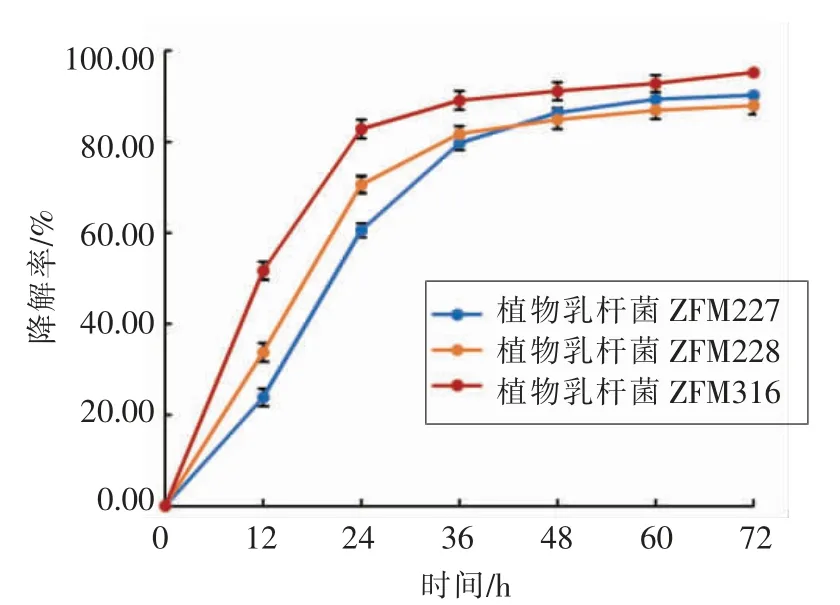
图6 植物乳杆菌LZ217、ZFM228、ZJ316 对亚硝酸盐降解的影响Fig.6 Effect of L. plantarum LZ217,ZFM228,ZJ316 on nitrite degradation
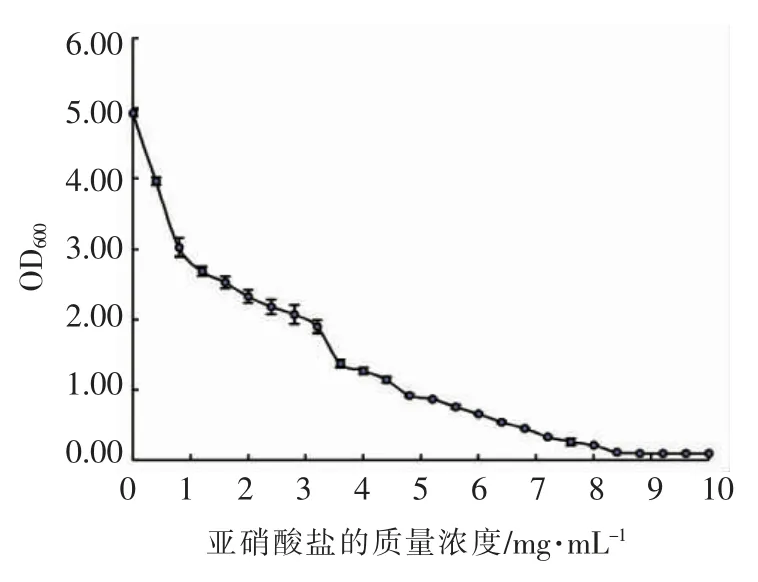
图7 ZJ316 对亚硝酸盐的耐受性Fig.7 The tolerance of ZJ316 on nitrite
考察了植物乳杆菌ZJ316 在不同亚硝酸盐浓度的耐受性,结果见图7。 植物乳杆菌ZJ316 在亚硝酸盐质量浓度3.20 mg/mL 时,乳酸菌仍能正常生长; 当亚硝酸盐质量浓度达3.60 mg/mL 时,乳酸菌生长受到明显抑制; 当亚硝酸盐质量浓度为4.80 mg/mL 时,乳酸菌生长受到严重抑制;当亚硝酸盐质量浓度大于8.40 mg/mL 时,乳酸菌几乎不生长。 由此得出植物乳杆菌ZJ316 耐受硝酸盐质量浓度范围为0~3.60 mg/mL。
3.6 榨菜汁挥发性风味物质的测定
发酵样品通过固相微萃取处理后, 挥发性风味物质的种类及相对含量用GC-MS 测定并分析。如表2 所示,3 组发酵榨菜中含量较高的物质为乙酸、辛酸、月桂酸、含硫化合物、甘油芥酸酯,这些物质为榨菜的主要风味成分。 植物乳杆菌ZJ316、发酵组、植物乳杆菌LZ227、植物乳杆菌ZFM228 和对照组分别检出33 种物质、27 种物质、31 种物质、18 种物质。 在植物乳杆菌发酵组中,醇类和酸类均多于对照组。醇类和酸类是影响榨菜风味的主要化合物, 赋予榨菜优良的发酵风味。另外,感官嗅觉分析表明接种组比对照组香气更强烈。 植物乳杆菌ZJ316 发酵组的醇类与酸类物质含量明显优于植物乳杆菌LZ227 和植物乳杆菌ZFM228。
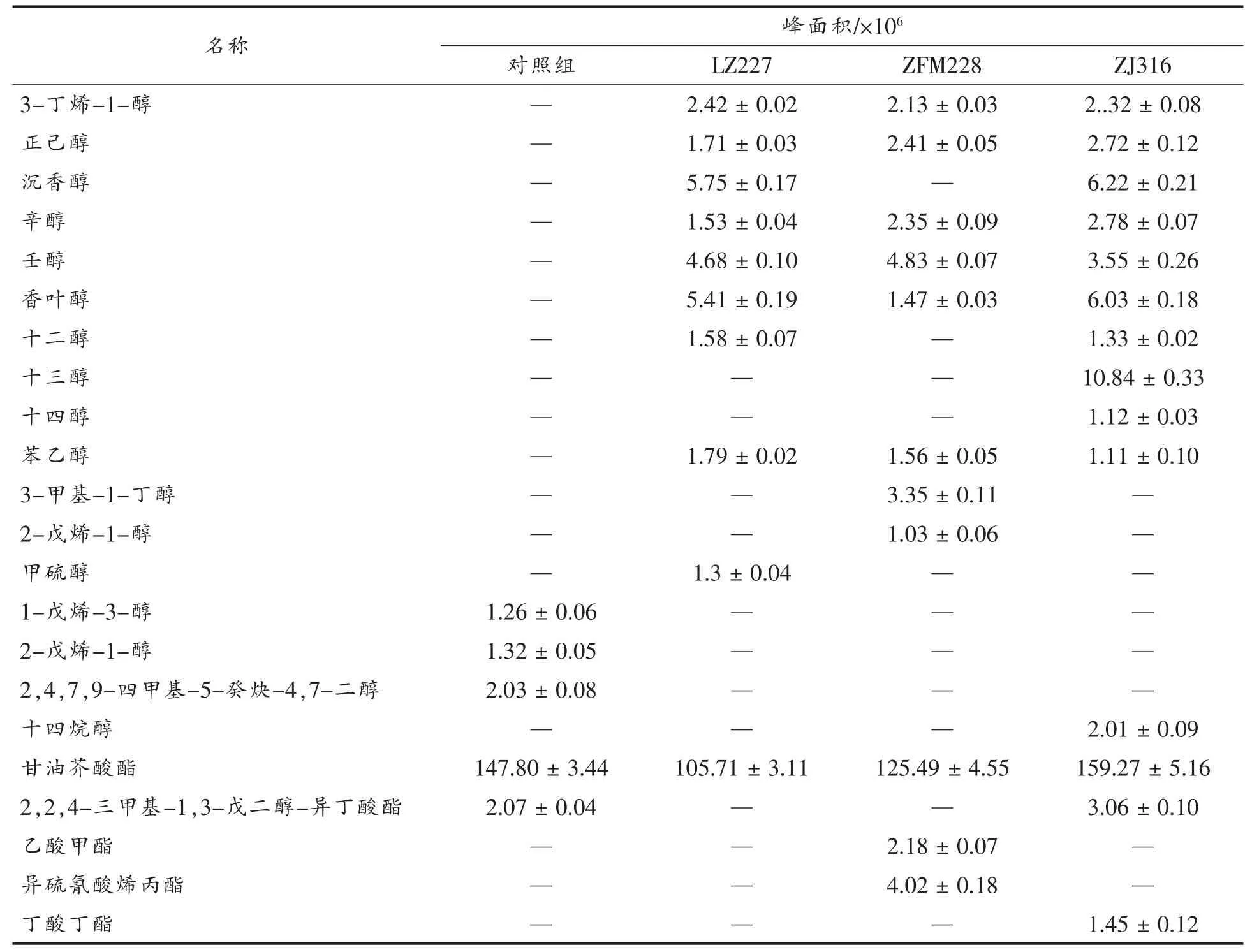
表2 乳酸菌发酵榨菜汁挥发性风味成分表Table 2 Volatile flavor components of mustard juice medium
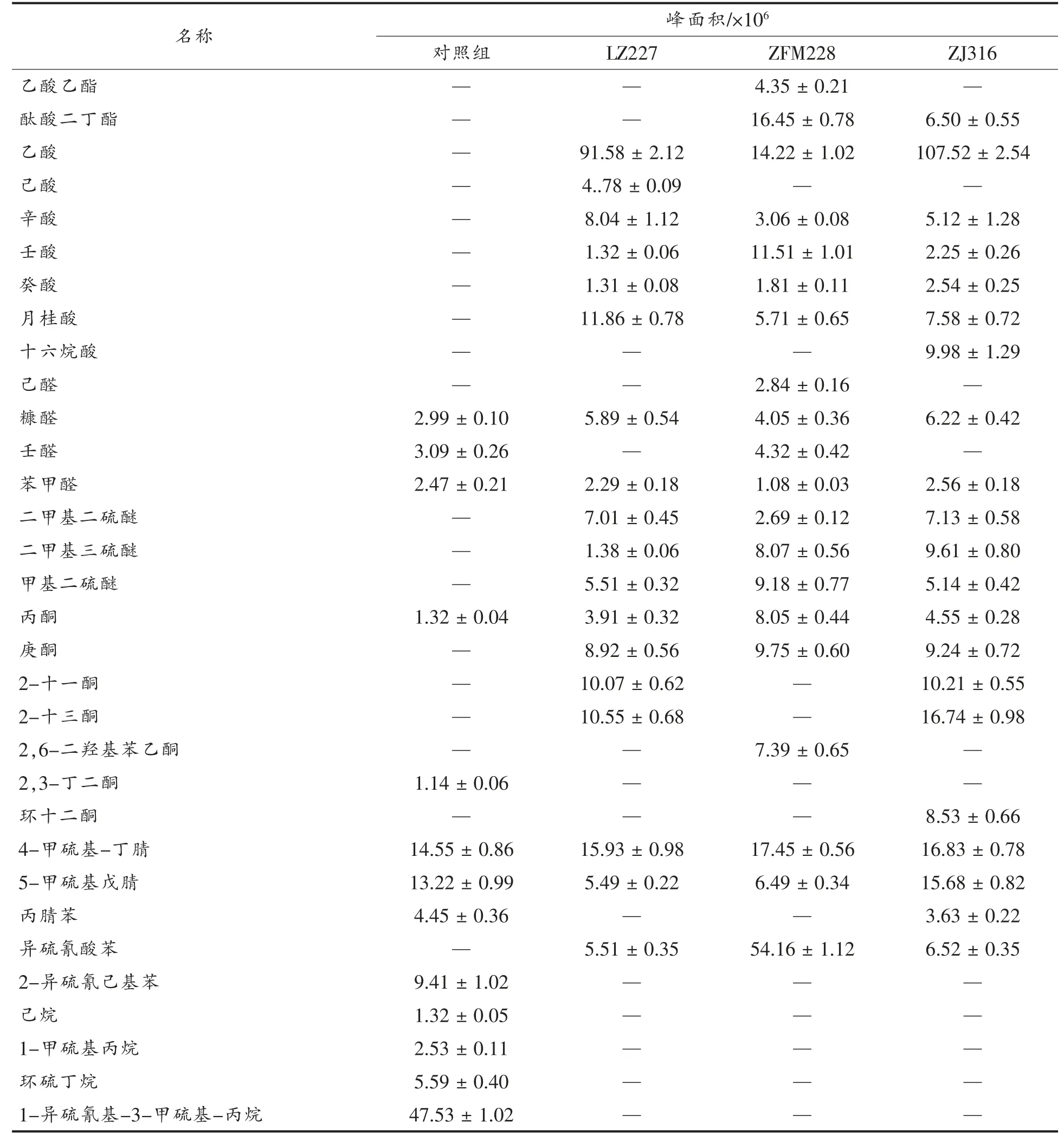
(续表2)
4 结论与讨论
传统榨菜采用高盐腌制,盐耗量高,产生资源浪费, 容易导致亚硝酸盐含量超标, 腌制时间过长,脱盐排放造成环境污染等问题。乳酸菌是榨菜腌制发酵过程中的主要微生物, 在高效降解亚硝酸盐,不破坏食品基质,赋予特殊风味等方面具有很大的优势。 本研究通过筛选得到具有高效降解亚硝酸盐的3 株植物乳杆菌ZJ316、LZ227 和ZFM228,降解率均在93%以上。 其中植物乳杆菌ZJ316 表现出较强的产酸能力和产酸速度, 可在0~3.6 mg/mL 亚硝酸盐含量环境生长。 此外,在发酵过程中, 植物乳杆菌ZJ316 发酵榨菜产生大量醇类化合物和酸类化合物, 赋予榨菜优良的发酵风味。植物乳杆菌ZJ316 作为榨菜发酵菌株,可有效降低亚硝酸盐的含量, 增加发酵榨菜的风味物质含量和酸度, 从而提高榨菜食品的安全性和营养价值。 本研究结果为发酵榨菜优良乳酸菌菌株的筛选和应用打下良好的基础。
