牛乳铁蛋白衍生肽FP-PF的安全性及其抑菌机理
2020-09-01付永岩李盈盈姜瞻梅姜成刚侯俊财王玉堂
付永岩 李盈盈 姜瞻梅 刘 飞 姜成刚 侯俊财* 田 波 王玉堂
(1 东北农业大学 乳品科学教育部重点试验室 哈尔滨150030 2 中国农业科学院哈尔滨兽医研究所 哈尔滨150001)
抗生素滥用和产生耐药性已成为全球范围内严重的生态问题,其直接导致抗生素大量残留,引起一系列健康问题[1]。 另外,“超级细菌”的出现也表明细菌的抗药性越来越强,种类更繁多、功能更强大的新型抗生素相继涌现[2]。在过去的20年里,我国对抗生素的需求量逐年升高, 被认为是全球严重滥用抗生素国家之一[3]。 抗菌肽发展迅速,先后从多种生物体(主要是昆虫、细菌和脊椎动物的有机体)中发现并分离,其无毒副作用,杀菌能力强,无药物残留并且能抑制细菌移位,极大地解决了抗生素抗菌谱窄、应用范围窄、药物残留多、生产效率低等问题[4]。 由于其在很多领域,如食品防腐剂、医药学、化妆品、动植物抗病基因工程等都有巨大的利用价值[5],因此,研究新型抗菌肽已成为基因工程热门领域之一[6]。
工艺复杂,产量低,费用高以及结构关系不好等因素, 限制了天然牛乳铁蛋白肽的广泛应用[7]。通过分子改造重新优化设计, 可以提高其抗菌活性,降低溶血性及毒性。 在酸性条件下,受到胃蛋白酶作用的牛乳铁蛋白在N 末端释放出牛乳铁蛋白肽(LfcinB),此环形多肽含有25 个氨基酸残基 (FKCRRWQWRMKKLGAPSITCVRRAF-NH2)和1 个二硫键。 本试验中选用牛乳铁蛋白肽的片段LfcinB18-28(KCRRWQWRMKK-NH2)进行对称改造,引入非极性氨基酸:苯丙氨酸(F)和脯氨酸(P)以及碱性氨基酸:精氨酸(R),得到新型抗菌肽FP-PF(FPRRWQWRRPF-NH2)。依据不同抗菌肽的结构特点,抗菌能力稍有不同。 普遍来说,昆虫源和蛙源的抗菌肽抗菌活性较强, 例如蜂毒素(melittin)。 蜂毒素含有26 个氨基酸残基,具有典型的两亲性α-螺旋结构,结构稳定。 低浓度的蜂毒素即可达到杀菌的效果[8-9],然而蜂毒素具有的较高溶血性和细胞毒性等副作用, 降低了其使用价值。 本试验以抗菌肽FP-PF 为研究对象,蜂毒素为对照肽,对短链阳离子FP-PF 的毒性、溶血性和抑菌机理进行研究, 旨在为短链阳离子FPPF 成为未来抗生素替代品,降低合成成本方面提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 抗菌肽的分子合成 抗菌肽FP-PF、 母肽LFcinB18-28 和蜂毒素均产自上海吉尔(GL)生化有限公司,用反相高效液相色谱法(RP-HPLC)将其纯化。用无菌蒸馏水配制成2.56 mmol/L 的抗菌肽溶液,置-20 ℃保存。
1.1.2 其它材料 无水乙醇, 法国Kermel 公司;噻唑蓝(MTT)、N-苯基-1-萘胺(NPN)、邻硝基苯β-D-半乳吡喃糖苷(ONPG)、多粘菌素B 和二甲基亚砜(DMSO),美国Sigma 公司;DMEM 培养基,美国Gibco 公司;HEPES 缓冲液,中国Biosharp 公司;人肾上皮293 细胞,中国农业科学院哈尔滨兽医研究所。
1.2 设备与仪器
VD-1320 型洁净工作台, 北京东联哈尔仪器制造有限公司;空气恒温培养箱,天津市泰斯特仪器有限公司; 超低温冰箱, 青岛海尔股份有限公司;96 孔细胞培养板和1 000 g 离心机,上海智城分析仪器制造有限公司;721 型可见分光光度计,上海元析仪器有限公司; 荧光分光光度计 (F-4500)、透射电子显微镜(H7650)和扫描电子显微镜(S4800),日本Hitachi 公司。
1.3 方法
1.3.1 分子特性的预测 按照网址:http://web.expasy.org/compute_pi/提供的软件预测抗菌肽FPPF 和蜂毒素的净电荷数及理论分子质量。 按照网址:http://rzlab.ucr.edu/scripts/wheel/wheel.cgi 提供的软件预测螺旋轮结构。 按照网址:http://heliquest.ipmc.cnrs.fr/提供的软件预测抗菌肽FPPF 和蜂毒素的疏水性和疏水力矩。
1.3.2 溶血活性的测定 参考Zweytick 等[10]方法。 将1 mL 人新鲜血液置于离心机中离心(1 000×g,10 min),PBS 缓冲液冲洗收集到的红细胞,用10 mL PBS 重悬细胞。 96 孔板中,前10 孔中各添加50 μL 红细胞悬液, 再分别加入PBS 稀释后的10 个浓度梯度(256~0.5 μmol/L)抗菌肽FP-PF。阳性对照: 分别加入50 μL 的0.01%聚乙二醇辛基苯基醚(Triton X-100)和红细胞悬液。 阴性对照:分别加入50 μL 的PBS 缓冲液和红细胞悬液。37 ℃培养1 h 后,10 min 离心取上清液,检测OD570nm处吸光值。 溶血率根据式(1)计算:
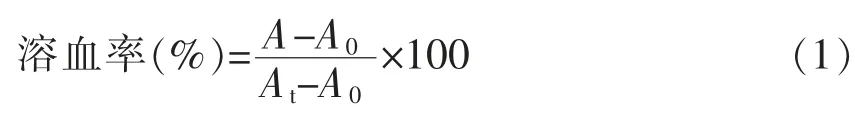
式中,A——抗菌肽样品试验组吸光值;At——阳性对照组吸光值;A0——阴性对照组吸光值。
1.3.3 细胞毒性的测定 选用MTT 法[11],复苏人肾上皮293 细胞, 置37 ℃下5% CO2的培养箱中,用DMEM 传代培养至对数生长期,制成单细胞悬液。 按1.3.2 节的方法稀释FP-PF, 加入50 μL 制备好的单细胞悬液。 阳性对照:只添加单细胞悬液。 阴性对照:既不添加单细胞悬液,也不添加抗菌肽。 在5% CO2培养箱(37 ℃,24 h)中,分别添加40 μL MTT 溶液培养4 h 后,添加150 μL DMSO 溶液,振荡10 min,检测OD492nm值。
1.3.4 抑菌机理研究
1.3.4.1 细胞外膜通透性测定 采用Ma 等[12]的研究方法检测细胞外膜的通透性, 试验菌株为大肠杆菌UB 1005。 将生长对数期的细菌置于离心机中,离心(8 000 r/min,10 min)后加入5 mmol/L HEPES 缓冲溶液。取2 μL 1 mmol/L NPN 和2 mL菌悬液混合加入石英比色皿, 再加入抗菌肽。 用F-4500 荧光分光光度计在激发光波长350 nm 和发射波长420 nm 处,测定荧光强度的变化。 阳性对照:多粘菌素B。 NPN 根据公式(2)计算:
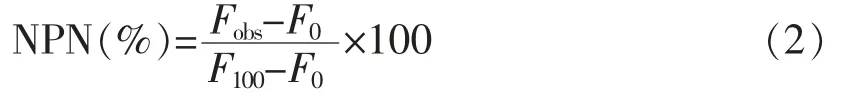
式中,Fobs——加入抗菌肽稳定时的荧光值,单位;F0——未加抗菌肽稳定时的荧光值;F100——加入多粘菌素B 的荧光值。
1.3.4.2 细胞内膜通透性的测定 采用Zhou 等[13]的研究方法,试验菌株为大肠杆菌UB 1005。在含2%乳糖的MHB 培养基中培养菌株, 当细菌生长到对数期时放入离心机中, 离心(8 000 r/min,10 min)后用pH 7.4 的PBS 缓冲液制备悬浮液,最后添加邻硝基苯β-D-半乳吡喃糖苷,使其最终的浓度到达1.5 mmo/L。 取2 mL 菌液混合4 μmol/L 和8 μmol/L(最小抑菌浓度MIC)浓度的抗菌肽放入比色皿中,在波长420 nm 处,每隔2 min 记录所有0~38 min 的结果。
1.3.4.3 细胞膜去极化的测定 选用Yang 等[14]的研究方法,试验菌株为大肠杆菌UB 1005。细菌离心10 min, 添加pH 7.4 的5 mmol/L HEPES 缓冲液 (20 mmol/L 葡萄糖和5 mmol/L EDTA)。 添加DiSC3-5 染料,使最终浓度到达0.4 μmol/L,避光震荡培养1~1.5 h; 加入终浓度为200 mmol/L 的KCl 储存液, 避光震荡培养0.5 h。 在激发光波长622 nm 和发射波长670 nm 处用F-4500 荧光分光光度计进行检测。
1.4 电镜分析
1.4.1 扫描电镜 参照Juba 等[15]的研究方法,大肠杆菌ATCC 25922 作为试验菌种。
1)菌体准备 将待测菌种传代培养至对数生长期,用PBS 制备菌悬液,调整浓度为OD600nm=0.2;
2)抗菌肽处理 用上述选菌液将抗菌肽调至终浓度为最小抑菌浓度(MIC=4 μmol/L),震荡培养2 h,对照组为未加抗菌肽的菌液;
3)样本处理 离心,弃上清,收集细菌沉淀,用PBS 冲洗3 次, 添加1 mL 2.5%的戊二醛,4 ℃冰箱过夜固定;
4)梯度脱水 用不同体积分数的乙醇溶液(50%,70%,80%,90%,95%和100%)梯度脱水,每次15 min, 再用100%叔丁醇-100%乙醇溶液(体积比1 ∶1)处理15 min 并离心,最后用纯叔丁醇处理0.5 h;
5)镀膜 将处理好的样品放入冷冻干燥机中,干燥、冷冻之后,镀上1 层金属膜;
6)观察 放在电子显微镜下观察结果。
1.4.2 透射电镜的分析测定 参照Chou 等[16]的研究方法,试验菌种:参照1.4.1 节。
1)菌体准备 参照1.4.1 节中1);
2)抗菌肽处理 参照1.4.1 节中2);
3)样本处理 参照1.4.1 节中3),PBS 冲洗,最后用1%锇酸固定70 min;
4)梯度脱水 参照1.4.1 节中4),脱水后再用100%的叔丁醇溶液-100%乙醇溶液(体积比1∶1)处理15 min;
5)浸透 离心后,置于烘箱(37 ℃)中,用包埋液-丙酮(体积比1∶1)浸泡0.5 h,再用包埋液-丙酮(体积比4∶1)过夜浸泡,置于烘箱(45 ℃)中用纯包埋液浸泡2 h;
6)包埋聚合 将混合包埋液滴入橡胶包埋板中,用醋酸双氧铀(Uranyl acetate)和柠檬酸铅(Lead citrate)染色;
7)观察 放在电子显微镜下观察结果。
2 结果与分析
2.1 抗菌肽FP-PF、LFcinB18-28 和蜂毒素的分子特性
如表1 所示,抗菌肽FP-PF 和母肽LFcinB18-28的理论分子质量与实际分子质量比相差不大,即合成肽为目标肽。FP-PF 与LFcinB18-28和蜂毒素的净电荷和疏水力矩相比都有所下降, 疏水性与LFcinB18-28相比有明显的提高,表明改善了合成肽的两亲性。 抗菌肽的螺旋轮图见图1, 方块数增加,说明增加了疏水性氨基酸数量。
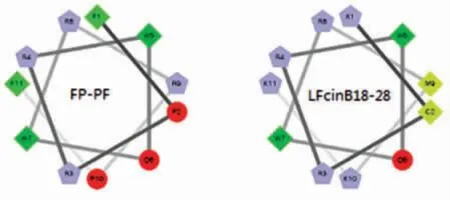
图1 抗菌肽的螺旋轮图Fig.1 Helical wheel diagrams of antimicrobial peptides
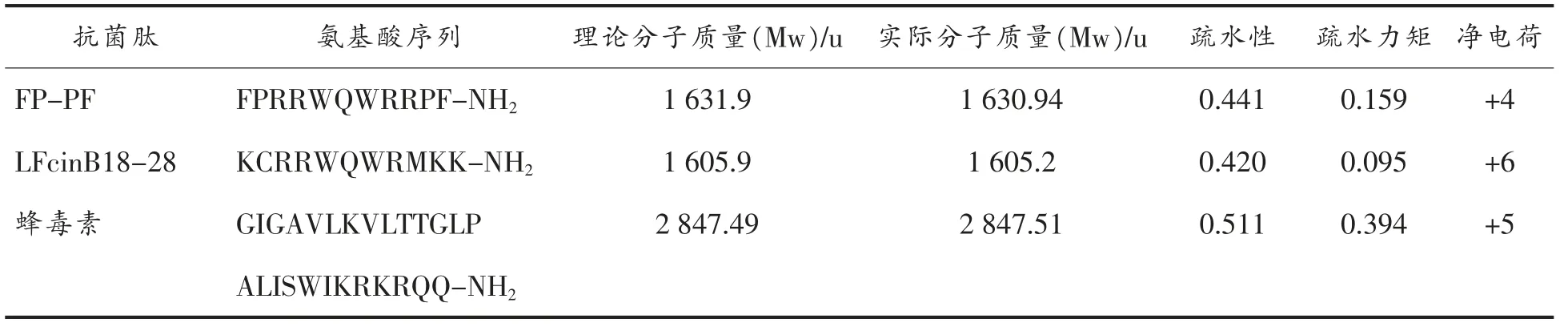
表1 FP-PF、LFcinB18-28 和蜂毒素的分子特性Table 1 The characterization of FP-PF, LFcinB18-28 and melittin
2.2 抗菌肽FP-PF 和蜂毒素的溶血活性
由图2 可知, 当肽浓度在1~256 μmol/L 之间,FP-PF 的溶血率明显小于蜂毒素,蜂毒素的溶血率在0~110%之间。 当肽浓度为1 μmol/L 时,蜂毒素的溶血率为46.80%; 当肽浓度为2 μmol/L时,溶血率上升到109.97%,并一直维持在该数值左右,没有明显下降。 相对于蜂毒素,FP-PF 的溶血率一直小于5%,表明FP-PF 的溶血性很低。
2.3 抗菌肽FP-PF 和蜂毒素的细胞毒性
由图3 可知, 当肽浓度为1~64 μmol/L 时,FP-PF 对人肾上皮293 细胞的毒性明显小于蜂毒素,说明FP-PF 对细胞生长的影响很小,其中64 μmol/L FP-PF 处理的细胞存活率仍大于92%。当肽浓度为8 μmol/L 时, 蜂毒素处理的细胞存活率为23.40%;当肽浓度达16 μmol/L 时,蜂毒素处理的细胞存活率为0,表明蜂毒素有很强的细胞毒性。
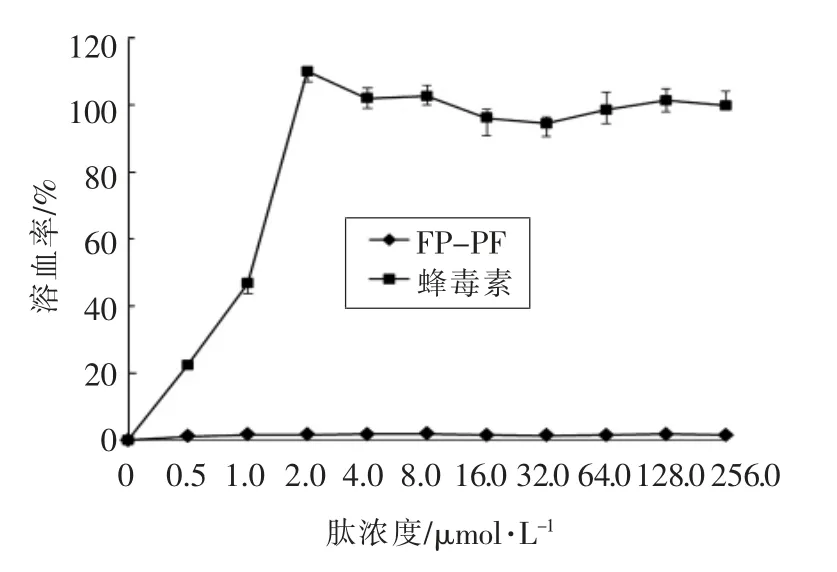
图2 FP-PF 和蜂毒素的溶血活性Fig.2 The hemolytic activities of FP-PF and melittin
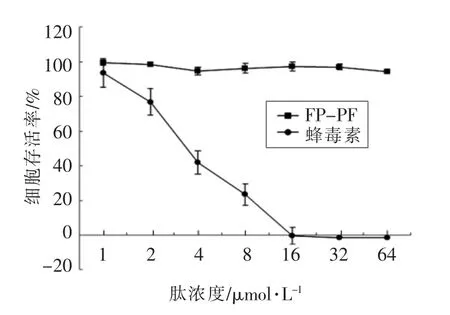
图3 FP-PF 和蜂毒素的细胞毒性Fig.3 The cytotoxicity of FP-PF and melittin
2.4 抗菌肽的抑菌机制
2.4.1 抗菌肽对外膜通透性的影响 图4 所示FP-PF 和蜂毒素对细胞外膜的破坏作用。 由图4可知,FP-PF 和蜂毒素的浓度为1~16 μmol/L,FPPF 和蜂毒素渗透大肠杆菌UB 1005 外膜的能力存在剂量的依赖性。 FP-PF 的NPN 的释放量从68.87%升到99.66%,随着肽浓度的增加,释放量也明显增加, 说明FP-PF 处理后细胞外膜通透性增大,破坏程度也增大。
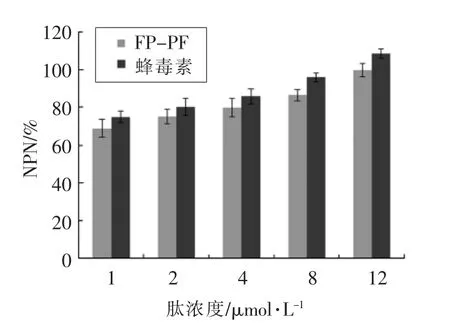
图4 FP-PF 和蜂毒素对NPN 荧光吸收强度的影响Fig.4 Effect of FP-PF and melittin for uptaking NPN
2.4.2 抗菌肽对内膜通透性的影响 通过检测加入FP-PF 和蜂毒素后细菌细胞内β-半乳糖苷酶活性,明确抗菌肽对细菌细胞内膜的渗透程度。 图5 显示在1/2 倍和1 倍MIC 浓度下抗菌肽FP-PF和蜂毒素对细胞内膜的破坏程度。 随着肽浓度升高和时间延长,FP-PF 和蜂毒素对内膜的破坏程度也加大。 无论是1/2 倍MIC 浓度还是1 倍MIC浓度的抗菌肽与细菌悬液反应后,β-半乳糖苷酶均较快速及较大幅度的释放。 同一浓度下,随着时间的增加,β-半乳糖苷酶的释放量增大,说明FPPF 和蜂毒素诱导的细胞内膜渗透性具有时间依赖性。FP-PF 在两种浓度下内膜通透性相差很大,30 min 后,1/2 倍MIC 浓度下OD420nm为0.45,1 倍MIC 浓度下为0.72,说明高浓度FP-PF 破坏内膜。
2.4.3 抗菌肽对膜的去极化作用 图6 为不同浓度下FP-PF 和蜂毒素对细菌细胞膜去极化的结果。 当细胞膜被破坏时,表面形成通道,荧光染料DiSC3-5 由通道进入介质中,使荧光强度增大。 2 μmol/L 和4 μmol/L 肽浓度时,时间对荧光强度的影响:随着浓度增加和反应时间延长,FP-PF 和蜂毒素对细胞膜表面电势的影响逐渐增大, 说明FP-PF 和蜂毒素使大肠杆菌的细胞膜去极化。 在同一浓度下,随着反应时间的延长,荧光强度也增大,说明细胞膜去极化作用有时间依赖性。在同一反应时间,随着浓度的增加,荧光强度增强,细胞去极化作用有浓度依赖性。
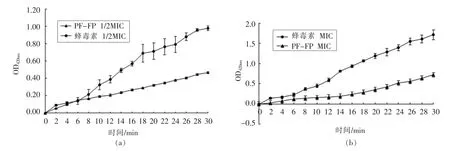
图5 不同浓度抗菌肽处理大肠杆菌UB 1005 β-半乳糖苷酶活性的释放Fig.5 Release of cytoplasmic β-galactosidase activity of E. coli UB 1005 treated with the antimicrobial peptides in different concentrations
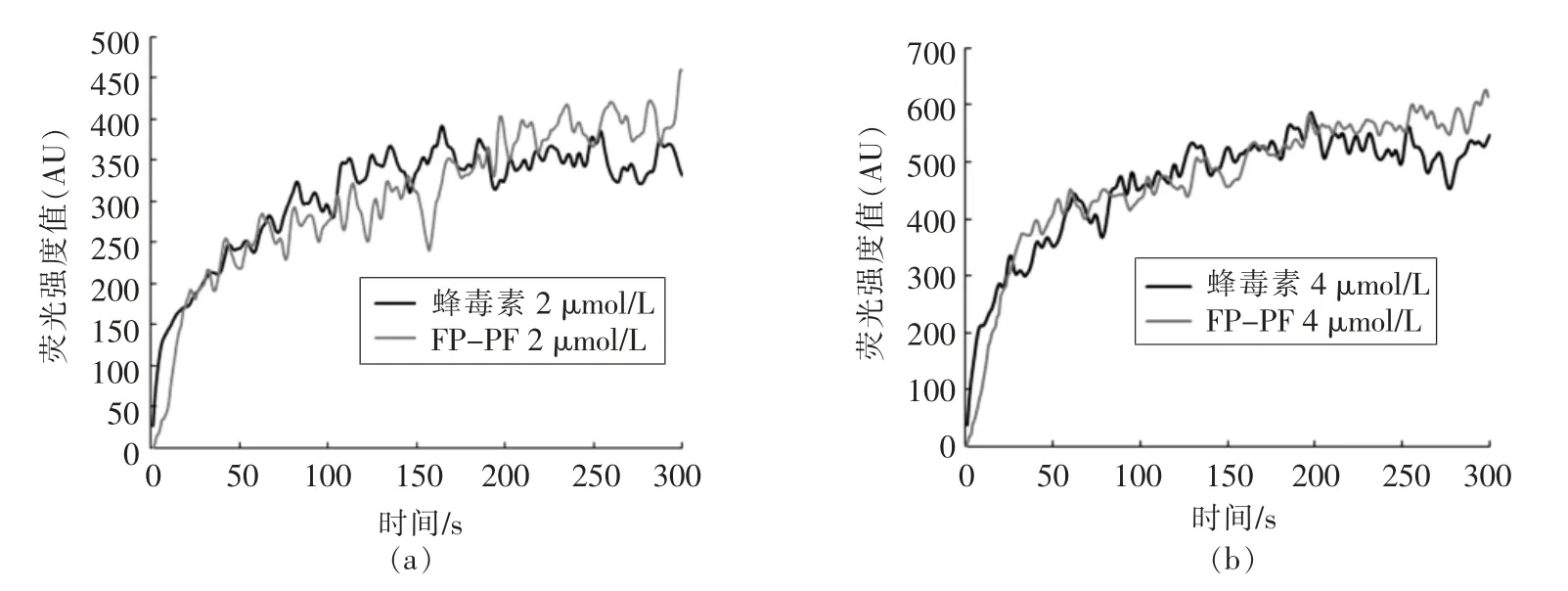
图6 不同浓度抗菌肽对大肠杆菌UB 1005 细胞膜的去极化作用Fig.6 The cytoplasmic membrane depolarization of E. coli UB 1005 by AMPs in different concentrations
2.5 电镜分析
2.5.1 扫描电子显微镜分析 扫描电子显微镜下,可清楚观察到细菌细胞膜表面的形态变化。图7 分别为1 倍MIC 浓度下FP-PF 处理后以及未加处理的大肠杆菌扫描电镜图。由图7 可知,空白对照组中的大肠杆菌依然保持原来的形状, 表面光滑,细胞饱满充盈,生长状态很好。 加入FP-PF 处理后的细菌部分被破坏,外形不完整,细胞破裂,内容物流出,细胞表面有褶皱,不光滑。
2.5.2 透射电子显微镜分析 利用透射电子显微镜观察经抗菌肽处理的细菌内部结构变化。 图8为1 倍MIC 浓度下FP-PF 处理后和未加处理的大肠杆菌的透射电镜图。由图8 可知,空白对照组的大肠杆菌形状完整,内容物充实,分布均匀,细胞壁和细胞膜都很完整, 表面光滑。 加入FP-PF处理后的细菌形状被破坏, 不能清晰地看到杆状或者椭圆状细菌,并且细菌细胞壁和细胞膜分离,有缺口,大量内容物流出,分布不均匀,细胞膜部分破裂,边缘不清晰。
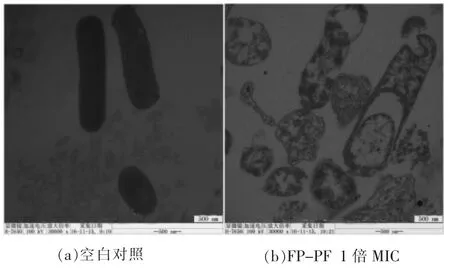
图8 FP-PF 处理大肠杆菌ATCC 25922 的透射电镜显微图Fig.8 TEM micrographs of E. coli ATCC 25922 cells treated with FP-FP
3 讨论与结论
研究表明, 决定抗菌肽生物活性的因素包括疏水性强弱、含正电荷数和疏水力矩[17-18]。 天然的牛乳铁蛋白肽结构关系不好,其安全性有待提高。精氨酸(R)、苯丙氨酸(F)和脯氨酸(P)能够有效地构成抗菌肽[19],其中带正电荷的精氨酸和脯氨酸,能够与细菌中带负电的成分相结合,使之更加贴合在细胞膜表面[20]。 Haney 等[21]研究表明在抗菌肽中引入带正电的氨基酸会增强其抑菌能力。 脯氨酸也是蛋白质结构中构成氨基酸邻近效应最频繁的氨基酸。 Lu 等[22]研究证明在抗菌肽中引入含疏水性的氨基酸(P 和F)会降低其细胞毒性。在批量生产抗菌肽时,安全性是重要的因素。 Soman 等[23]研究表明蜂毒素作为常用的对照肽,其缺点是安全性不好。 与蜂毒素相比, 新型抗菌肽FP-PF的溶血性和细胞毒性都有较大程度的改善。
抗菌肽大部分为阳性碱性肽, 会与阴离子物质相结合,使膜的渗透压变大,破坏细胞膜,使内容物外泄,最后导致细胞死亡[24]。NPN 是一种细胞外膜敏感性荧光染料, 常用于细胞外膜通透性测定试验。 通过测定NPN 的释放量,了解细胞外膜的渗透情况[25]。 FP-PF 肽可破坏细胞外膜,使渗透性增大,且随着抗菌肽浓度的增加,NPN 的释放量也增加,外膜渗透性提高,透化作用增强。 β-半乳糖苷酶存在细胞内,无色的ONPG 是β-半乳糖苷酶的反应底物,细胞膜被破坏后β-半乳糖苷酶释放到细胞外, 与细胞膜外面的底物ONPG 发生反应生成邻-硝基苯酚(黄色),可通过荧光强度了解细胞内膜的渗透性[26]。 细胞膜荧光染料DiSC3-5是疏水性的, 当细胞膜电位发生改变后,DiSC3-5染料进入膜双分子层的疏水环境中, 使荧光强度增加, 因此常作为细胞膜去极化试验中的反应试剂。 用抗菌肽FP-PF 处理细胞后,细胞膜上产生孔道, 膜电位被干扰, 原本聚集在细胞膜表面的DiSC3-5 染料被释放,发出荧光,荧光强度的大小反映细胞膜去极化程度[27]。 抗菌肽FP-PF 使细胞膜去极化, 且具有时间和浓度依赖性。 在抗菌肽FP-PF 处理细胞50 s 内去极化速度呈直线上升趋势,随后增加速度越来越缓慢。以上结果表明抗菌肽FP-PF 是通过破坏细胞外膜和内膜来抑菌。 用扫描电子显微镜和透射电子显微镜观察细胞表面和内部的结构变化, 结果表明, 抗菌肽处理的细胞,结构被破坏。细胞膜不光滑,出现褶皱,形成孔洞,细胞内容物流失。 抑菌机理试验表明,FP-PF通过改变细胞膜的渗透性和完整性抑制细菌生长。 综上所述,与蜂毒素相比,新型抗菌肽FP-PF具有毒性小,溶血率低的特点,因此在食品和医药等领域应用前景看好。
