草鱼肌原纤维蛋白与特征腥味物质的结合作用
2020-09-01徐永霞赵佳美李学鹏仪淑敏米红波励建荣
徐永霞 王 瑞 赵佳美 周 晓 李学鹏 仪淑敏 米红波 励建荣*
(1 渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心辽宁锦州121013 2 西南大学食品科学学院 重庆400715)
鱼糜制品是一种传统的水产加工品, 是我国水产加工品中发展速度最快的品种之一。 随着淡水养殖业的发展壮大,将草鱼、鲢鱼等淡水鱼加工成鱼糜及鱼糜制品有着极大的加工价值[1]。 然而,与海水鱼鱼糜相比,淡水鱼鱼糜存在腥味重、凝胶特性差的问题[2,3],影响了淡水鱼鱼糜加工产业的发展。
淡水鱼腥味物质主要包括挥发性的醛、 醇、酮、烃、含氮含硫类物质等[4],其中2-甲基异冰片、土味素、己醛、庚醛、壬醛等物质被为是导致鱼体腥味及不良气味的主要物质[5]。肌原纤维蛋白是鱼肉中最重要的蛋白质, 也是鱼糜制品中结合腥味物质的主要受体, 挥发性气味物质与蛋白质之间可以通过氢键、 离子键和疏水相互作用的可逆结合,以及共价键的不可逆结合,此外,还通过范德华力、毛细管作用产生物理吸附[6]。 不同的腥味物质与鱼肉蛋白质之间的相互作用机制也可能存在明显差异,有必要对其进行深入研究。
顶空-气相色谱/质谱联用(HS-GC-MS)是评价挥发性物质与蛋白质结合作用的常见方法。 在挥发性物质与蛋白质溶液共存的气-液平衡体系中,用气相色谱或气相色谱/质谱直接取顶空风味物质进行分析, 风味物质的释放程度将影响其在该作用体系中顶空物质的浓度, 可借此评价挥发性物质与蛋白质的结合作用[7]。Wang 等[8]用顶空法与气相色谱/质谱联合测定6 种醛酮类物质与豌豆蛋白和小麦蛋白的结合作用。 Martínezarellano等[9]利用顶空法与GC-MS 联合对干腌火腿中肽与己醛、1-辛烯-3 醇等的相互作用进行了测定。 此外,小分子与生物大分子结合前、后结构变化的信息可以通过紫外、荧光、拉曼光谱等多种光谱学方法测定[10-11]。 其中Lubke 等[12]利用荧光光谱确定醛类物质在肌原纤维蛋白上的结合部位。 目前鲜见采用顶空法结合多种光谱技术研究鱼类蛋白质与特征腥味物质间相互作用的报道。
鉴于此,本试验以草鱼为研究对象,选择4 种典型鱼肉特征腥味物质(己醛、庚醛、辛醛、壬醛),建立鱼肌原纤维蛋白-腥味物质作用模型体系,通过顶空-气相色谱-质谱联用法结合紫外、荧光、拉曼光谱等技术分析草鱼特征腥味组分与肌原纤维蛋白的结合作用特征, 旨在对淡水鱼及鱼糜制品加工中的风味调控提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜活草鱼,购于辽宁省锦州市水产市场,平均体长(30±5)cm,体重(500±50)g。
己醛、庚醛、辛醛和壬醛,均为色谱纯级,购于美国Sigma 公司;磷酸氢二钠、磷酸二氢钠、Tris 和氯化钠等试剂均为分析纯级, 购于国药集团化学试剂有限公司。
1.2 仪器与设备
气相色谱-质谱联用仪(7890N-5975C),美国Agilent 公司;差示扫描热量仪(Q2000),美国TA仪器;拉曼光谱仪(LabRAM HR Evolution),堀场(中国)贸易有限公司; 荧光分光光度计(970CRT),上海精密科学仪器有限公司;氨基酸自动分析仪(L-8900),日本日立公司。
1.3 试验方法
1.3.1 肌原纤维蛋白的制备 肌原纤维蛋白提取方法参照孙为正等[13]的方法并稍作修改。 对新鲜草鱼电击,晕后宰杀、去皮,取背部肌肉绞碎,第1次加入5 倍体积的10 mmol/L Tris-HCl(pH 7.2),高速均质3 次,每次30 s,在4 500 r/min、4 ℃条件下离心10 min,取沉淀。 上述步骤重复两次,第3次加入5 倍体积的10 mmol/L Tris-HCl 缓冲液(含0.1 mol/L NaCl,pH 7.2),高速均质3 次,每次30 s,在4 800 r/min、4 ℃条件下离心10 min,取沉淀,在最后1 次沉淀中加入5 倍体积的10 mmol/L Tris-HCl 缓冲液(含0.6 mol/L NaCl,pH 7.2),高速均质,在4 800 r/min、4 ℃条件下离心15 min,取上清液备用。 肌原纤维蛋白质量浓度采用双缩脲法测定,用牛血清蛋白作为标准品。
1.3.2 风味物质储备液的制备 根据前期预试验,将内标己醛、庚醛、辛醛、壬醛溶于上述10 mmol/L Tris-HCl 缓冲液 (含0.6 mol/L NaCl,pH 7.2)中,超声2 min,配得2 000 mg/L 标准品储备液,密封后置于-4 ℃冰箱,备用。
1.3.3 氨基酸含量的测定 蛋白样品经盐酸水解,离心取上清,过0.22 μm 滤膜,然后采用氨基酸自动分析仪进行氨基酸的测定。
1.3.4 GC-MS 分析 GC 条件:HP-5MS 毛细管柱(30 m×0.25 mm×0.25 μm);解析时间5 min;进样口温度250 ℃;柱初温40 ℃,保持3 min,载气为99.999%高纯氦气,流速1.0 mL/min;不分流模式进样; 以3 ℃/min 程序升温到100 ℃, 保持5 min;流量1.0 mL/min;不分流模式进样。
MS 条件:色谱-质谱传输线温度280 ℃,离子源温度230 ℃,四极杆温度150 ℃;离子化方式:EI;电子能量70 eV;质量扫描范围30~550(m/z)。
1.3.5 肌原纤维蛋白对各风味物质吸附能力的测定 参照Wang 等[8]的方法并稍作修改。 将提取到的草鱼肌原纤维蛋白与不同风味物质储备液分别溶解于上述缓冲液中, 使待测溶液中蛋白质量浓度为5.0 mg/mL, 挥发物质量浓度为1.0 mg/L。 取10 mL 上述溶液 (空白组以含相同浓度挥发物的PBS 溶液代替)快速加到15 mL 顶空瓶中,添加风味化合物储备液调整至设定质量浓度, 然后用PTFE 硅胶隔垫瓶盖密封,用振荡器振荡1 min,30℃避光条件下恒温振荡1 h,平衡后的溶液采用直接进样法测定各挥发性化合物的顶空浓度。 用气相进样针吸取1 mL 不同挥发物, 采用1.3.4 节的色谱条件直接进样分析。 依据Kuhn 等[14]的理论,研究草鱼肌原纤维蛋白对风味物质的吸附作用,通过相对吸附百分比(%)来表示:

1.3.6 化学作用力的测定 参照Wang 等[15]方法检测蛋白质与挥发性物质间的化学作用力。
1.3.7 热稳定性的测定 取5~10 mg 冻干的蛋白样品于铝盒中(空白组以含同浓度、无挥发物的蛋白溶液代替),采用差示扫描量热仪测定。 参数设定为:初始温度20 ℃,升温速率5 ℃/min,结束温度100 ℃,对照组为空盘子,整个过程需氮气(0.8~1 Pa)保护。
1.3.8 内源荧光的测定 用上述缓冲液将处理后蛋白液质量浓度调到0.25 mg/mL (空白组以含同浓度无挥发物的蛋白溶液代替),采用F96 型荧光分光光度计测定光谱。 测定条件: 激发波长295 nm,狭缝均为10 nm,扫描范围300~450 nm,灵敏度2。
1.3.9 紫外-可见光光谱的测定 分别在有和无风味物质时测量肌原纤维蛋白的紫外-可见光谱,测量范围190~400 nm。 肌原纤维蛋白的质量浓度固定在0.1 mg/mL,而挥发物质量浓度为1.0 mg/L。加入挥发物后,于30 ℃避光条件下恒温振荡1 h,测定平衡后溶液的吸光度值。
1.3.10 拉曼光谱的测定 取10 mL 处理过的蛋白液(空白组以含同浓度无挥发物的蛋白溶液代替)冷冻干燥, 用于拉曼光谱的测定。 激光波长785 nm,功率120 mW,曝光时间60 s,每次扫描3次,检测范围 500~3 200 cm-1,以苯丙氨酸(1 002 cm-1)为标准进行归一化[16]。
1.3.11 数据分析 用软件SPSS 20.0 进行显著性分析,数据肩标有相同的字母为差异不显著(P>0.05),有不同字母者为差异显著(P<0.05)。用软件Excel 2010 和Origin 8.5 制表和绘图。 GC-MS 数据处理利用计算机谱库(Nist11/Wiley7.0)标准质谱库匹配求得。
2 结果与讨论
2.1 草鱼肌原纤维蛋白氨基酸组成
蛋白质是由氨基酸组成的,氨基酸的类型、含量和顺序等决定了蛋白质的结构和功能。 草鱼肌原纤维蛋白中氨基酸组成及含量如表1 所示,其中丝氨酸(27.539%)、谷氨酸(12.32%)、精氨酸(9.156%)、赖氨酸(8.441%)和天冬氨酸(8.3%)含量较为丰富,而甲硫氨酸(1.413%)、脯氨酸(1.152%)和丙氨酸(0.158%)等疏水性氨基酸含量较低。 在决定蛋白质功能、结构和稳定性时,不同类型的氨基酸起不同的作用, 这些疏水性氨基酸对蛋白质空间结构的展开起重要的作用。 本研究通过添加4 种饱和醛类物质与肌原纤维蛋白相互作用, 评估小分子风味物质对蛋白质构象的潜在影响。 Wang 等[17]研究了几种醛、酮类风味物质与豌豆蛋白结合后对蛋白结构以及凝胶特性的影响。
2.2 结合能力分析
风味物质与蛋白质的结合能力受多种因素的影响,其中风味成分的种类、疏水性、分配系数是影响其相互作用的主要因素。研究表明,酯类与牛血清蛋白的结合主要受到碳原子数及沸点的影响,醛类的结合受到氢原子数与沸点的影响,酮类的结合受到碳原子数、 链长及分支程度的影响[6]。Martínezarellano 等[9]对干腌火腿中肽与挥发性物质的结合作用进行了研究, 发现挥发性物质的化学性质是影响其结合作用的重要因素。 草鱼肌原纤维蛋与4 种醛类物质的结合能力如图1 所示,己醛、庚醛、辛醛和壬醛与肌原纤维蛋白的结合能力分别为21.15%,23.69%,24.98%和26.93%,它们的结合能力大小随碳链的增长而增加, 这可能是长链饱和醛拥有更多的结合位点, 能更有效地与蛋白质结构伸展暴露出来的结合位点相结合。Wang 等[15]研究油菜籽蛋白和豌豆蛋白对辛醛和庚醛的吸附能力强于己醛。刘璘等[7]认为辛醛和壬醛与白鲢鱼肌球蛋白的结合能力比庚醛强。 以上与本研究结果相似。
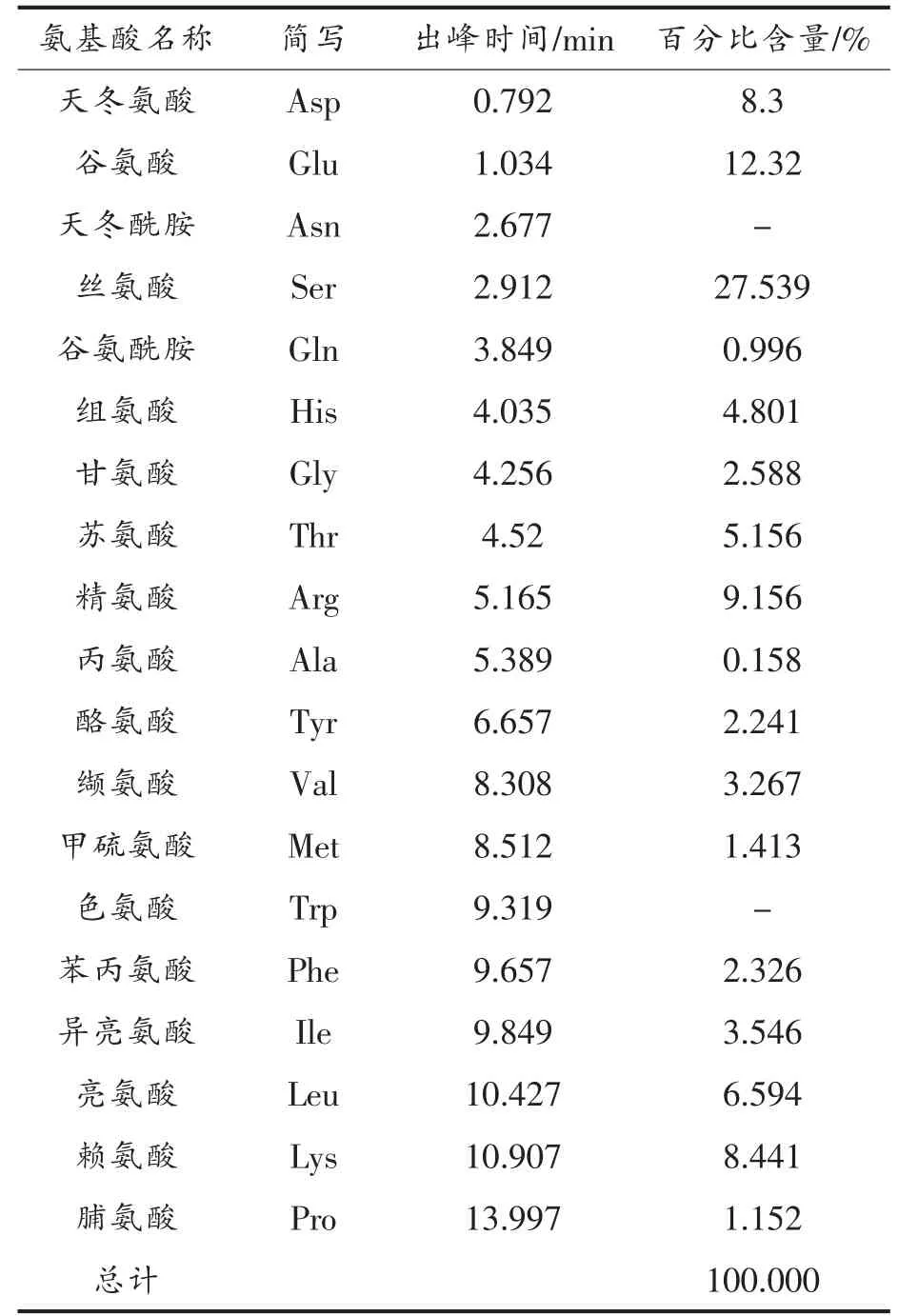
表1 草鱼肌原纤维蛋白中氨基酸含量Table 1 Amino acid composition of grass carp’s myofibrillar protein

图1 草鱼腥味物质与肌原纤维蛋白的结合能力Fig.1 Binding capacity of fishy odor compounds to grass carp’s myofibrillar protein
2.3 化学作用力分析
挥发性物质与蛋白质结合通过不可逆的共价键及可逆的物理化学键,例如范德华力、氢键、疏水相互作用和离子键等。 通过添加不同溶剂来破坏凝胶中化学键,通过GC-MS 测定挥发性物质保留程度来评定挥发性物质与蛋白质之间的结合作用力。 表2 列出各种试剂对风味物质和蛋白质分子间相互作用的影响。
通过添加Na2SO4、Cl3CCOONa 以及尿素、盐酸胍(GuHCl)和丙二醇(PG)确定4 种饱和醛类与蛋白质结合的各种非共价键的作用类型。 从图2a 可以看出, 添加5 mol/L 尿素组与对照组相比,壬醛、辛醛、庚醛、己醛的保留分别降低了10.10%,12.39%,16.04%,16.55%,这表明疏水相互作用或氢键参与醛类与肌原纤维蛋白的结合。 当添加1 mol/L GuHCl 时,4 种醛类物质的保留降低不显著(P>0.05), 这表明氢键和离子键可能在醛类物质与肌原纤维蛋白的结合中起一定作用。 与对照组相比, 丙二醇存在时醛类风味与蛋白质结合显著降低(P<0.05),如添加20%丙二醇使壬醛、辛醛、庚醛、 己醛的保留分别降低了14.78%,19.89%,20.75%,31.16%,这表明疏水相互作用对醛类与蛋白质结合的重要性。

表2 各种试剂对蛋白质和腥味物质分子间相互作用的影响Table 2 Effects of various reagents on molecular interactions between proteins and fishy odor compounds
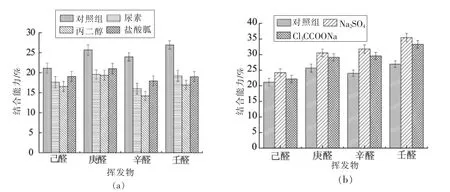
图2 尿素、丙二醇、盐酸胍(a)和Na2SO4 和Cl3CCOONa(b)对4 种饱和醛类与肌原纤维蛋白结合作用的影响Fig.2 Effects of urea, guanidine hydrochloride and propylene glycol (a)and Na2SO4, Cl3CCOONa (b)on binding of hexanal, heptanal, octanal and nonanal to myofibrillar protein
在食品领域Na2SO4作为稳定蛋白质结构的盐被广泛应用。 Na2SO4通过增强分子内和分子间疏水相互作用促进蛋白质的热稳定性, 可以创造更有利于风味保留的结合位点, 从而增加风味物质与蛋白质结合作用。 从图2b 可以看出,与未添加盐的对照样品相比,0.5 mol/L Na2SO4能显著增强4 种饱和醛对肌原纤维蛋白的结合, 壬醛、辛醛、庚醛、己醛的保留分别增加了12.64%,15.99%,22.12%,24.03%,这表明分子间疏水相互作用对醛类与蛋白质结合起重要作用。 Cl3CCOONa 通过特定的离子-大分子相互作用使蛋白质变性,导致活性基团暴露, 降低蛋白质的热稳定性。 加入Cl3CCOONa 后使蛋白质部分变性, 暴露新的结合位点,从而使4 种饱和醛类的保留能力增强。本结果显示, 醛类物质主要通过非共价键的疏水相互作用与蛋白质结合,少部分通过氢键或离子键,这与Wang 等[15]研究几种选定的挥发性物质与盐溶性豌豆蛋白间的化学作用力结果相似。
2.4 热稳定性分析
对蛋白质体系而言, 当温度升高到某一特定值时,蛋白质受热变性,结构变化,从而引起焓的变化[18]。肌原纤维蛋白与腥味物质结合,经DSC 分析得到的转变温度及ΔH 的变化,见表3。 相对于对照组而言, 添加4 种饱和醛类对肌原纤维蛋白热变性温度有显著性影响(P<0.05),焓变值显著降低(P<0.05),如己醛0.51J/K、庚醛0.48J/K、辛醛0.39J/K、壬醛0.24J/K,表明添加腥味物质能诱导蛋白质部分变性, 从而降低了蛋白质变性所需的焓变值。添加壬醛、辛醛、庚醛和己醛,蛋白质热稳定性分别降低了70.73%,52.44%,41.46%和37.80%,说明饱和醛碳链越长越易与蛋白质暴露出的结合位点结合, 进而降低蛋白质变性所需的焓变值。 Wang 等[15]也有相似的研究结果。
2.5 内源荧光分析
荧光光谱法是研究生物大分子与小分子、离子相互作用的应用广泛的方法之一[11]。 蛋白质的荧光主要是源于Trp、Tyr 和Phe 残基,而其内源荧光主要是源于Trp 残基[19]。通过内源荧光光谱可以了解蛋白分子多肽链空间结构变化。 图3 显示加入4 种饱和醛类物质后肌原纤维蛋白内源荧光的变化。 随着己醛、庚醛、辛醛和壬醛4 种醛类物质的添加, 肌原纤维蛋白的荧光强度分别降低了6.13%,7.54%,7.90%和10.94%, 可能是腥味物质与肌原纤维蛋白相互作用,改变蛋白质肽链结构,暴露出的色氨酸残基与腥味物质反应, 降低了肌原纤维蛋白荧光强度。添加的醛类物质碳链越长,荧光强度降低越多, 暴露在亲水环境中的色氨酸残基更易与长链醛类物质发生反应。
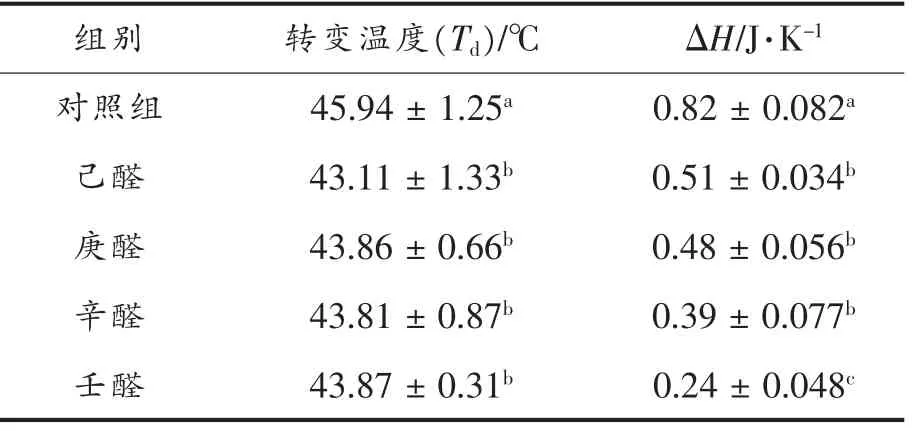
表3 草鱼肌原纤维蛋白与腥味物质结合后热稳定性的变化Table 3 Changes of the thermal properties of myofibrillar protein binding with fishy odor compounds in grass carp
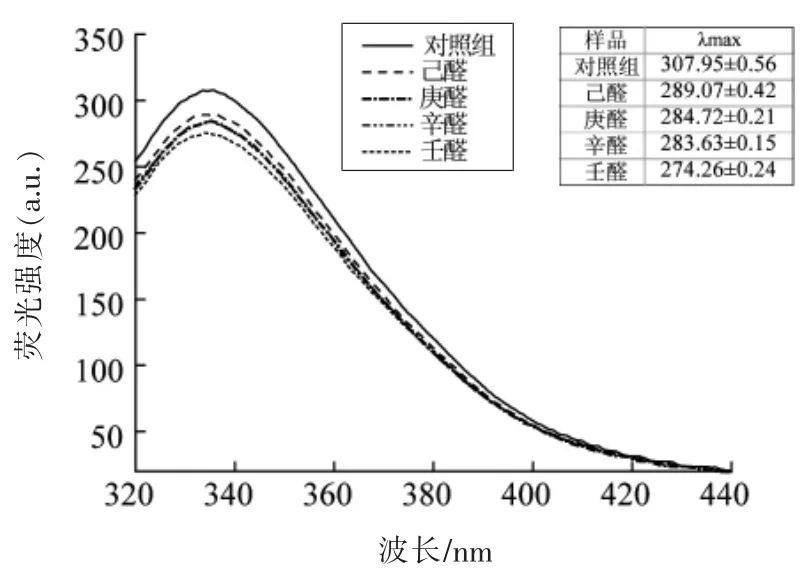
图3 草鱼肌原纤维蛋白与腥味物质结合后内源荧光的变化Fig.3 Changes of endogenous fluorescence of myofibrillar protein binding with fishy odor compounds in grass carp
2.6 紫外光谱分析
紫外吸收光谱可用于研究蛋白质的结构变化,是一种探究复合物形成的简单而有效的方法[20]。为了初步确定腥味物质对草鱼肌原纤维蛋白的结合作用机制,测定了肌原纤维蛋白、腥味物质以及二者相互作用体系的紫外吸收光谱, 结果如图4所示。 肌原纤维蛋白在210 nm 和280 nm 处有两个吸收峰,其中210 nm 处的强烈吸收峰反映肌原纤维蛋白肽链骨架信息,而280 nm 处的吸收峰是由芳香族氨基酸(色氨酸、酪氨酸和苯丙氨酸)产生的。挥发物在波长200~400 nm 范围没有明显的吸收峰。 添加己醛、庚醛、辛醛和壬醛后肌原纤维蛋白在210 nm 处吸收峰强度分别降低了21.17%,22.20%,25.42%和29.49%, 并伴随约1 nm 的红移, 这表明腥味物质改变了肌原纤维蛋白肽键周围的微环境, 同时改变了肌原纤维蛋白的二级结构,即腥味物质与肌原纤维蛋白间存在相互作用。肌原纤维蛋白在280 nm 处的紫外吸收光谱未发生移动, 表明肌原纤维蛋白与腥味物质结合后没有明显改变蛋白中芳香族氨基酸残基微环境的极性[21]。

图4 草鱼肌原纤维蛋白与腥味物质结合后的紫外-可见吸收光谱图Fig.4 UV-vis spectra of myofibrillar protein binding with fishy odor compounds in grass carp
2.7 拉曼光谱分析
拉曼光谱检测是一种无损检测技术, 受水分的影响较小, 可作为判断物质分子结构的强有力的手段[22]。 用拉曼光谱分析蛋白质,可以反映其肽链的骨架振动, 侧链周围微观环境的变化及化学信息[23]。草鱼肌原纤维蛋白与腥味物质结合后归一化的拉曼光谱见图5,经Alix 公式计算得出二级结构单元含量见表4。 添加4 种醛类物质后,α-螺旋结构降低,β-折叠和β-转角结构含量上升,这可能是由于肌球蛋白结构被破坏,蛋白质结构展开,α-螺旋结构转变成β-折叠和β-转角结构。 其中添加己醛、庚醛、辛醛和壬醛后α-螺旋含量较对照组分别降低了15.66%,20.43%,20.97%和24.81%,表明蛋白质伸展暴露出更多的结合位点, 更易与长链醛类物质结合。 蛋白质二级和三级结构的稳定性大部分依靠非共价键力,如氢键、范德华力、静电相互作用和疏水相互作用,α-螺旋结构是稳定蛋白质最主要的结构[24],其中多肽链上羰基(-CO)和氨基(NH-)端之间的氢键是稳定α-螺旋的主要化学键, 添加醛类物质破坏了稳定蛋白质结构的化学键,引起蛋白质变性。
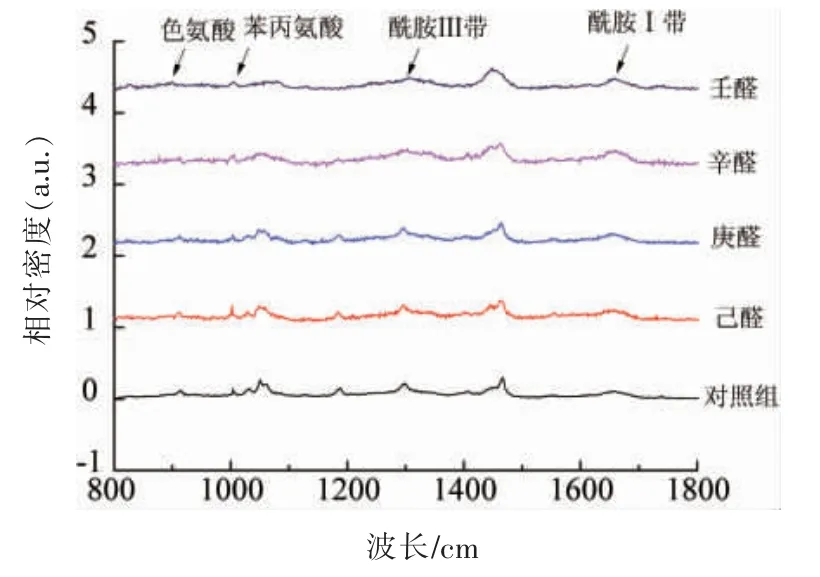
图5 草鱼肌原纤维蛋白与腥味物质结合作用的拉曼光谱图Fig.5 The Raman spectrum of myofibrillar protein binding with fishy odor compounds in grass carp
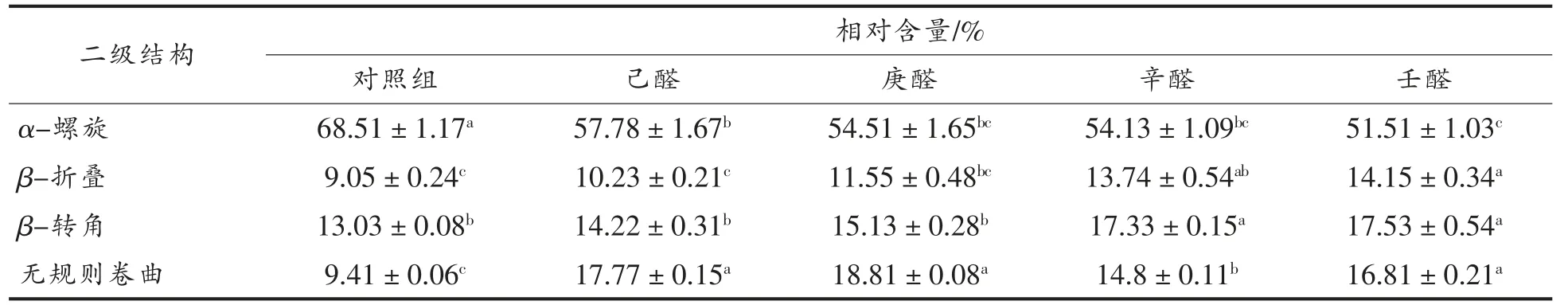
表4 草鱼肌原纤维蛋白与腥味物质结合后二级结构的变化Table 4 The relative content of secondary structures of myofibrillar protein binding with fishy odor compounds in grass carp
3 结论
采用HS-GC-MS 结合紫外、荧光、拉曼等技术对草鱼肌原纤维蛋白与4 种特征腥味物质(己醛、庚醛、辛醛和壬醛)的相互作用进行研究,结果表明, 肌原纤维蛋白对直链醛的结合能力随碳链的增长而增加。 肌原纤维蛋白与醛类物质间相互作用主要为疏水作用,其次是氢键或离子键作用。醛类腥味物质的存在改变了蛋白质的肽链构象,暴露出的荧光基团与腥味物质反应降低了肌原纤维蛋白的荧光强度及蛋白质的热稳定性。
