微藻裂殖壶菌藻粕酶解肽抑制水产鱼类肠道炎症的功效研究
2020-09-01李孟研柴力彬张延杰邝丽红
李孟研 柴力彬 张延杰 邝丽红 李 昊,2*
(1 福州大学生物科学与工程学院 应用生物技术研究所 福州350108 2 福建蓝昊生物科技有限公司 福州350109)
鱼类水产养殖业为人类提供了大量优质动物蛋白食品,其产业增长速度迅猛。 随着集约化、工厂化养殖的大幅度增加,各类养殖病害急剧上升,如果不对疾病进行及时的预防和控制, 就会导致养殖水产动物大规模死亡。 鱼类肠道不仅是消化及营养吸收的主要器官[1],也是体内病原微生物及毒素聚集的主要场所, 因此鱼类肠道炎症是目前最为普遍的养殖疾病。 目前临床上还没有开发出针对鱼类肠炎性疾病的靶向性药物, 大多是使用人类药物或兽药对鱼类肠炎进行治疗, 然而长期频繁使用抗生素等化学物质, 不仅会使鱼体产生耐药性, 降低其抗病能力, 而且还会导致药物残留。 此类物质在鱼类体内残留,被人体摄入后,对人体健康也会造成严重危害。 迫切需要应用现代生物技术, 开发既能防治疾病又无毒副作用的水产药物替代品。
生物活性肽是氨基酸以酰胺键互相连接在一起形成的具有多种生物活性的化合物[2]。其对生物机体具有一定的生理作用,例如抗炎[3]、抗微生物[4]以及抗氧化[5]等作用,在食品科学、饲料添加以及生物医药等方面具有重要的应用价值。 生物活性肽不仅有强大的生理功能, 而且易于消化吸收[6],对生物体没有任何毒副作用和依赖性, 是具有长远发展的功能因子。 目前应用生物活性肽治疗鱼类肠道炎症疾病鲜有研究。 本课题组通过研究生物活性肽抑制鱼类肠道炎症的功效及机理, 为开发新型抗炎症水产药替代品提供了重要的理论依据,为新型水产品养殖提供关键技术。
鱼类肠炎在鱼类疾病中最为常见, 是养殖用户最棘手的问题。 鱼类肠炎具体的发病原因主要包括水质中存在微生物以及营养过剩时会引发病原菌的大量繁殖,导致鱼类肠炎和其它病症;体内寄生虫引起的肠炎;饲料引起的肠炎[7]。 细菌感染引起的肠道炎症以及药物引起的肠炎, 如大量使用抗生素可使鱼肠道内正常菌群减少, 导致耐抗生素菌群改变肠道内的微环境, 最终引起肠道炎症。
针对鱼类肠道炎症使用的药物为抗菌类药物,包括抗生素类[8]、磺胺类和喹诺酮类。其杀菌方式主要有3 种,分别是阻止蛋白质的合成,破坏细胞壁的形成以及影响DNA 的复制。长期使用抗生素会打破机体内微生态平衡[9],导致条件致病菌占上风,从而引发机体内源感染。 同时,某些抗生素进入机体后无法代谢而导致鱼体内药物残留[10],从而间接危害人类健康。 由于抗生素会给人类及牲畜带来很多副作用,因此,许多抗菌类药物被禁用,例如抗生素类中的红霉素、氯霉素、呋喃唑酮和呋喃西林等药物,磺胺类药物中的磺胺噻唑和磺胺咪等被禁止用于鱼类疾病防治和饲料添加剂。
目前,上述渔药类都没有针对性的治疗作用,大多是使用人类药物或兽药治疗鱼类肠炎, 而长期使用抗生素等化学物质, 不仅导致鱼类自身肠黏膜免疫系统遭到破坏,降低其抗病能力,而且频繁使用这些药物还会有药物残留现象。 本文研究生物活性肽抑制鱼类肠道炎症的功效及机理,研发水产药物替代品。
1 材料与方法
1.1 材料与试剂
1.1.1 藻粕 海洋微藻裂殖壶菌藻粕及饲料中的维生素AD 复合物由厦门金达威集团股份有限公司提供。
1.1.2 实验动物 草鱼100 尾,体重(35±5)g;鳗鱼100 尾,体重(50±5)g,分别分为正常组、阴性组、 阳性对照恩诺沙星组以及裂殖壶菌酶解产物和复合饲料中维生素AD 组,简称MESH 组,共4组,每组10 尾,由福州大学生物科学与工程学院提供。
1.1.3 试剂及配制 5%三硝基苯磺酸(TNBS),美国Sigma 公司;无水乙醇、甲醛及磷酸盐缓冲液,国药集团化学试剂有限公司;PBS 所用试剂为分析纯级。
2.5%三硝基苯磺酸溶液配制:5%TNBS 水溶液和无水乙醇 (按体积比1 ∶1)配制成2.5%的TNBS 乙醇溶液[11-12],现配现用。
动物组织固定液的配制:将100 mL 甲醛加入800 mL 磷酸盐缓冲溶液中,定容1 000 mL,混合均匀,常温保存。 PBS 所用试剂为分析纯级。
1.2 试验方法
1.2.1 实验鱼的饲养 将草鱼和鳗鱼分别放在鱼缸里饲养,试验用水为充分曝气的自来水,水温控制在(25±2)℃,并使用增氧泵24 h 不间断充氧。适应期间饲喂不含任何药物的全价饲料(饲料中含有维生素AD),每天9:00 投喂,饲喂量为鱼体重的1%。 每两天更换1 次水, 每次换水量约为30%并及时清除水底残饵和排泄物。
1.2.2 TNBS 肠道炎症模型的建立 将5%TNBS水溶液和无水乙醇配制成2.5%的TNBS 乙醇溶液。 参考赵杰等[13]的方法,确定TNBS 的灌注量为鱼体质量80~90 mg/kg,即规格为35 g 左右的实验鱼。2.5%TNBS 乙醇溶液灌注量约0.13 mL,不会造成实验鱼死亡并有明显的肠道炎症。 实验鱼被灌注2.5%TNBS 乙醇溶液或PBS 前,禁食24 h,以清除肠道内排泄物。 将实验鱼放入质量浓度为60 mg/L 的MS-222 溶液中浸泡麻醉5 min[14],用灌胃针轻轻推入鱼肛门上端3 cm 处, 缓慢灌入2.5%TNBS 乙醇溶液。 灌注等体积PBS 作为正常组,灌注后将灌胃针保持在原位30 s 后缓慢抽出, 将鱼倒置30 s,确保灌注试剂不会流出。
1.2.3 肠道炎症的防治方法 取配制好的酶解液MESH 溶液、恩诺沙星溶液和PBS 溶液,在实验鱼适应7 d 后,对其肠道炎症做预防处理。每天9:00分别投喂含有不同药物的饲料, 饲喂量为实验鱼体重的1%,连续投喂7 d。正常组、阴性组按PBS 0.01 mol/L,恩诺沙星组按10 mg/kg,MESH 组按2.5 mg/kg 的药饵剂量给药。 用喷雾器均匀地喷洒在饲料上,使每一颗都沾上MESH、恩诺沙星和PBS溶液,将配制好的药饵放入25 ℃烘箱烘干。 提前1 d 配制好,放入4 ℃冰箱保存。
1.2.4 疾病活动指数评分(DAI)为了更好地监测实验鱼患肠炎的过程,通过表1 的评分系统[15-16],对实验鱼肠道炎症进行整体性评价。 从建立实验鱼肠道炎症模型的第1 天开始, 每天对鱼游动能力、摄食量、肛门炎症、体表充血和腹水等体表形态实时监测评分。 该评分可以直观反映实验鱼肠道炎症水平。疾病活动指数评分越高,其肠道炎症越严重;反之,其健康状况良好。
1.2.5 试验样品的获取及处理方法 使用60 mg/L 的MS-222 溶液将实验鱼浸泡麻醉,然后从肛门处插入手术剪, 沿腹中线向前经腹鳍中间剪至下颌。 将鱼侧卧,左侧向上,自肛门处向背上方剪到脊柱,沿脊柱下方剪至鳃盖后缘,再沿鳃盖后缘剪至下颌,除去左侧体壁肌肉,使内脏暴露在外,用镊子将鱼整条肠道取出。 使用预冷的PBS 将肠道冲洗干净,用于苏木精-伊红(Hematoxylin-eosin,HE)染色。

表1 疾病活动指数打分Table 1 Criteria for scoring disease activity index
1.2.6 消化道指数的测定 患肠炎的实验鱼肠道会相应变短,肠壁变薄(甚至透明),肠的质量明显下降。消化道指数可反映实验鱼肠道炎症的程度。
实验鱼被灌注TNBS 或者PBS 1,3,7 d 后,分别对其进行活体解剖, 观察肠道炎症反应状况并测量鱼的体重、体长(自吻端到尾鳍部)、肠长和肠重。 计算实验鱼消化道指数。 消化道指数[17]:

1.2.7 髓过氧化物酶的测定 髓过氧化物酶(MPO)是中性粒细胞特有的酶。在炎症状态下,它被释入细胞外液,进入循环。 MPO 在中性粒细胞中含量是一定的, 通过供氢体邻连茴香胺供氢后生成黄色化合物,在波长460 nm 处用比色法测定MPO 的活力。
分别在肛灌TNBS 或PBS 后的第1,3,7 天对近肛门一段的后肠取样,用于MPO 活性检测。 检测方法按照南京建成生物工程研究所MPO 试剂盒说明书操作。
1.2.8 组织切片及HE 染色方法 将固定在10%福尔马林溶液中24~48 h 的肠道取出, 用预冷的PBS 冲洗肠道,然后用镊子夹住肛门远端一侧,将肠道的内侧暴露于外面,旋转镊子,向肠道近肛门端,一圈圈缠绕成“螺丝状”,将卷好的肠道用大头针固定后置于包埋盒里, 常温保存于10%福尔马林溶液固定。 按苏木精-伊红(Hematoxylin-eosin,HE)染色常规方法染色。
1.3 统计方法
用Microsoft Excel 2016 软件进行试验数据的统计分析。计量数据均用(±s)表示,组间比较用T-test 检验,**、## 代表P<0.01,*、# 代表P<0.05。
2 结果与分析
将体重 (35±5)g 的草鱼随机分成正常组、阴性组、阳性对照恩诺沙星组和活性肽MESH 组,每组18 尾。 草鱼被灌注TNBS 或PBS 1,3,7 d 后分别对其进行活体解剖, 结果显示活性肽MESH 可明显改善草鱼体表形态及肠道损伤程度, 降低疾病活动指数,表现出显著的抗肠道炎症作用。患肠炎的草鱼随着病情的加重消化道指数明显下降,而活性肽MESH 可有效缓解患病期草鱼消化道指数的下降程度。 髓过氧化物酶(MPO)的活性随着炎症程度的增加而升高, 活性肽MESH 抑制中性粒细胞含量增加,从而降低MPO 活性。 不同试验组草鱼肠道组织病理变化存在明显差异, 活性肽MESH 组实验鱼肠灌1 d 后,其肠道炎症现象与其它试验对照组相比,炎性细胞浸润较少,肠绒毛只有少部分脱落,结缔组织肿胀程度不高。 肠灌3 d后,其恢复速度明显高于阴性组和阳性对照组,肠道炎性细胞数量逐渐减少,肠绒毛开始迅速恢复。肠灌7 d 后, 肠道病理组织切片与正常组相比基本一致, 说明活性肽MESH 通过维持草鱼肠黏膜形态结构的完整性,促进肠道细胞及组织恢复,从而达到防治的效果。
2.1 活性肽对草鱼肠道炎症的影响分析
2.1.1 草鱼肛门及肠道炎症反应结果 根据草鱼体表及肠道组织结构表面的变化, 判断草鱼肠道炎症的程度。 草鱼被灌注TNBS 或PBS 1,3,7 d后, 对活体解剖, 观察肛门及肠道炎症的反应状况。
正常组,图1a 所示,灌注PBS 1 d 后肛门及肠道炎症状况,肛门周围无炎症现象。解剖后取其肠道观察, 肠道粘膜形状连续且有韧性, 粪便成形,肠壁无充血情况。 如图2a 及图3a 所示,灌注PBS 3 d 及7 d 后肛门及肠道炎症状况,与第1 天相同,肛门及肠道并没有炎症状况。
阴性组,图1b 所示,灌注TNBS 致炎1 d 后,其体表有多处掉鳞现象,胸鳍基部有充血,肛门周围炎症明显,肠道内没有食物,肠黏膜充血,肠道末端糜烂严重,有明显的肠道炎症现象。 如图2b所示,灌注TNBS 致炎3 d 后,肛门周围炎症区域有扩大现象,轻挤压腹部有黄色液体流出,肠道内的粪便间有很长的透明的“胶体”,形成“肠套”,肠壁变薄, 肠黏膜充血糜烂, 有严重的肠道炎症现象。 如图3b 所示,灌注TNBS 7 d 后,其肛门周围炎症状况有所减轻,解剖后观察其肠道,肠道内有少量食物,肠壁部分充血。

图1 不同处理组草鱼肠灌1 d 后肛门及肠道组织炎症反应Fig.1 Inflammatory response of anal and intestinal tissues of grass carp after intestinal enema for 1 day in different treatment groups
恩诺沙星组,如图1c 所示,灌注TNBS 致炎1 d 后,肛门周围发红,解剖后取其肠道观察,肠道内有不成形的食物,肠道近肛门端有充血现象。如图2c 所示,灌注TNBS 3 d 后,肛门周围炎症区域扩大,肠道内有成型的食物,前肠有充血现象。 如图3c 所示, 灌注TNBS 7 d 后, 肛门周围炎症好转,肠道有一定的韧性,肠壁无充血现象。
活性肽MESH 组, 如图1d 所示, 灌注TNBS致炎1 d 后,腹部有充血现象,肛门周围有轻微的炎症, 解剖后取其肠道观察, 肠道内有少量的食物, 肠壁末端有充血现象。 如图2d 所示, 灌注TNBS 致炎3 d 后,体表好转无充血现象,肛门周围炎症依然存在,肠道内有成型的粪便。 如图3d所示,灌注TNBS 致炎7 d 后,体表完好,肛门周围炎症好转,肠道连续且有韧性,肠壁较厚。
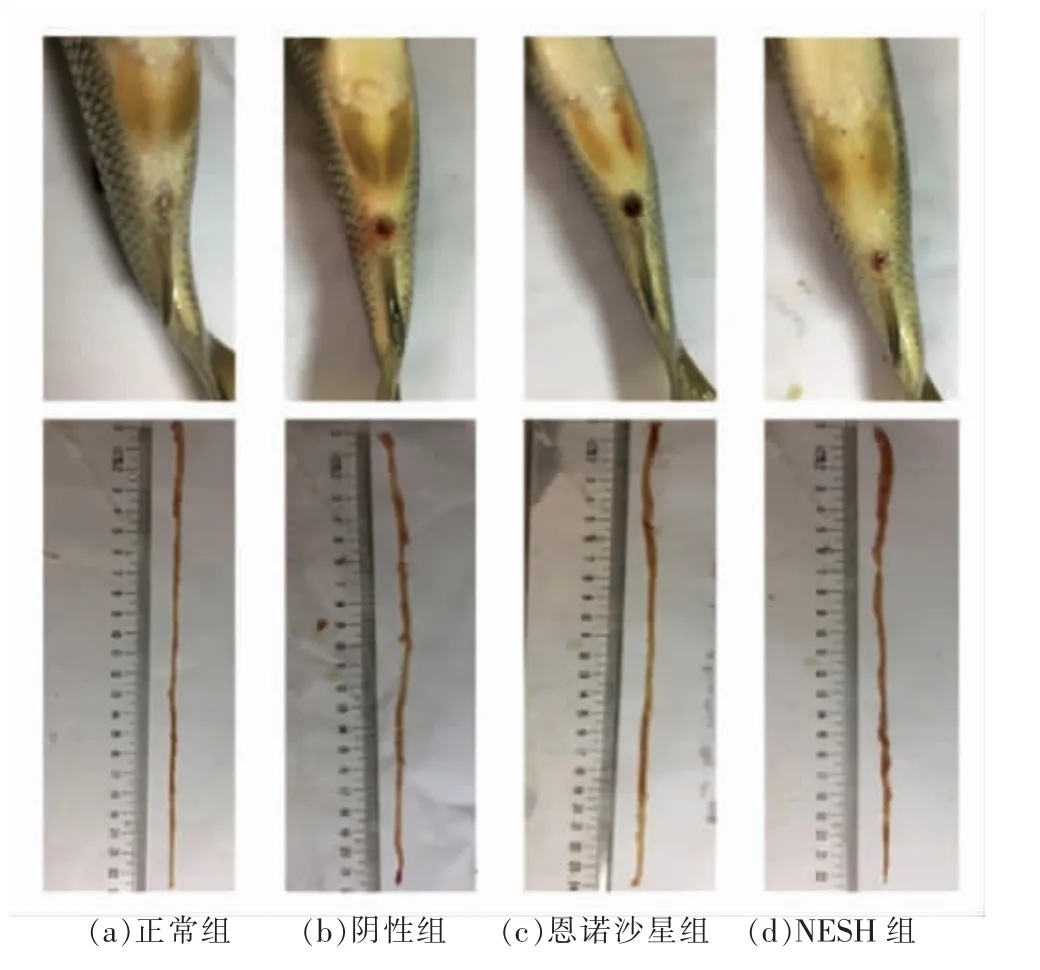
图2 不同处理组草鱼肠灌3d 后肛门及肠道组织炎症反应Fig.2 Inflammatory response of anal and intestinal tissues of grass carp after 3 days enema in different treatment groups

图3 不同处理组草鱼肠灌7d 后肛门及肠道组织炎症反应Fig.3 Inflammatory response of anal and intestinal tissues of grass carp in different treatment groups after 7 days enema
综上所述, 根据肛门及肠道炎症现象,MESH组在肠灌TNBS1d 后相较于阴性组和恩诺沙星组,肛门周围炎症区域显著缩小,肠道充血现象较轻,说明活性肽MESH 有一定的预防效果。通过后期对草鱼的治疗,可以观察到MESH 组灌注TNBS 3 d 及7 d 后,肛门及肠道周围炎症恢复速度明显高于阴性组,具体表现为:肛门周围炎症区域明显缩小,肠道连续且有韧性。 灌注TNBS 7 d 后肛门和肠道组织恢复到与正常组几乎相同的水平,说明活性肽MESH 有治疗草鱼肠道炎症的效果。
2.1.2 草鱼临床评分 草鱼的疾病活动指数评分越高,其肠道炎症越严重;反之,说明草鱼健康状况良好。不同处理组草鱼疾病活动指数(DAI)评分见图4。
如图4 所示,草鱼在灌注TNBS 后,其游动能力明显缓慢, 摄食量减少, 肛门周围炎症现象明显,与正常组相比较疾病活动指数显著升高,说明肠道灌注TNBS 的草鱼都有不同程度的炎症。MESH 组灌注TNBS 1 d 后,其疾病活动指数与阴性组相比显著下降(P<0.01),说明通过前期对草鱼肠道进行为期7 d 的药饵投喂, 达到预防肠道炎症的效果。 通过后期的治疗,MESH 组疾病活动指数一直处于下降的状态, 与阴性组草鱼疾病活动指数相比有显著性差异(P<0.01),且疾病活动指数一直低于恩诺沙星组, 说明活性肽MESH 对草鱼肠道炎症有一定的治疗效果, 比恩诺沙星的效果显著。
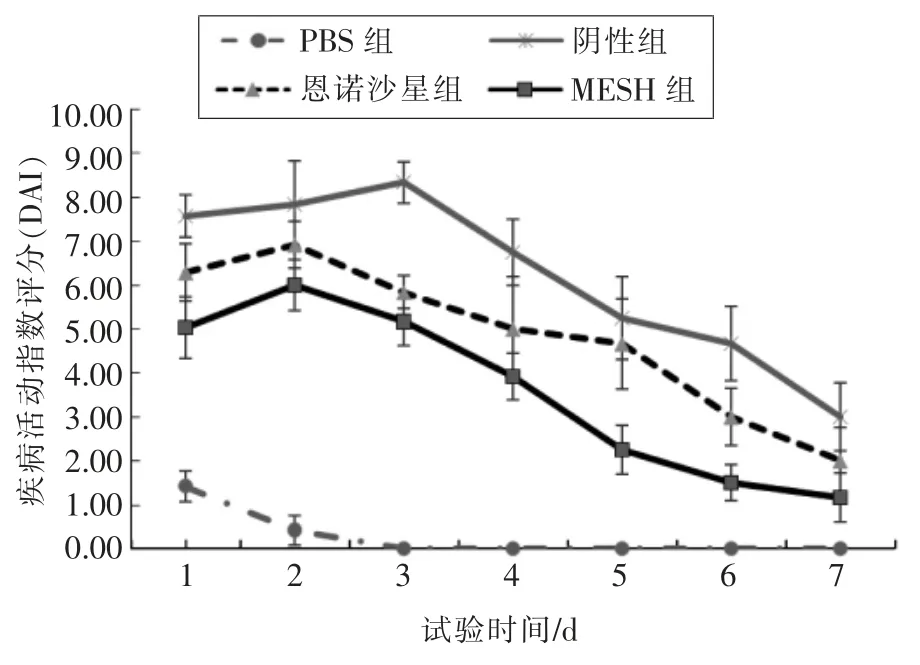
图4 不同处理组草鱼疾病活动指数(DAI)评分Fig.4 Disease activity index score of grass carp in different treatment groups
2.1.3 草鱼消化道指数 草鱼被灌注TNBS 或PBS 1,3,7 d 后分别对其活体解剖。观察肠道炎症反应状况并测量草鱼体重、体长(自吻端至尾鳍基部)、肠长以及肠重,计算草鱼消化道指数。结果见图5~6。
消化道指数反映草鱼肠道炎症的程度。 如图6 所示,灌注TNBS 1 d 后的实验鱼,与正常组相比,比肠重明显下降,阴性组尤为显著(P<0.01),下降了33.81%。 MESH 组与阴性组相比较,比肠重上升了21.58%,且有显著性差异(P<0.05)。灌注TNBS 3 d 后,恩诺沙星组和阴性组比肠重还在持续下降,而MESH 组明显上升,与阴性组比较有显著性差异(P<0.01)。 灌注TNBS 7 d 后,恩诺沙星组和MESH 组几乎与正常组相一致, 而阴性组仍显著低于正常组。如图5 所示,在各试验组之间比肠长差异并不显著,说明TNBS 诱导草鱼炎症,使其肠道长度缩短不明显。 综上所述,TNBS 灌注草鱼后,引起肠黏膜脱落,肠质量显著下降,从而引起不同程度的肠道炎症。MESH 组灌注TNBS 后有一定的肠炎,其严重程度明显轻于阴性组,且灌注TNBS 3 d 后,其比肠重高于恩诺沙星组,说明活性肽MESH 对草鱼的肠炎有一定的防治效果,且治疗效果比恩诺沙星显著。

图5 不同处理组草鱼比肠长的变化情况Fig.5 Changes of specific intestinal length of grass carp in different treatment
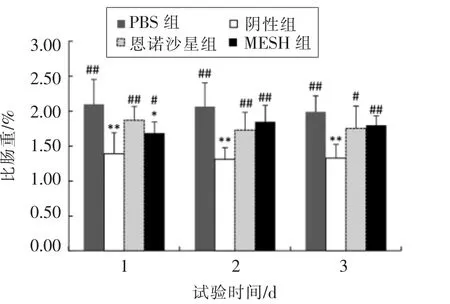
图6 不同处理组草鱼比肠重的变化情况Fig.6 Changes of specific intestinal weight of grass carp in different treatments
2.1.4 草鱼肠道MPO 活性变化 髓过氧化物酶(MPO)是中性粒细胞的标志,其含量增高,反映中性粒细胞在某一组织中增高, 间接反映组织有炎症。
草鱼被灌注TNBS 或PBS 的1,3,7 d 后分别对其活体解剖,观察草鱼肠道MPO 活性的变化。
如图7 所示,TNBS 处理1 d 后的草鱼MPO活性显著高于正常组(P<0.05),其中恩诺沙星组和阴性组极显著高于正常组(P<0.01)。 MESH 组MPO 活性相较于阴性组和恩诺沙星组最低,说明通过前期对草鱼进行为期7 d 的药饵预防, 可以提高肠道抗病能力,抑制中性粒细胞含量增高,对草鱼肠道炎症有一定的预防效果。 灌注TNBS 3 d后,草鱼MPO 活性降低,然而阴性组MPO 活性还极显著高于正常组(P<0.01),MESH 组和恩诺沙星组MPO 活性虽高于正常组,但与阴性组相比显著低于阴性组(P<0.05)。 灌注TNBS 7 d 后,草鱼MPO 活性持续下降,MESH 组和恩诺沙星组MPO活性降低明显,与阴性组比有极显著的差异(P<0.01),说明通过后期的治疗,活性肽MESH 和恩诺沙星对草鱼肠道炎症有明显的治疗效果。 综上所述, 活性肽MESH 通过控制中性粒细胞含量增加,从而对草鱼的肠道炎症起到防治作用。
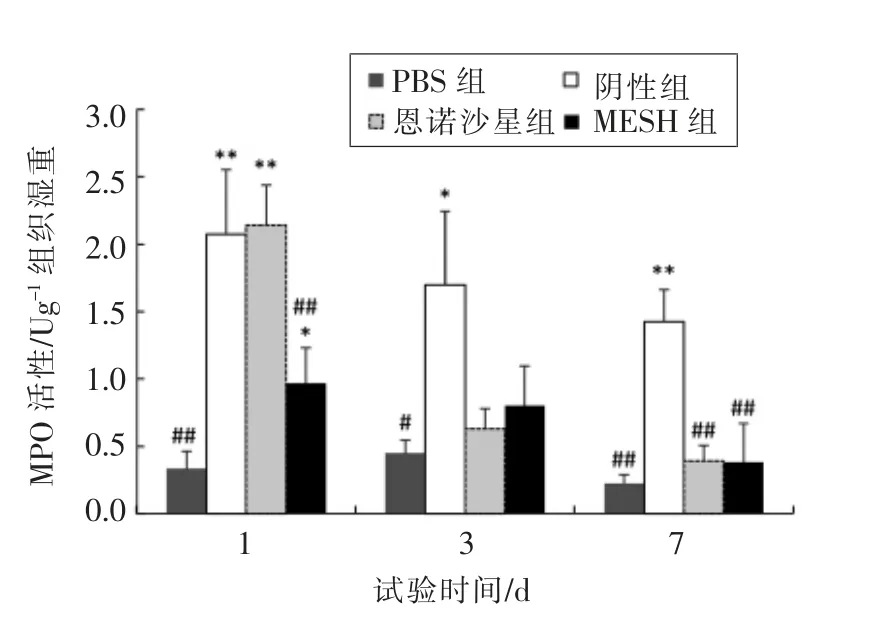
图7 不同处理组草鱼肠道MPO 活性的变化Fig.7 Changes of MPO activity in intestinal tract of grass carp in different treatments
2.1.5 草鱼肠道组织结构变化 肠道病理组织切片具有一定组织学特征, 对肠道疾病的诊断具有重要意义。通过观察肠黏膜的损伤程度、炎性细胞的浸润程度以及隐窝结构的改变, 可判断出肠道炎症的病变程度。 草鱼被灌注TNBS 或PBS 的1,3,7 d 后分别对其活体解剖,观察草鱼肠道组织结构的变化,见图8。
如图8 所示, 横向为同组实验鱼不同时期肠道组织的变化情况, 纵向为不同试验组同一时期肠道组织的变化情况。
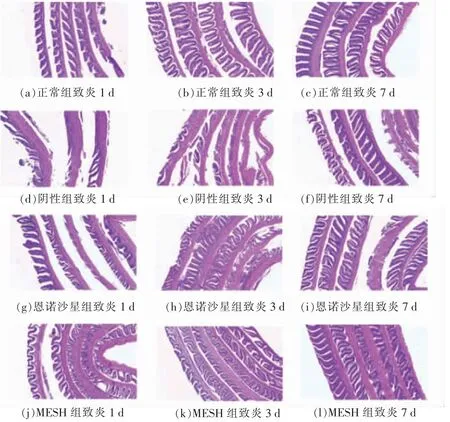
图8 草鱼肠道病理组织结构变化情况Fig.8 Intestinal structure change of pathological tissue of grass carp
正常组,如图8a 所示,PBS 处理1 d 后仅出现轻度炎症,上皮细胞排列规则,肠道远端仅有部分肠绒毛损伤, 杯状细胞分布在上皮细胞间。 阴性组,如图8d 所示,TNBS 处理1 d 后,炎性水肿引起小肠绒毛上的柱状上皮细胞坏死、脱落,大部分肠绒毛消失。 上皮细胞粘连在一起,黏膜层、黏膜下层结缔组织间以及环纵肌的肌层间腔, 有大量的炎性细胞浸润。炎性水肿引起肠壁显著增厚,有明显的急性炎症的状况,且严重程度较为明显。相比较而言,MESH 组,如图8j 所示,肠道绒毛只有部分损伤,肠壁增厚不显著,炎性细胞浸润较少,与阴性组相比有显著性差异, 并且比恩诺沙星组肠道组织病理变化轻微, 说明活性肽MESH 通过前期的预防对草鱼肠道结构有保护的作用, 从而抑制TNBS 毒性物质进入肠道内与组织蛋白结合形成抗原引起肠道炎症。 正常组灌注PBS 3 d 后,肠绒毛和肠上皮细胞排列整齐、紧凑,肠道组织已经恢复正常。阴性组,如图8e 所示,与第1 天组织状况相比,其炎性细胞依然大量存在,肠道绒毛部分恢复,然而,其柱状上皮细胞还是有崩解、脱落现象, 固有层及黏膜下层结缔组织发生肿胀、坏死、解体现象。 相比恩诺沙星组和MESH 组,如图8h 和图8k 所示,草鱼肠道病理变化均有改善,肠绒毛基本恢复,肠道黏膜下层、肌层及结缔组织间炎性细胞明显减少。 阴性组灌注TNBS 7 d 后,草鱼由急性炎症转为慢性炎症,如图8f 所示,损伤部位募集炎性细胞,形成新的肠绒毛,杯状细胞大量存在,肠道炎症有所减缓。 MESH 组,如图8l 所示,肠道组织变化基本恢复正常。 恩诺沙星组,如图8i 所示,仍有部分肠绒毛正在恢复,还没有完全恢复正常。
综上所述, 活性肽MESH 对草鱼肠道炎症有防治的效果,且其效果比恩诺沙星更加显著。
2.2 活性肽对鳗鱼肠道炎症的影响
采用和草鱼同样的测试方法, 获得系列数据结果与草鱼的结果一致, 列举两项最直接数据如下。
2.2.1 鳗鱼消化道指数 如图9 和图10 所示。
3 结论
裂殖壶菌藻粕酶解产物MESH 应用在含有维生素AD 的饲料中, 对草鱼和鳗鱼肠道炎症有显著的防治效果。 其能明显改善草鱼和鳗鱼鱼体表形态及肠道损伤程度, 降低疾病活动指数评分情况,表现出显著的抗肠道炎症作用。 经TNBS 诱导后,鱼髓过氧化物酶(MPO)的活性随着炎症程度的加深而升高,MESH 组通过抑制中性粒细胞含量增加,降低MPO 的活性。 不同试验组草鱼和鳗鱼肠道组织病理变化存在明显差异,MESH 组实验鱼灌注TNBS 1 d 后,其肠道发生炎症现象与其它试验对照组相比,炎性细胞浸润明显较少,肠绒毛只有少部分脱落,结缔组织肿胀程度不高。灌注TNBS 3 d 后,其恢复速度明显高于阴性组和阳性对照组,肠道炎性细胞逐渐减少,肠绒毛开始迅速恢复。 灌注TNBS 7 d 后,肠道病理组织切片与正常组相比较基本一致, 说明MESH 通过维持草鱼和鳗鱼肠黏膜形态结构的完整性, 促进肠道细胞及组织的恢复能力,从而达到防治的效果。
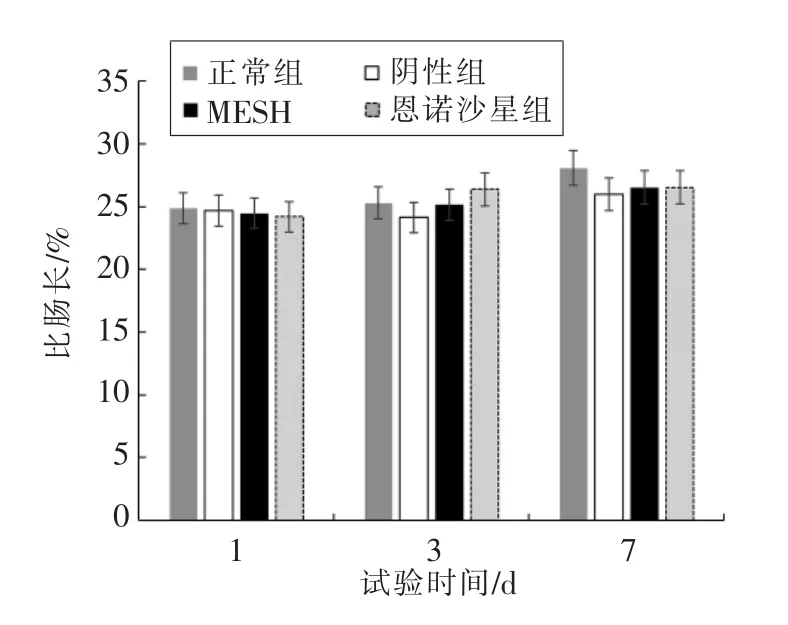
图9 鳗鱼消化道指数比肠长的变化Fig.9 Changes of specific intestinal length of eel in different treatment
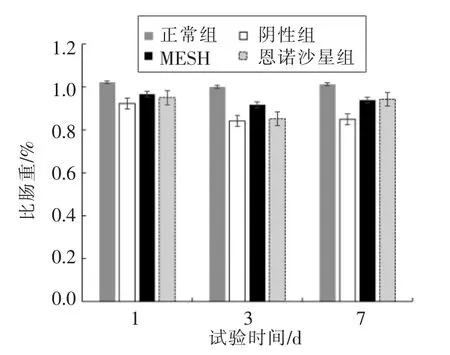
图10 鳗鱼消化道指数比肠重的变化Fig.10 Changes of specific intestinal weight of eel in different treatment
微藻裂殖壶菌藻粕酶解活性肽MESH 及复合饲料中的维生素AD 可有效抑制水产鱼类肠炎,替代现有抗生素应用于治疗鱼类肠炎。
