猕猴桃果园林下不同管理模式对土壤的影响
2020-08-31刘芝秀李小艳
刘芝秀,杨 红,李小艳
(1 西昌学院动物科学学院,四川西昌 615000;2 西昌学院资源与环境学院)
果园生草是指选择适宜草种在果园内进行人工种植,或者选留原生植被并剔除不适宜杂草的自然生草[1]。果园生草与土壤有机质、土壤矿物营养元素、土壤水分以及土壤微生物和酶活性等的变化密切相关,影响着果园的生态环境和经济效益[2]。近10 年来,果园生草在果树行业发达的国家普遍推行,50%以上的园区都实施了生草覆盖[3]。果园生草作为绿色果品生产主要技术措施,自20 世纪90 年代引进以来,在全国范围内进行了推广。但在实践生产中,生草果园占比低,不到全国果园总面积的10%,果园生草在我国仍然处于初级阶段,需要进一步的推广与发展[4]。
土壤是一切生物赖以生存的基础,由各种微生物、有机物、无机物等组成[5]。土壤结构、土壤养分以及土壤的理化性质等影响着植株的生长和微环境变化[6]。对于土壤而言,土壤微生物通过分解作用,将枯枝落叶和动物生命过程中产生的各种有机物质进行分解,形成腐殖质,为土壤带来丰富的营养成分,并对土壤肥力的保持起着重要的作用[7]。土壤酶作为土壤的组成成分之一,参与土壤中的生物化学反应。通过检测酶的活性,可以了解土壤生物学状况,为判断土壤肥力、土壤品质以及土壤健康提供理论依据[8]。根际土壤作为特殊的生态系统,由植物、土壤、微生物共同影响,它与周围非根际土壤在生物学特征、化学成分上存在显著差异[9]。植物通过根系凋落物、根系分泌物等影响土壤特征,进而对整个土壤的理化性质产生影响。不同作物对土壤理化性质、微生物数量及土壤酶活性有不同的影响,且彼此之间存在着密切联系[10]。
果园生草作为先进的管理技术,在葡萄(Vitis)[11]、苹果(Malus pumila)[12]、柿子(Persimmon)[13]等果树中先后进行了推广,证明其对土壤微生物数量、土壤酶活性以及土壤理化性质的变化等均具有一定的影响。有张承等[14]在猕猴桃果园林下进行生草试验,发现套种吉祥草(Reineckia carnea)可显著提高猕猴桃根际土壤微生物数量,增强猕猴桃根际土壤脲酶、过氧化氢酶活性,改善猕猴桃果实品质。通过在猕猴桃林下人工种植白车轴草(Trifolium repens)、长柔毛野豌豆(Vicia villosa)2 种豆科植物,并以自然生草作为对照,旨在研究不同生草方案对土壤微生物数量、土壤酶活性、土壤理化性质的影响,为生产实践选择适宜的生草管理模式提供理论依据。
1 研究内容与方法
1.1 试验地概况及实验设计
试验地设在四川省西昌市琅环乡“凉山州畅兴农业有限责任公司”(以下称“畅兴公司”)的猕猴桃果园内,该地坐落于安宁河西岸,属于亚热带高原季风气候,年均降雨量1004.3mm,平均气温17.2℃,冬春季节干旱降雨少,雨季主要集中在5~9 月。白天太阳辐射强,光热资源丰富,昼夜温差大。2014 年“畅兴公司”在琅环乡建植猕猴桃园6.67hm2,引种“金果”“金艳”“红阳”等多个品种。本试验选择在树龄5 年的“金果”猕猴桃林下进行。2017 年9 月在果树林下种草,人工种植白车轴草和长柔毛野豌豆,以自然生草为对照,每年结合果园对林下植被的要求进行刈割等日常管理。
1.2 土样采集及预处理
土样于2019 年4 月进行采集。在各处理区采用5点采土法,随机选取猕猴桃植株,距离主干30cm 处,除去土壤表层植被,分点挖取0~10cm 深处的部分土壤和根系,采用抖根法,分离猕猴桃根际土壤和非根际土壤。然后过2mm 筛,放入装有冰袋的泡沫箱中立即带回实验室。将土样分成3 份,1 份置于4℃冰箱保存,用于土壤微生物数量的测定;1 份风干后过0.3mm 筛,用于土壤酶活性的测定;另1 份风干后送检,用于土壤基本理化性质的测定。
1.3 研究内容与方法
1.3.1 土壤微生物数量的测定。土壤稀释液的制备:称取10g 新鲜土壤,放入装有90mL 无菌水的250mL 三角瓶中,震荡20min,依次制成10-1~10-8梯度稀释液。
土壤微生物的培养与计数:用平板稀释涂布计数法测定细菌、真菌、放线菌的数量。细菌采用牛肉膏蛋白胨琼脂培养基,放线菌采用改良高氏合成一号琼脂培养基,真菌采用马丁培养基,结果以每1g 干土所含数量表示[15]。菌数/g 干土=计数皿平均菌落数×计数皿稀释倍数×水分系数/0.3[16]。
1.3.2 土壤酶活性的测定。土壤酶测定使用南京建成生物工程研究所试剂盒,按说明书测定不同酶活性。过氧化氢酶活性测定采用比色-分光光度法,结果以每天每1g 风干土样催化1μmol H2O2降解定义为一个酶活力单位表示;多酚氧化酶活性测定采用邻苯二酚比色法,结果以每天每1g 土壤中产生1mg 紫色没食子素为1 个酶活力单位表示;脲酶活性测定采用靛酚蓝比色法,结果以每天每1g 土样中产生1μg NH3-N 为一个酶活力单位表示。
1.3.3 土壤理化性质的测定。土壤含水量的测定采用烘干法;土壤有机质、总氮、总磷含量由青岛衡立检测有限公司检测。土壤有机质采用重铬酸钾氧化-外加热法测定;总氮采用半微量凯氏法和扩散法测定;总磷采用碱熔法和酸溶法测定。
1.3.4 数据处理。试验采用Excel 2010 与SPSS 20.0 软件进行数据处理。
2 结果与分析
2.1 不同管理模式对猕猴桃果园土壤微生物数量的影响
表1 显示,对不同管理模式下猕猴桃根际土壤细菌数量而言,长柔毛野豌豆细菌数量最多,而白车轴草和自然生草较少,但差异不显著;对不同管理模式下猕猴桃根际土壤真菌数量而言,长柔毛野豌豆真菌数量最多,其次,自然生草高于白车轴草,不同处理间差异显著。对不同管理模式下猕猴桃根际土壤放线菌数量而言,长柔毛野豌豆放线菌数量最多,显著高于白车轴草和自然生草;白车轴草和自然生草两者差异不显著。

表1 不同管理模式下猕猴桃果园根际土壤微生物数量
不同管理模式下猕猴桃非根际土壤细菌数量表现为白车轴草>自然生草>长柔毛野豌豆(表2),三者之间差异不显著。对不同管理模式下猕猴桃非根际土壤真菌数量而言,白车轴草真菌数量显著低于其他2种处理;长柔毛野豌豆和自然生草两者差异不显著。对不同管理模式下猕猴桃非根际土壤放线菌数量而言,自然生草放线菌数量最多,长柔毛野豌豆次之,两者都显著高于白车轴草。
2.2 不同管理模式对猕猴桃果园土壤酶活性的影响
由图1 可知,不同管理模式下猕猴桃根际土壤过氧化氢酶活性表现为自然生草>长柔毛野豌豆>白车轴草,且三者之间差异显著。对不同管理模式下猕猴桃非根际土壤过氧化氢酶活性而言,长柔毛野豌豆最高,显著高于其他2 种处理;自然生草和白车轴草处理之间差异显著。

表2 不同管理模式下猕猴桃果园非根际土壤微生物数量
由图2 可知,对不同管理模式下猕猴桃根际土壤多酚氧化酶活性进行比较,自然生草根际土壤多酚氧化酶活性最低,长柔毛野豌豆和白车轴草相近,3 种处理差异不显著。对不同管理模式下猕猴桃非根际土壤多酚氧化酶活性而言,长柔毛野豌豆最高,其次为自然生草,白车轴草活性最低,且显著低于其它2种处理,长柔毛野豌豆和自然生草处理差异不显著。
由图3 可知,对不同管理模式下猕猴桃根际土壤脲酶活性而言,自然生草根际土壤脲酶活性显著高于白车轴草,其他处理差异不显著。比较不同管理模式下猕猴桃非根际土壤脲酶活性,发现自然生草非根际土壤脲酶活性显著高于白车轴草和长柔毛野豌豆;但白车轴草和长柔毛野豌豆的差异不显著。
2.3 不同管理模式对猕猴桃果园土壤基本理化性质的影响
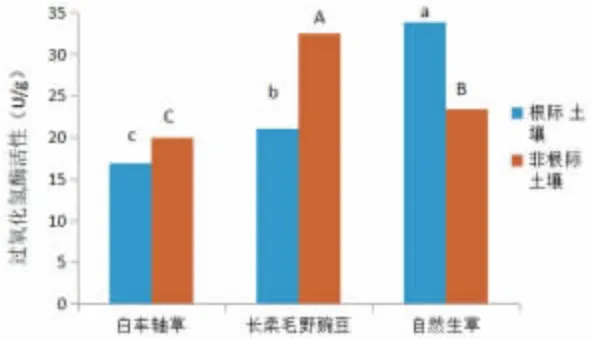
图1 不同管理模式对猕猴桃果园土壤过氧化氢酶活性的影响
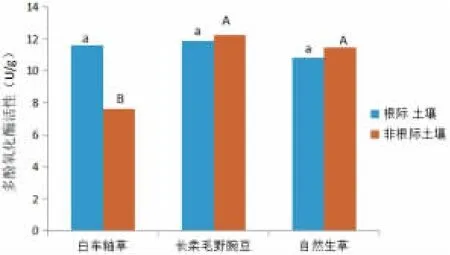
图2 不同管理模式对猕猴桃果园土壤多酚氧化酶活性的影响
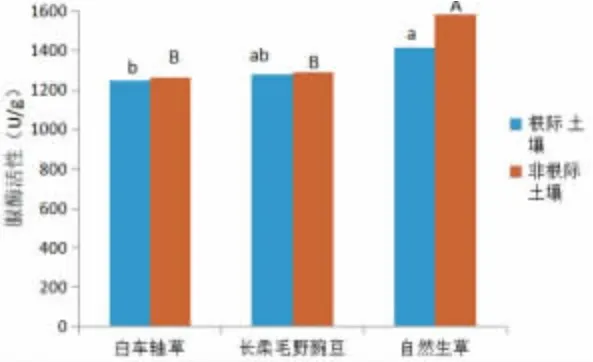
图3 不同管理模式对猕猴桃果园土壤脲酶活性的影响
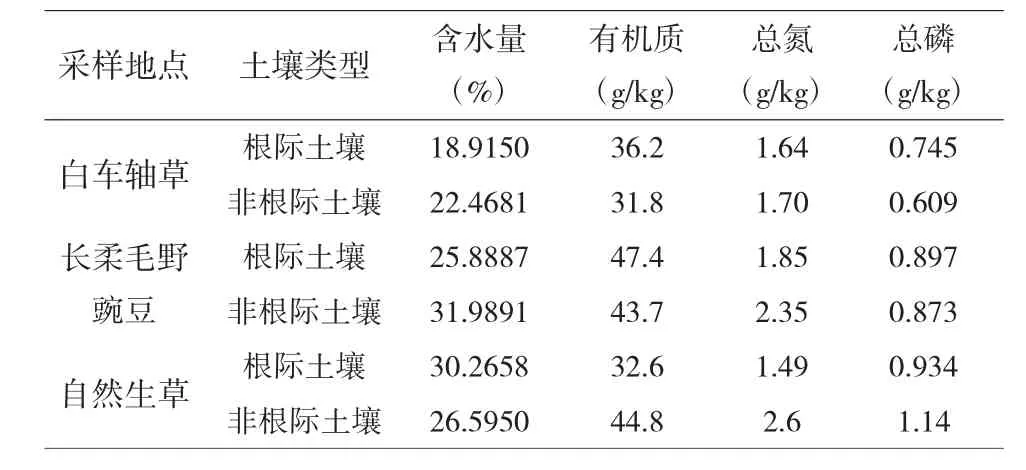
表3 供试土壤基本理化性质的测定结果
2.3.1 不同管理模式下猕猴桃果园土壤基本理化性质分析。从表3 可以看出,猕猴桃根际土壤含水量和总磷含量均表现为白车轴草<长柔毛野豌豆<自然生草;土壤有机质和总氮含量均表现为长柔毛野豌豆>白车轴草>自然生草。猕猴桃非根际土壤有机质、总氮和总磷含量均为自然生草>长柔毛野豌豆>白车轴草;非根际土壤含水量为长柔毛野豌豆>自然生草>白车轴草。
2.3.2 土壤基本理化性质与土壤微生物数量以及酶活性的相关性分析。由表4 可知,土壤真菌数量与土壤含水量呈显著正相关(P<0.05);土壤脲酶活性与土壤全氮含量呈极显著正相关(P<0.01);土壤细菌、放线菌以及土壤过氧化氢酶、多酚氧化酶与土壤养分之间无相关性(P>0.05)。

表4 土壤基本理化性质与微生物数量和土壤酶活性的相关性分析
3 讨论
土壤微生物作为土壤的重要组成成分之一,积极参与土壤养分的转化和循环,在土壤肥力形成过程中起着重要的作用。草地植被发育良好,使得较多的根和凋落物进入土壤,增加了土壤养分含量,为土壤微生物提供了充足的食物来源,促进了它们的生存和繁殖[17]。研究表明,在肥力好的土壤中,土壤微生物数量多,土壤细菌和放线菌的种群数量高[6]。本研究结果表明,在果园林下种植长柔毛野豌豆,猕猴桃根际土壤的细菌、真菌、放线菌数量均最高。对于猕猴桃非根际土壤微生物数量而言,白车轴草非根际土壤细菌数量显著高于长柔毛野豌豆和自然生草,但真菌和放线菌数量显著低于其它2 种处理。这表明豆科植物对土壤微生物数量的影响较大。这与岳泰新[1]的研究结果相近。另外,本研究发现,土壤微生物数量与土壤理化性质之间无相关性,这可能是受其他非生物因素的影响。
土壤酶作为土壤肥力的重要指标,参与土壤有机质矿化释放C、P、N,反映土壤生物活性,直接影响着土壤的代谢性能[18-19]。土壤过氧化氢酶可以增强植物抗氧化能力,对植物抗逆能力具有重要意义。酚类物质与土壤微生物种群的分布密切相关,从而影响植物的生长与发育[20]。土壤脲酶作为唯一一种水解尿素肥料的酶类,对衡量土壤氮肥的转化具有重要意义[21]。在猕猴桃果园进行不同的生草处理,其土壤酶活性之间存在着一定的差异。本研究发现,在猕猴桃果园林下进行自然生草后,猕猴桃根际土壤的过氧化氢酶、土壤脲酶活性均高于其他2 种处理,土壤多酚氧化酶活性虽然最低,但与播种白花三叶草和长柔毛野豌豆后的结果差异并不显著。猕猴桃非根际土壤酶活性结果显示,播种长柔毛野豌豆后的土壤过氧化氢酶和多酚氧化酶活性均高于其它2 种处理,土壤脲酶活性显著低于自然生草。有研究表明,种植豆科植物有利于土壤氮素的积累[22]。但本研究结果表明,猕猴桃果园林下种植2 种豆科植物后,土壤脲酶活性都低于自然生草处理。这可能与生草初期(1~3 年)草与果树的争肥有关,使得土壤中N 含量下降。
土壤养分作为土壤肥力的重要物质基础,与林下生草栽培的草种有很大的关系[18,23],。研究结果表明,在猕猴桃果园林下进行人工生草对猕猴桃根际土壤理化性质的影响大于自然生草;而对于猕猴桃非根际土壤而言,自然生草能显著提高土壤理化性质。研究结果还表明,种植长柔毛野豌豆能显著提高猕猴桃根际土壤微生物数量和非根际土壤酶活性;自然生草能显著提高非根际土壤微生物数量和根际土壤酶活性。
综上所述,在猕猴桃果园林下种植长柔毛野豌豆和自然生草可增加土壤微生物数量,提高土壤酶活性和土壤的理化性质,但它们对根际土壤与非根际土壤的影响不一致,其原因有待进一步深入研究。土壤作为一个复杂的生态系统,时时刻刻都处于动态变化之中,猕猴桃果园林下不同管理模式对土壤的影响不同,需要结合多种指标,才能更加全面、准确的评价。
