HBV感染免疫耐受期产妇与正常产妇脐带血浆细胞样树突状细胞中PI3K、mTOR、p70S6K、IFNα的表达情况分析
2020-08-31杨雯珺彭建平
杨雯珺, 霍 燚, 彭建平
1 湖南中医药大学, 长沙 410007; 2 湖南中医药大学第一附属医院 肝病科, 长沙 410007
据世界卫生组织报道,截至2017年,全世界约有2.57亿慢性HBV感染者[1]。乙型肝炎仍是世界及我国的一项重大传染病,HBV感染者常因进展为肝癌、重型肝炎及肝硬化失代偿期并发症死亡[2]。研究发现,妊娠期间免疫活性的改变会影响乙型肝炎的自然史,包括增加乙型肝炎发作的风险。据报道[3],HBV慢性感染的妇女在妊娠期间乙型肝炎发作的流行率为6%~14%。慢性乙型肝炎相关的妊娠期糖尿病、产前出血、早产等均有报道[4]。与其他导致肝硬化的原因相似,乙型肝炎肝硬化确实增加了母亲和胎儿的死亡风险[5]。因此防治乙型肝炎仍是一项重要的工作。机体免疫应答功能的损害及HBV cccDNA在肝细胞核内潜伏是导致乙型肝炎慢性化及难以根治的重要原因[6-7]。研究[8]显示,核苷酸类似物联合序贯PEG-IFN治疗能提高HBsAg阴转率,提示提高机体的免疫调节功能可以增强清除HBV的能力。浆细胞样树突状细胞(plasmacytoid dendritic cells, pDC)是一种重要的免疫细胞,通过产生大量IFN及抗原递呈诱导适应性免疫应答抗病毒[9]。有实验[10]证实:PI3K-mTOR-p70S6K信号通路是pDC 产生Ⅰ型IFN的关键调节通路。在此背景下,本实验比较了乙型肝炎免疫耐受期产妇与正常产妇pDC中PI3K、mTOR、p70S6K及培养上清IFNα表达情况。
1 资料与方法
1.1 研究对象 选取湖南中医药大学第一附属医院产科住院部2017年10月-2020年1月健康产妇10例(正常组)及HBV感染免疫耐受期产妇脐带血20例(足月产产妇)(乙型肝炎组),诊断标准参照《慢性乙型肝炎防治指南(2015年更新版)》[11]。排除:(1)合并其他肝脏疾病、肝硬化、重型肝炎的患者;(2)合并HIV感染者;(3)合并糖尿病、冠心病、高血压、恶性肿瘤等其他心、脑、肾、肺慢性疾病;(4)合并免疫性疾病及使用免疫抑制剂治疗者。
1.2 主要试剂 淋巴细胞分离液(天津灏洋公司),PBS、RPMI-1640(Thermo公司),Recombinant Human IL-3、Flt3-L(peprotech,catalog#:200-03、300-19),BDCA-2-PE、CD123-FITC、BDA-4-APC及同型对照抗体(德国Miltenyi Biotec公司),CpG-A(5′-GGGGGACGATCGTCGGGGGG-3′,上海生物工程有限公司),Trizol(ambion,15596026),SYBR Green PCR试剂盒(KAPA Biosystems,KM4101),逆转录试剂盒(TAKARA,639505),DNaseⅠ(Fermentas,AM2295),DEPC处理水(bioswamp,RN1680),引物由武汉天一辉远有限公司合成,人IFNα ELISA试剂盒(Bioswamp,HM10251)等。
1.3 实验方法
1.3.1 脐带血pDC的体外培养及鉴定 按照已建立的体外分离培养脐带血pDC的方法进行培养及鉴定[12]。在培养的第7天加入CpG-A,24 h后分别收集细胞及上清液,分组标记,进行后续相应的mRNA、蛋白及INFα检测。
1.3.2 real-time PCR检测pDC中PI3K、mTOR、p70S6K mRNA定量 引物序列见表1。收集第8天的pDC,用Trizol提取pDC总mRNA,用DNase1消除总RNA中的DNA,根据逆转录盒说明合成cDNA单链模板,然后进行PCR扩增,扩增体系:SYBRGreen mix 10 μl,上游引物0.5 μl,下游引物0.5 μl,cDNA模板1 μl,ddH2O 8 μl,总体积20 μl。反应程序:95 ℃,3 min;95 ℃,5 s;56 ℃,10 s;72 ℃,25 s;39个循环;65 ℃,5 s;95 ℃,50 s。以β-actin为内参,用2-△△CT公式计算mRNA相对表达定量。

表1 引物序列表
1.3.3 Western Blot检测pDC中PI3K、mTOR、p70S6K 蛋白定量 配备溶液制胶,在pDC中加入蛋白酶及磷酸酶抑制剂的裂解液裂解细胞,加热,离心弃上清,提取出pDC总蛋白,定量蛋白,上样,电泳,转膜,封闭膜,抗体孵育,显色。使用软件测量蛋白条带灰度值。
1.3.4 ELISA法检测培养液上清的IFNα 按照ELISA试剂说明书操作测定上清中的IFNα,根据标准物浓度与OD值得出直线方程,根据每个样本OD值计算出样本IFNα的浓度。
1.4 伦理学审查 本研究方案经由湖南中医药大学第一附属医院伦理委员会审批(批号:AF/SC-07/02.0)。

2 结果
2.1 脐带血pDC流式细胞仪检测结果 细胞表面分子CD123、CD303、CD304均表达阳性的细胞为pDC,占17.22%,结果见图1。
2.2 两组pDC中PI3K、mTOR、p70S6K mRNA表达情况
与正常组比较,乙型肝炎组脐带血pDC PI3K、mTOR、p70S6K mRNA表达水平显著降低(P值均<0.001)(表2)。
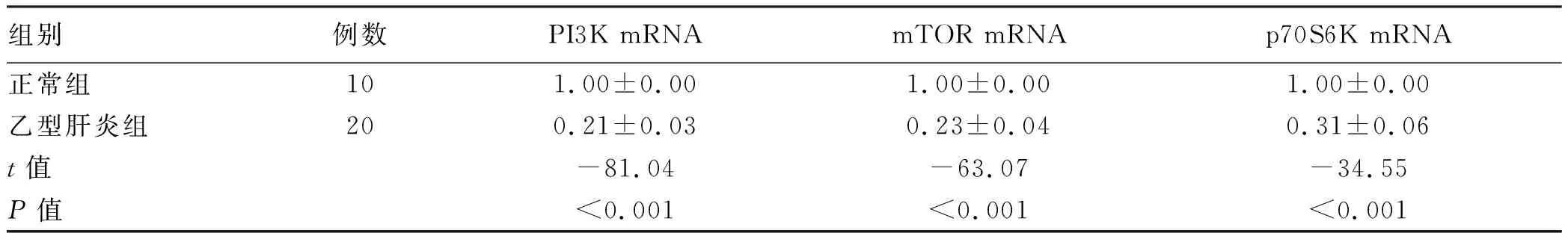
表2 两组产妇脐带血pDC中PI3K、mTOR、p70S6K mRNA相对表达量
2.3 两组pDC中PI3K、mTOR、p70S6K 蛋白表达情况与正常组比较,乙型肝炎组脐带血pDC PI3K、mTOR、p70S6K 蛋白表达水平显著降低(P值均<0.05)(表3,图2)。
2.4 两组培养液上清IFNα表达情况 正常产妇与HBV感染免疫耐受期产妇脐带血pDC培养上清IFNα分别为(12 663.06±1286.96)pg/ml、(6069.77±953.23)pg/ml,与正常产妇比较,HBV感染免疫耐受期产妇脐带血pDC 培养上清IFNα表达水平显著降低(t=-15.88,P<0.05)。

表3 两组产妇脐带血pDC中PI3K、mTOR、p70S6K蛋白相对表达量
3 讨论
近年来在HBV研究中,pDC受到重视,pDC产生体内95%左右的Ⅰ型IFN,pDC通过Toll样受体(TLR)9识别病毒,由包含髓样分化因子88(myeloid differentiation factor 88,MyD88)、PI3K、mTOR、p70S6K、IFN调节因子(interferon regulatory factor,IRF) 7等分子的通路产生大量Ⅰ型IFN[9-10],IFN通过诱导细胞合成的抗病毒蛋白抑制病毒复制,并调节NK细胞、DC、辅助性T淋巴细胞、B淋巴细胞等抗病毒[13],同时,pDC还作为抗原递呈细胞,活化B淋巴细胞及效应T淋巴细胞,激活体液免疫及细胞免疫抗病毒[9],研究[14-15]表明在多种慢性病毒感染性疾病,包括急慢性HBV感染,患者外周血pDC数量减少、功能亦受损。有实验[16]证实,HBV能抑制TLR9-IRF7-IFNα信号通路,从而抑制pDC分泌IFNα,从而逃逸机体的免疫应答,导致HBV持续的慢性感染。pDC功能受损是乙型肝炎慢性化的重要原因之一。
PI3K-mTOR-p70S6K信号通路参与了多种重要的细胞生理功能,该途径的异常能导致恶性肿瘤、免疫性疾病、病毒感染不能清除等[17-18]。研究[19]发现,抑制HepG2细胞的PI3K-Akt-mTOR通路,促进HBV的复制。Cao等[10]研究显示TLR9介导的pDC产生IFN的过程需要PI3K-mTOR-p70S6K信号通路参与,抑制mTOR及p70S6K导致IFNα减少。国内外关于HBV影响PI3K-mTOR-p70S6K通路亦有类似报道。HBV治疗性疫苗-可溶性CTP-HBcAg18-27-Tapasin融合蛋白疫苗降低CD8+T淋巴细胞的凋亡,增强CD8+T淋巴细胞的反应,并诱导HLA-A2转基因小鼠的细胞免疫功能,研究[20]表明,该疫苗实现以上功能亦是通过PI3K-mTOR-p70S6K通路的激活实现的。
新生儿脐带血DC是研究免疫耐受较好的细胞模型。研究[21]发现,健康胎儿脐血DC功能明显下降,其原因为自然产生免疫耐受,防止对胚胎的免疫排斥反应;孕妇分娩时脐带血pDC及mDC百分比较健康人外周血明显下降。推测妊娠期间DC数量的减少在维持针对胚胎的免疫耐受中起着重要作用[22]。还有研究[23]表明,脐带血DC特异性表面分子、基因和蛋白的表达明显降低,这可能导致脐带血DC诱导的CD8+T淋巴细胞活化的细胞表面信号转导缺乏启动因素。脐带血DC中表达显著降低的基因和蛋白也可能与先天性和适应性免疫功能和特性有关[23]。故本研究以HBV感染免疫耐受期产妇脐带血pDC为研究对象,能更好地反映机体感染HBV后的免疫耐受状态。
关于HBV感染免疫耐受期产妇脐带血pDC PI3K、mTOR、p70S6K及IFNα表达的变化,目前国内外尚未见相关研究。本研究比较HBV感染免疫耐受期产妇脐带血与健康产妇脐带血pDC PI3K、mTOR、p70S6K及IFNα表达的变化,进一步阐述HBV感染免疫耐受的机制。本研究发现,HBV感染免疫耐受期产妇脐带血pDC中PI3K、mTOR、p70S6K mRNA和蛋白表达水平及培养上清IFNα水平较正常产妇明显下降,提示pDC功能低下,是乙型肝炎慢性化的可能原因之一。分析可能的原因:(1)HBV和HBsAg抑制PI3K-mTOR-p70S6K信号通路中p70S6k磷酸化,进而抑制IRF7磷酸化和IFNα基因转录。有学者[24]通过体外培养pDC,用HBV和HBsAg体外干预,发现HBV和HBsAg阻断了CpG-A/TLR9诱导的、mTOR介导的S6磷酸化以及随后的IRF7磷酸化和IFNα基因转录,导致pDC产生IFNα功能受抑制。(2)HBV导致TLR9-MyD88复合物的损害,进而导致IRF7的磷酸化及核转位中断[10]。(3)除了HBV对pDC的直接影响外,HBV也能干扰pDC与单核细胞的相互作用,间接影响pDC产生IFNα的功能[24]。HBV感染介导pDC产生IFNα的过程涉及复杂的信号通路,该实验仅观察了较为重要的PI3K、mTOR、p70S6K指标,信号通路中的其他分子如Akt、PIP3、PDK-1、PTEN、TSC1、TSC2、mTORC1、mTORC2、eIF-4E等及各种分子相互间作用有待进一步研究。
