肝硬化及肝细胞癌患者腰肌横向厚度指数与营养风险的相关性分析
2020-08-30肖慧娟2c
韩 芳, 肖慧娟, 张 翔, 韩 涛,2c,3,4,5
1 天津医科大学三中心临床学院, 天津 300170; 2 天津市第三中心医院 a.营养科; b.放射科; c.肝内科, 天津 300170; 3 天津市肝胆疾病研究所, 天津 300170; 4 天津市人工细胞重点实验室, 天津 300170;5 卫生部人工细胞工程技术研究中心, 天津 300170
国内外研究[1-2]显示,营养风险筛查2002(nutritional risk screening 2002,NRS-2002)评分适用于肝硬化、肝细胞癌患者的营养风险评估。肌肉减少症是肝硬化、肝细胞癌患者病死率的独立预测因素[3-5]。近期一项研究[6]表明,CT检查经脐水平测得的腰肌橫向厚度指数(transversal psoas thickness index,TPTI)可预测肝硬化患者病死率,同时测量TPTI简单可靠。本研究尝试测量第3腰椎(L3)水平右侧腰肌横径(transversal diameter of the psoas muscle,TDPM)并计算TPTI,探究其与肝硬化、肝细胞癌患者发生营养风险的相关性。
1 资料与方法
1.1 研究对象 选取2018年1月-2019年1月于天津市第三中心医院住院,并行腹部CT的单纯肝硬化患者95例,及肝硬化合并肝细胞癌患者56例作为研究对象。纳入标准:肝硬化、肝细胞癌的诊断基于对患者病史、临床表现、化验结果、影像学检查及胃镜检查的综合分析。排除标准:(1)合并其他系统恶性肿瘤者;(2)合并甲状腺疾病、库欣综合征等代谢相关疾病者;(3)合并克罗恩病、溃疡性结肠炎等可能导致营养代谢障碍疾病者;(4)合并慢性心、肺、肾功能不全者;(5)伴肢体活动障碍者;(6)年龄<18岁或>85岁;(7)一般资料或化验、CT结果缺失者。
1.2 临床数据 收集入选患者性别、年龄、身高、体质量、BMI、肝硬化病因及血常规、肝功能、肾功能、电解质、空腹血糖、凝血常规等化验结果。患者体质量根据腹水、下肢水肿情况进行校正,即测得体质量减去腹水质量(轻度5%、中度10%、重度15%),若出现双踝水肿再减5%[3]。综合临床资料对患者进行Child-Pugh分级和营养风险筛查。
选取患者入院前后2周内的腹部CT检查,经L3水平测量右侧TDPM。腰肌轴径(axial diameter of the psoas muscle,ADPM)为腰肌最大前后径,TDPM为垂直于ADPM的最大直径,以mm表示。根据身高进行标准化,计算TPTI,以mm/m表示。
56例肝细胞癌患者中,27例接受经导管肝动脉化疗栓塞术治疗,6例接受射频消融治疗,9例经确诊后未于本院接受治疗,临床数据均取自治疗前;14例因脓毒血症、上消化道出血等严重并发症及肺骨远处转移不宜干预。
1.3 伦理学审查 本研究方案经由天津市第三中心医院伦理委员会审批。

2 结果
2.1 一般资料 151例患者中男121例,首位肝硬化病因为HBV,其次为酒精,其中12例HBV合并酒精、3例酒精合并自身免疫性肝病、1例HBV合并HCV;女30例,肝硬化病因主要为HBV,其次为自身免疫性肝病共7例,其中1例HBV合并自身免疫性肝病、1例HCV合并自身免疫性肝病(表1)。
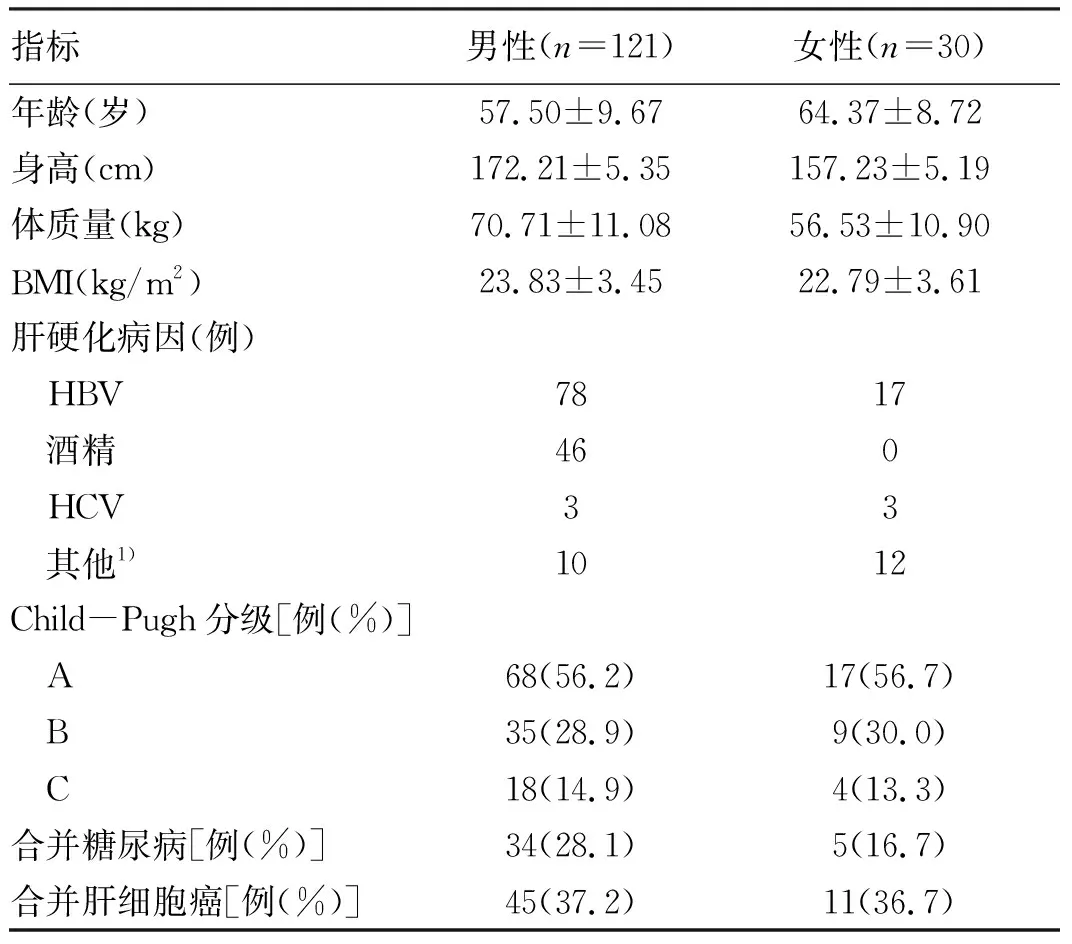
表1 纳入患者一般临床资料
2.2 不同Child-Pugh分级患者营养风险情况 营养风险发生率在Child-Pugh A、B、C级单纯肝硬化患者中分别为61.2%、80.6%、86.7%,趋势χ2检验显示随着肝功能储备降低,患者营养风险发生率呈增长趋势(χ2=5.051,P=0.025);在肝细胞癌患者中分别为44.4%、84.6%、85.7%,Spearman相关分析显示二者呈正相关,提示随着肝细胞癌患者肝功能储备降低,其营养风险发生率上升(r=0.388,P=0.003)。
2.3 营养风险组与无营养风险组对比分析 单纯肝硬化患者性别、年龄、BMI在两组间差异均无统计学意义(P值均>0.05),有营养风险组患者的Hb、Alb、Na、Ca、PTA、TPTI水平均明显低于无营养风险组(P值均<0.05)(表2)。肝细胞癌患者性别、年龄在两组间差异均无统计学意义(P值均>0.05),有营养风险组患者的体质量、BMI、Hb、Alb、Na、Ca、SCr、PTA、TPTI水平均明显低于无营养风险组患者(P值均<0.05(表3)。

表2 单纯肝硬化患者营养风险组与无营养风险组临床指标比较
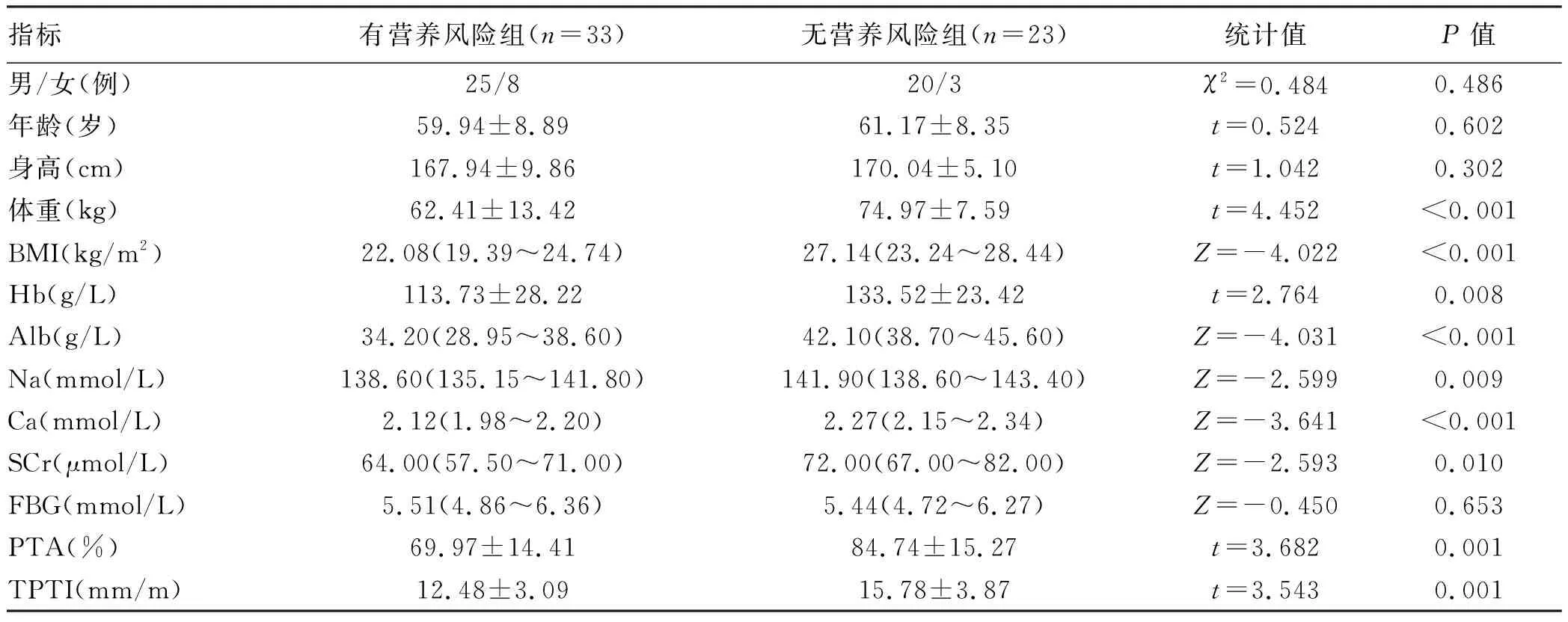
表3 肝细胞癌患者营养风险组与无营养风险组临床指标比较
2.4 患者营养风险与各指标相关性 logistic回归分析显示,单纯肝硬化患者Alb、TPTI与NRS-2002评分呈负相关,调整Alb水平后,TPTI值越高,肝硬化患者发生营养风险的可能性越低;肝细胞癌患者Alb、体质量与NRS-2002评分呈负相关,调整Alb水平后,体质量越低,肝细胞癌患者发生营养风险的可能性越高(表4)。

表4 营养风险相关因素的logistic回归分析结果
3 讨论
营养不良是肝硬化患者的常见并发症,并与肝硬化患者的疾病严重程度相关[7]。当肝硬化患者出现食管胃底静脉曲张破裂出血、腹水、肝性脑病等失代偿期并发症时,临床上多予以禁食水、限制钠盐、限制蛋白摄入等对症处理,造成患者营养物质摄入减少,营养代谢失衡,增加发生营养不良的风险。营养风险是指营养因素造成患者出现不良临床结局的风险,而不是指患者出现营养不良的风险,欧洲肠外肠内营养学会推荐NRS-2002评分用于住院患者营养风险筛查。本研究显示,肝硬化、肝细胞癌患者营养风险的发生与肝功能失代偿严重程度相关,随着肝功能储备下降,肝硬化、肝细胞癌患者营养风险发生率呈上升趋势。此外,肝硬化及肝硬化基础上合并肝细胞癌的患者,即使在肝功能代偿期,也有相当一部分患者存在营养风险,增加患者出现不良临床结局的风险。因此,对于该类患者,无论其是否处于失代偿期,均应进行营养风险及营养状态的评估,及时给予营养支持治疗。进行多学科小组营养干预能够提高患者的生存率和生活质量[8],研究[9]显示高纤维、高蛋白饮食并补充支链氨基酸对于肝硬化患者是一种安全的营养干预措施,在增加骨骼肌质量的同时,并未发现升高血氨水平。而一项Meta分析[10]显示营养支持治疗可增加营养不良住院患者的体质量(不限于肝病患者),但对患者临床结局未见明显积极影响。对此,还需要更多高质量的随机对照试验,验证营养支持治疗在营养不良肝病患者中的临床效果。
本研究中,肝硬化患者TPTI与NRS-2002评分呈负相关,logistic回归模型调整Alb水平后,TPTI值越高,肝硬化患者发生营养风险的可能性越低。肝细胞癌患者TPTI值在有营养风险组中显著低于无营养风险组,其中33例(58.9%)患者进行了射频消融或经导管肝动脉化疗栓塞术治疗,这部分患者一般状态及肝功能较好,可能与TPTI未被纳入logistic回归方程有关。经腹部CT检查评估腰肌状态对判断肝硬化、肝细胞癌患者是否存在营养风险具有一定的可行性和准确性,提示TPTI可作为一项营养风险筛查的新指标,未来还需更多大规模、高质量临床研究去验证TPTI在肝硬化、肝细胞癌人群中对营养风险的预测意义。
