《中国高尿酸血症与痛风诊疗指南(2019)》解读
2020-08-29林淑芃
林淑芃
近年来,我国高尿酸血症的发病率呈明显上升和年轻化趋势[1],中国高尿酸血症的总体患病率为13.3%,痛风为1.1%[2],已成为继糖尿病、高血压、高脂血症后的“第四高”。 由于我国临床医生和患者对高尿酸血症和痛风的诊断、治疗及预防可能存在一些认识盲区与误区,出现了诊疗水平参差不齐、患者依从性差、转归不良等现状,因此中华医学会内分泌学分会制定了《中国高尿酸血症与痛风诊疗指南(2019)》(以下简称本指南)。 本文结合国内外相关文献、指南和共识对本指南进行解读,为广大基层临床医生提供参考。
一、《中国高尿酸血症与痛风诊疗指南(2019)》制定的方法学特点
本指南的制定过程有以下3 个特点:(1)遵循国际通用GRADE 分级系统,采用临床循证指南制订方法和工作流程;(2)包括方法学、内分泌科、肾脏病科、消化科、心血管内科在内的多学科专家参与;(3)采用问卷调查和专家组面对面会议讨论的方式,筛选出针对高尿酸血症与痛风的10 个临床问题,形成了3 项总则和10 项推荐意见。
二、推荐总则
临床中常有一些高尿酸血症和痛风患者服用降尿酸药物达标后即停药、不再随诊复查的情况,患者和部分医生对高尿酸血症和痛风需要终身治疗、可能导致的并发症及危害并不十分了解,这些认识误区和盲区导致我国高尿酸血症和痛风的治疗率、控制率不高。 因此本指南在总则中强调高尿酸血症是一种慢性、全身性疾病,可导致多个靶器官的损伤,可能影响患者预后,与痛风、肾结石、慢性肾脏病、心脑血管疾病、糖尿病、高血压密切相关[3];强调了终身治疗和监测、预防并发症的重要性,纠正了一些盲区和误区,也是广大基层医生对患者进行宣教的重点,这部分内容是既往指南未曾专门提及的。 本指南形成的3 条总则是所有高尿酸血症和痛风患者均应遵循的治疗原则,见表1。
三、高尿酸血症与痛风的诊断标准及更新、治疗时机、目标值及分型
本指南对高尿酸血症和痛风的诊断标准依然沿用2016 年美国风湿病协会(ACR)/欧洲抗风湿病联盟(EULAR)的标准[4]。 由于近年来痛风诊断技术的不断进步,如高频超声[5]、双能CT[6]等影像检查手段的广泛应用,发现无症状高尿酸血症患者关节及周围组织可出现尿酸盐晶体沉积甚至骨侵蚀现象。 经过专家小组讨论,认为无症状高尿酸血症和痛风是一个连续的病理过程,对无症状高尿酸血症患者如影像学检查发现尿酸钠晶体沉积和(或)痛风性骨侵蚀,可诊断为亚临床痛风,并启动相应的治疗。 本指南不仅首次提出亚临床痛风的概念,还首次规范了难治性痛风的诊断标准。 本指南对高尿酸血症和痛风的开始治疗时机、控制目标值均给予了推荐,同时不建议将血尿酸长期控制在180 μmol/L 以下。 为方便广大基层医生对各个概念的认识,并掌握治疗时机及治疗目标,本文将主要内容汇总于表2。

表1 《中国高尿酸血症与痛风诊疗指南(2019)》推荐总则具体内容
从诊断标准可以看出,从无症状高尿酸血症→亚临床痛风→痛风→难治性痛风是一个连续、逐渐进展的病理生理和临床过程,早期发现、规范治疗、长期监测对于改善患者的预后非常重要。 对于非风湿免疫专业的内科医生、全科医生、基层医生而言,根据本指南常可准确识别临床表现典型的痛风患者,若根据临床表现不足以诊断痛风,建议转诊至相应专科医生或上级医院进一步确诊。
对于高尿酸血症的分型,本指南建议在无嘌呤或严格限制嘌呤饮食5 天后,检测血尿酸和尿尿酸排泄情况,根据尿尿酸排泄率(UUE)和尿酸排泄分数(FEUA)综合判定。 高尿酸血症可分为排泄不良型、生成过多型、混合型和其他型,并作为选择降尿酸药物的依据。 具体分型标准见表3。

表3 高尿酸血症的分型标准
四、高尿酸血症和痛风患者降尿酸治疗药物的推荐
本指南推荐别嘌醇、非布司他或苯溴马隆为痛风患者降尿酸治疗的一线用药(1B),别嘌醇和苯溴马隆为无症状高尿酸血症患者降尿酸治疗的一线用药(1B),单药足量、足疗程治疗血尿酸仍未达标的患者可考虑联合应用两种不同作用机制的降尿酸药物,不推荐尿酸氧化酶与其他降尿酸药物联用(1C)。 广大基层医生为肾功能不全患者选择降尿酸药物较为困难,本文结合《中国肾脏疾病高尿酸血症诊治的实践指南(2017 版)》[7]和《中国慢性肾脏病患者合并高尿酸血症诊治专家共识》[8]的推荐意见,将我国各指南关于肾功能不全患者降尿酸药物的推荐意见进行总结。
别嘌醇是黄嘌呤氧化酶抑制剂,尤其适用于尿酸生成过多型患者。 别嘌醇超敏反应的发生与HLA-B∗5801 阳性存在明显相关性,且汉族人群携带该基因型频率为10% ~20%,因此国内外指南对HLA-B∗5801 阳性患者均不推荐使用别嘌醇,有条件的地区在首次服用别嘌醇前最好检测HLA-B∗5801。 建议从小剂量起始,并根据肾功能调整起始剂量、增量及最大剂量:初始剂量为每次50 ~100 mg,每日1 ~3次;2 ~3周后增至每日300 mg分 2 ~3 次服用。 肾功能下降如 eGFR <60ml·min-1·(1.73m2)-1时对别嘌醇的使用应减量,推荐剂量为50 ~100 mg/d,eGFR <15 ml·min-1·(1.73 m2)-1时应禁用别嘌呤。
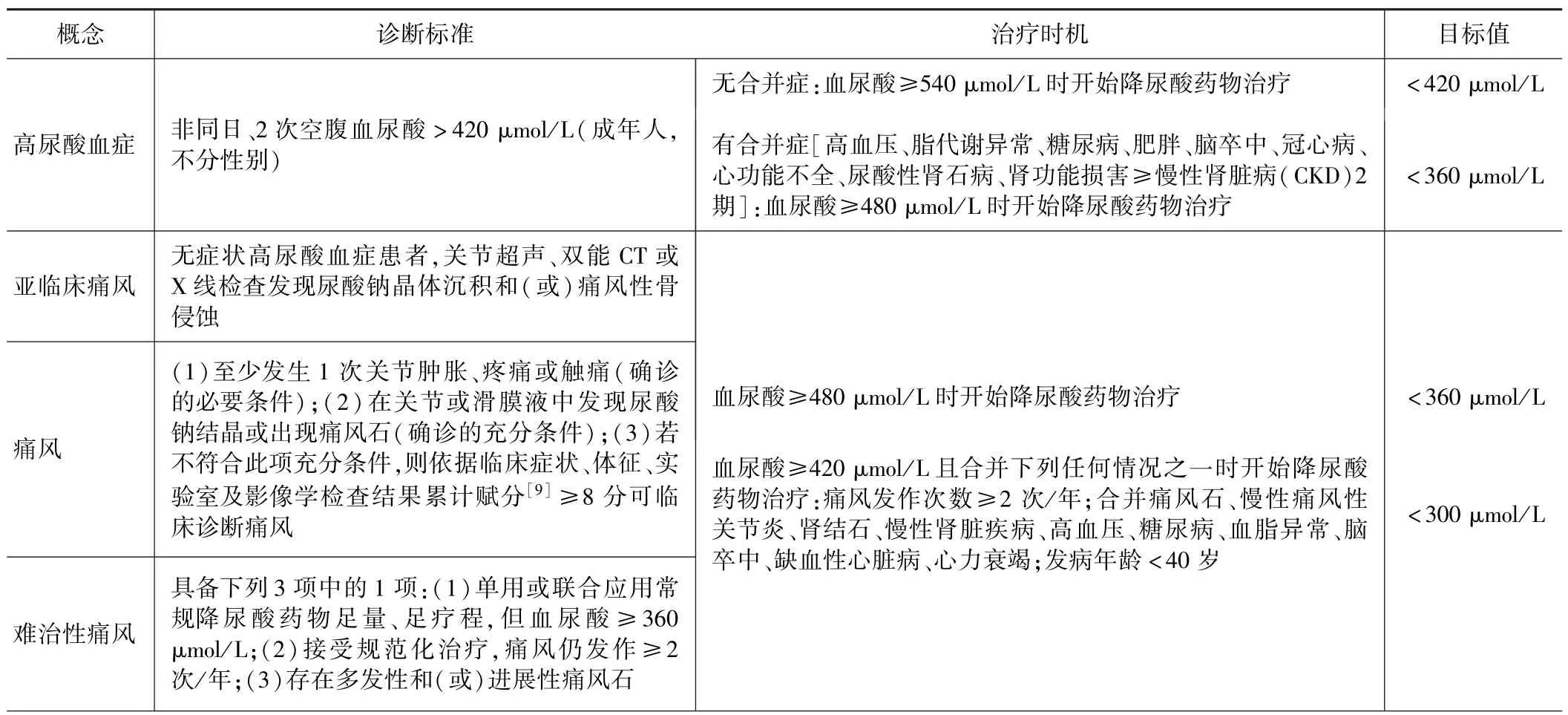
表2 高尿酸血症与痛风的诊断标准、治疗时机及目标值
非布司他为特异性黄嘌呤氧化酶抑制剂,有较好的降尿酸效果,尤其适用于慢性肾功能不全的患者。 由于非布司他对我国人群的降尿酸效果较好,本指南推荐起始剂量为20 mg/d,如果2 ~4 周后患者血尿酸水平仍未达标,可增加20 mg/d,最大剂量为80 mg/d。 轻、中度肾功能不全[eGFR 为30 ~89 ml·min-1·(1.73 m2)-1]的患者无需调整剂量,已有多项研究证实非布司他对于CKD 4 期及以上患者的有效性及安全性较好,建议起始剂量为20 mg/d。
苯溴马隆通过抑制肾近端小管尿酸盐转运蛋白1(URAT-1)抑制肾小管对尿酸的重吸收,以促进尿酸排泄,特别适用于肾尿酸排泄减少的高尿酸血症和痛风患者。 对于有肾结石高危风险的患者不推荐使用,服用苯溴马隆时应注意大量饮水及碱化尿液。 轻中度肾损伤或 eGFR >60 ml·min-1·(1.73 m2)-1的患者无需调整剂量,常用剂量为50 mg/d,最大剂量为100 mg/d。不推荐eGFR <30 ml·min-1·(1.73 m2)-1的患者及泌尿系尿酸结石患者使用。
五、痛风急性发作期的抗炎镇痛治疗
各国指南、共识对痛风急性发作的抗炎镇痛治疗推荐意见基本相似,推荐尽早使用小剂量秋水仙碱或非甾体抗炎药(NSAID,足量、短疗程),对上述药物不耐受、疗效不佳或存在禁忌的患者推荐全身应用糖皮质激素(1B)。 对于严重的急性痛风发作[疼痛视觉模拟评分法(VAS)评分≥7 分]、多关节炎或累及≥2 个大关节者,建议使用2 种或2 种以上镇痛药物治疗[10],包括秋水仙碱与NSAID、秋水仙碱与口服糖皮质激素联合使用及关节腔糖皮质激素注射与其他任何形式的组合,由于NSAID 和全身糖皮质激素均会增加消化道溃疡的发生,本指南不建议二者联用。 本指南建议难治性痛风患者可使用聚乙二醇重组尿酸酶制剂、白细胞介素(IL)-1 或肿瘤坏死因子(TNF)-α 拮抗剂进行治疗,上述几种药物虽然在国内还未上市,但基层医生也需要了解。
秋水仙碱目前仍是痛风急性发作的一线用药,建议首次剂量 1 mg,1 h 后追加 0.5 mg,12 h 后改为 0.5 mg 每日 1 次或每日2 次。 eGFR 在 30 ~ 50 ml·min-1·(1.73 m2) -1 时应减量使用,eGFR <30 ml·min-1·(1.73 m2)-1时应禁用。
NSAIDs 首选起效快、胃肠道不良反应少的药物,老龄、肾功能不全、既往有消化道溃疡、出血、穿孔的患者应慎用,GFR<30 ml·min-1·(1.73 m2)-1时应禁用,建议使用选择性环氧化酶2(COX-2)抑制剂。 应警惕药物引起的肾损伤,注意充分水化,监测患者肾功能。
糖皮质激素在痛风急性发作期的镇痛效果与NSAIDs 相似,但能更好地缓解关节活动痛。 为防止激素滥用及反复使用增加痛风石的发生率,专家组将糖皮质激素推荐为二线镇痛药物,但对于慢性肾功能不全患者是一线用药。 建议口服泼尼松30 ~ 35 mg/d,共 3 ~5 d。
六、高尿酸血症与痛风患者有合并症时相关药物的选择推荐
高尿酸血症与痛风患者常合并有其他疾病,本指南根据近年来的循证医学证据对有合并症时相关药物的选择进行了推荐:(1)合并高血压时,建议降压药物首选氯沙坦钾和(或)钙通道阻滞剂(2C),不推荐噻嗪类和袢利尿剂等单独用于降压治疗(1C);(2)合并高三酰甘油血症时,调脂药物建议首选非诺贝特;(3)合并高胆固醇血症时,调脂药物建议首选阿托伐他汀钙(2B);(4)合并糖尿病时,建议优先选择兼有降尿酸作用的降糖药物,次选不升高血尿酸的药物(2C)。 目前已明确具有降尿酸作用的降糖药物主要有α-糖苷酶抑制剂、胰岛素增敏剂、二肽基肽酶4(DPP-4)抑制剂、钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂和二甲双胍等。 胰岛素可通过激活URAT1 促进肾近端小管对尿酸重吸收,导致血尿酸水平升高。
综上所述,本指南与我国当前国情相结合,提出了一些新的观点和推荐意见,尤其是3 项总则强调了终身治疗和监测、预防并发症的重要性,提高了基础医生和患者对高尿酸血症和痛风的认知。 部分临床医生关注的问题在本指南中因证据过少没有提及,如尿酸正常痛风患者的治疗、生殖期药物的安全性、非布司他在无症状高尿酸血症中的应用、痛风发作期降尿酸药物的治疗、痛风发作期的局部治疗问题、痛风发作的预测指标及预防用药选择的依据等,这些问题也是该领域未来的研究方向。
