PentaRay 电极高密度基质标测指导持续性心房颤动导管消融的疗效
2020-08-29李腾黄俊梁建宾武刚李超帆李宜富
李腾 黄俊 梁建 宾武刚 李超帆 李宜富
肺静脉电隔离(PVI)是导管消融治疗心房颤动(简称房颤)的基石[1],而逐级消融法[2]和两圈三线(2C3L)法[3]是国内主要应用于持续性房颤的消融策略。 STAR AF Ⅱ研究等尚未能证实肺静脉外消融可为持续性房颤患者带来获益[4],但并不代表持续性房颤仅需PVI 就足够。 明确窦性心律下的异常心房基质并进行个体化改良治疗为持续性房颤的消融策略之一[5-7],而心房异常基质主要通过高密度标测技术确定。 我们的前期研究发现持续性房颤患者左心房电压明显降低且传导缓慢,个体化消融的成功率与国内外主流术式相似[8-9]。 PentaRay 电极是近年来进入临床的高密度多极标测导管,明显优于临床广泛应用的环状导管。 因此,我们采用PentaRay 电极对心房基质进行更加高密度标测以深入探讨持续房颤个体化消融策略。
对象与方法
1.对象:2017 年 1 月 ~2018 年 4 月于我院住院并接受导管射频消融的持续性房颤患者60 例。 纳入标准:(1)使用至少1 种抗心律失常药物(AAD)治疗无效的症状性持续性房颤患者;(2)年龄18 ~75 岁;(3)房颤持续时间≥7 天。 排除标准:接受过导管消融或心脏外科手术;严重冠心病或心脏瓣膜疾病;严重结构性心脏病;左心房血栓;左心室射血分数(LVEF) <35%;左心房内径(LAD) > 50 mm。 将患者以 1 ∶1 比例随机分为PVI 加左心房电压基质指导消融组(观察组,30 例)和PVI 加 2C3L 线性消融组(对照组,30 例),其中观察组男23 例,女7 例,年龄26 ~73 岁,平均年龄(57 ±10)岁;对照组男20 例,女 10 例,年龄 33 ~74 岁,平均年龄(59 ±11)岁。 本研究经我院伦理委员会审核批准,所有患者均签署知情同意书。
2.方法
(1)标测和消融方法:术前所有患者均停用所有AAD 至少5 个半衰期,术前行经食道超声心动图(TEE)或左房-肺静脉CT 排除左心房血栓。 所有患者均经下腔静脉置入可调弯冠状窦电极(美国波科公司)。 观察组患者在完成房间隔穿刺后行同步电复律,剔除3 次电复律不成功和不能维持窦性心律完成标测的患者,转律成功后,在三维标测系统(Carto 3,美国强生公司)结合Confidence 软件自动标测辅助下,应用PentaRay 电极(美国强生公司)完成左心房电压基质标测。 自动标测必须满足以下条件:导管稳定性、心率稳定性(周长)、压力稳定性(压力导管)及局部激动时间稳定性。 低电压区(LVA)定义为双极电压<0.5 mV,瘢痕定义为双极电压<0.1 mV。 应用压力监测消融导管(SmartTouch,美国强生公司)完成消融。 观察组患者完成左心房基质标测后行双侧PVI,若消融前标测到LVA 则继续行个体化左心房基质改良消融,具体策略参考既往文献[8-10]。 对照组患者首先完成双侧PVI 及左心房顶部线、二尖瓣峡部(MI)和三尖瓣峡部(CTI)线性消融,转复窦性心律后验证消融线双向阻滞。 消融参数设置:预设功率25 ~35 W、温度43 ℃、盐水灌流速度17 ml/min、后壁所用功率≤30 W、压力5 ~20 g、每点消融时间 30 ~60 s。
(2)随访:分别于术后第 1、3、6 和 12 个月进行随访,内容包括临床表现、超声心动图、24 h 动态心电图,此外有症状患者随时复查心电图。 主要终点:心电图、24 h 动态心电图或长程心电记录仪记录到>30 s 的房性心律失常。 手术时间定义为静脉穿刺开始至拔除鞘管时间;消融时间为累积消融时间;射线时间为累积X 线曝光时间。
3.统计学处理:应用SPSS 16.0 软件进行统计分析。 计量资料以表示,两组间比较采用独立样本t检验或Fisher确切概率法;计数资料以例数和百分比表示,两组间比较采用χ2检验。 采用Kaplan-Meier曲线分析两组患者的预后。 以P<0.05 为差异有统计学意义。
结 果
1.两组患者一般临床资料比较:两组患者性别、年龄、合并疾病、LAD、左心室舒张末期直径(LVEDD)及LVEF 比较差异均无统计学意义(P>0.05),见表1。
2.两组患者导管消融相关资料比较:观察组患者的平均标测点数为(2 026 ±606)个,2 例(6.7%)患者标测到低电压区并完成片状消融;对照组行顶部线阻滞、MI 阻滞、CTI 阻滞患者分别为 29 例(96.7%)、22 例(73.3%)、27 例(90.0%)。 观察组患者手术时间和消融时间均明显短于对照组(P<0.001),而两组患者射线时间比较差异无统计学意义(P>0.05),见表2。 对照组2 例患者分别于MI 和CTI 消融时出现气体爆裂(POP),未发生心脏压塞。 观察组1 例(3.3%)患者出现右侧腹股沟血肿,对照组1 例(3.3%)患者出现假性动脉瘤合并动静脉瘘,均内科治疗后好转。
3.两组患者的随访结果比较:两组患者均平均随访12个月,Kaplan-Meier曲线分析结果显示,单次消融后研究组和对照组患者的窦性心律维持率分别为76.7%(23/30)、80.0%(24/30),差异无统计学意义(P=0.77),见图 1。 观察组 7 例患者复发[1 例房性心动过速(简称房速)、6 例房颤],其中3 例阵发性房颤患者服用AAD 治疗后无明显症状;对照组6 例患者复发(3 例房速、3 例房颤),3 例房速患者(1 例为 CTI依赖大折返房速,2 例均为MI 依赖大折返房速)均接受再次消融。 对照组1 例患者消融后因症状性窦性心动过缓植入双腔心脏起搏器。 两组患者消融后均未发生迟发心脏压塞和心房食管瘘等并发症。
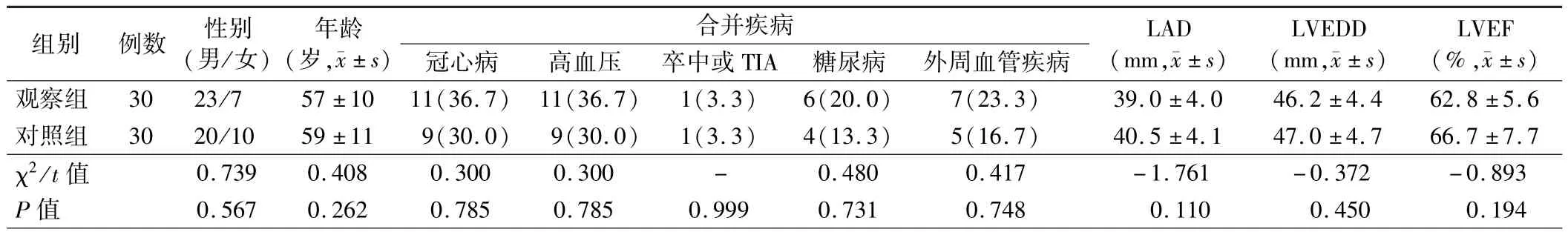
表1 两组患者一般资料比较[例,(%)]
表2 两组患者导管消融相关资料比较(min,)
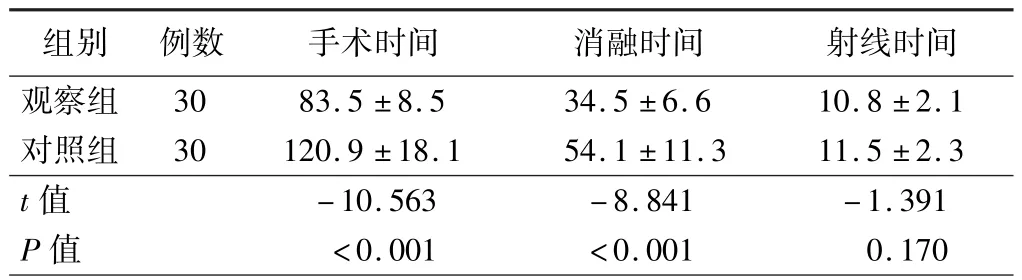
表2 两组患者导管消融相关资料比较(min,)
组别 例数 手术时间 消融时间 射线时间观察组 30 83.5 ±8.5 34.5 ±6.6 10.8 ±2.1对照组 30 120.9 ±18.1 54.1 ±11.3 11.5 ±2.3 t 值 -10.563 -8.841 -1.391 P 值 <0.001 <0.001 0.170
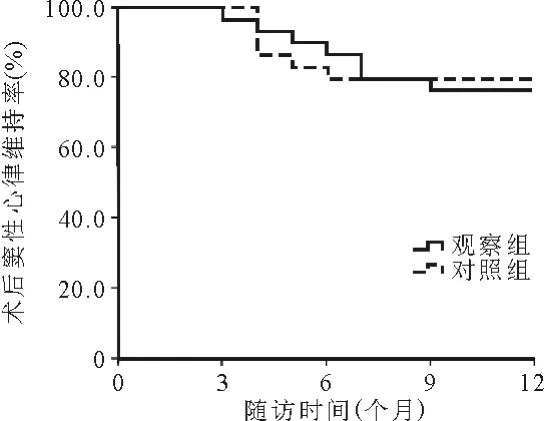
图1 消融后两组患者窦性心律维持率的Kaplan-Meier 曲线
讨 论
长期以来,学者们普遍认为持续性房颤消融仅行PVI是不够的,还需附加线性消融和(或)复杂心房碎裂电位消融[11]。 然而,附加消融明显延长手术时间,增加术后房速和严重并发症的发生率。 因此,对于持续性房颤患者,目前指南并不推荐经验性肺静脉外消融[1]。 本研究采用PentaRay 电极高密度标测,再一次验证了个体化左心房电压基质改良消融策略的优越性,该术式的成功率不低于国内主流术式,且手术时间和消融时间明显缩短,降低了手术风险。
目前临床应用于心房的多电极标测导管主要有环状电极、PentaRay 电极、网篮电极及HD Grid 电极。 网篮电极取点密度较高,但费用昂贵且操作难度较大,且标测三维系统不能兼容压力监测消融导管。 HD Grid电极可同时记录到32 个双极信号,能够更加真实有效和准确地识别电压区,但国内目前还未能将其应用于临床。 环状电极标测点数相对较少且密度较低,不能自动标测,大多数时候需要人工校正[9]。 PentaRay 电极可到达全心腔,配合confidence 软件能实现安全、精细标测,且解剖假腔少及人工校正少,显著优于环状电极。 本研究中,观察组标测点数较我们团队的前期研究[9]明显增多,LVA 的发生率仍相对较低。 Yagishita等[12]报道持续房颤患者的LVA 高达84%,但左心房基质标测是在房颤心律下进行的,研究结果争议较大。本研究中LVA 的发生率较低,考虑与患者房颤病程不长、危险因素少相关。 若能采取更高精密度网篮电极和HD Grid 电极进行标测,同时放宽患者入选标准,也许会进一步提高LVA 检测率,更多患者可能需要行左心房电压基质改良消融。
目前电压指导下的基质改良消融策略主要采用双极LVA 作为心房纤维化的电生理学替代指标并用以指导消融,但由于标测条件尚未统一,LVA 阳性率和面积在不同研究间差异很大,此外,LVA 是否等同于需要改良基质仍存在争议。 Rolf 等[6]发现基于LVA的个体化消融房颤患者的无房颤复发率明显高于仅行PVI 患者。 Jadidi 等[5]发现,对于持续性房颤患者,PVI加左心房LVA 消融优于PVI,而PVI 仅适用于左心房LVA(房颤状态下标测) <10%的患者。 Meta 分析结果表明,PVI 加LVA 改良消融的无房颤复发率高于PVI 和PVI 加经验性消融,且术后房速的发生率更低,显著缩短了手术时间、射线时间及消融时间[11]。 本研究中,对照组术后房速的发生率明显高于观察组,考虑与附加线性消融相关。 大部分附加线性消融并非呈真正连续的线性关系,可能残留缝隙缓慢传导,此外,MI和CTI 内膜面并非光滑平整,相比肺静脉前庭消融更难达到有效的透壁损伤,尤其是MI 消融双向阻滞的难度及风险更大,且术后峡部传导恢复率较高,因此容易发生缓慢传导所介导的微折返和大折返房速。 本研究中观察组术后房颤的发生率相对较高,而房速的发生率相对较低,考虑与肺静脉传导恢复和无附加线性消融相关。 因此,附加线性消融可能因消除了房颤的基质从而降低房颤复发,但其也可能形成房速发生的新基质。 虽然本研究结果尚未明确个体化消融策略明显优于PVI 加经验性线性消融,但术后房速的发生率低且手术时间明显缩短,因此不推荐经验性肺静脉外消融,需要标测结果作为支持。 虽然本研究中极少患者需要心房基质改良消融,但不能提示持续性房颤患者只需PVI 就足够。 因此广大电生理学者仍在不断探索持续性房颤的新消融策略,包括非肺静脉触发灶、转子和局灶性激活标测、疤痕基质、Marshall 静脉和心外膜等标测消融及高功率消融、脉冲电场消融。
本研究结果提示,持续性房颤个体化消融方法以PVI 为基础,然后根据PentaRay 电极标测的基质结果制定后续消融策略具有重要意义。 但本研究的样本量较小且来自单中心,仍需大规模随机对照研究进一步证实心房电压基质指导个体化消融的安全性和有效性以及是否适合所有持续性房颤患者。 综上所述,对于持续性房颤,通过PentaRay 电极对心房基质进行更加精确的标测定位,个体化消融策略的消融成功率与主流术式相似,且显著缩短了手术时间和消融时间。
