不同来源血清对体外培养驴巨噬细胞的影响
2020-08-28梁巩张强郭旭川陈慧飒王艳萍曾维斌
梁巩 张强 郭旭川 陈慧飒 王艳萍 曾维斌


摘要:为比较驴血清和胎牛血清对体外培养驴巨噬细胞的影响,采用含10%驴血清或胎牛血清的培养液进行驴巨噬细胞培养的对比试验,分别在培养的1、4、7、10 d时观察细胞的生长状况,并用MTT法通过细胞吸光度检测细胞活力;培养后4 d采用流式细胞仪检测巨噬细胞的纯度。结果表明,含10%驴血清培养液培养的驴巨噬细胞的分化能力优于胎牛血清;培养后1、4 d时,2种血清对巨噬细胞活力的影响没有显著差异,但培养后7、10 d,驴血清组的细胞活力显著(P<0.05)或极显著(P<0.01)高于胎牛血清组;培养后4 d,2组试验中巨噬细胞的纯度分别为(92.72±0.45)%和(81.16±2.13)%。综上,驴血清组培养的巨噬细胞其分化能力、活力和纯度均优于胎牛血清组,故更适合用于驴巨噬细胞的体外培养。
关键词:驴;MTT法;同源血清;异源血清;巨噬细胞;分化能力;活力;纯度;体外培养
中图分类号:S822.1 文献标志码: A文章编号:1002-1302(2020)13-0072-04
收稿日期:2019-07-30
基金項目:国家自然科学基金(编号:31760643);石河子大学高层次人才科研启动项目(编号:RCZX201501);新疆生产建设兵团塔里木畜牧科技重点实验室开放课题(编号:HS201504)。
作者简介:梁巩(1993—),男,新疆且末人,硕士研究生,研究方向为动物繁殖与生物技术。E-mail:2731327322@qq.com。
通信作者:曾维斌,副教授,研究方向为动物繁殖与生物技术。E-mail:zwbdky@126.com。血清支持细胞生长及繁殖的能力是在细胞培养过程中评价血清质量的重要指标之一,血清的选择对于细胞的培养有非常重要的意义[1]。血清中由于含有多种促细胞生长的营养成分及细胞因子,因此成为体外细胞培养液中的常用添加成分,其对细胞的培养意义重大。细胞培养液中,常用的血清主要来源于牛、猪、鸡等,其中胎牛血清因其获得量大、污染相对较小而得到广泛地应用,但不同来源的血清对不同的细胞培养效果各有差异[2-3],来自同种动物的同源血清体外培养的细胞,其分化能力与贴壁能力均显著优于异源血清培养的细胞,另外同源血清的应用可减少向培养液中添加较为昂贵的细胞生长因子[4-6]。
巨噬细胞作为重要的免疫细胞,是机体免疫反应的第1道防线[7-8]。它也参与稳态调节,包括纤维化、脂质代谢和组织重塑[9],巨噬细胞的分离与培养可为免疫学研究提供基础的细胞材料。目前,有大量试验对牛、鼠、猴等巨噬细胞进行研究[1,4,6],但有关驴巨噬细胞的分离及培养尚未见报道,因此本研究以驴外周血来源的巨噬细胞为试验对象,比较含10%驴同源血清与10%胎牛血清的细胞培养液对体外驴巨噬细胞培养的影响,以便建立一种体外培养驴外周血单核巨噬细胞的方法。
1材料与方法
1.1材料
1.1.1试剂淋巴细胞分离液、MTT试剂盒、青霉素链霉素混合溶液,均购自于Solarbio公司;DMEM培养基(Hyclone)、胎牛血清、0.25%胰蛋白酶消化液,均购自于Gibco公司;M、CD14抗体(美国BD公司)。
1.1.2试验动物新疆石河子大学试验站驴场体质量一致、体况较好的新疆母驴。
1.2方法
1.2.1驴血清的制备选择健康母驴3头,采用真空无抗凝剂采血管于颈静脉采集全血,室温静置 30 min,3 000 r/min离心10 min,取淡黄色上清液,采用0.22 μm滤菌器过滤除菌,56 ℃水浴15 min,最后冷冻保存于-20 ℃下。
1.2.2外周血单核细胞(PBMCs)的分离、培养将采集的全血用磷酸缓冲盐溶液(PBS缓冲液)等倍稀释混匀后,缓慢加到淋巴细胞分离液上层(两者的体积比为1 ∶1),1 800 r/min 离心30 min,采用移液器吸取血浆稀释液与淋巴细胞液中间的PBMCs层,将获得的PBMCs用PBS缓冲液等倍稀释混匀,1 000 r/min离心10 min,去除上清液,将沉淀的PBMCs再用PBS缓冲液洗1次,最后采用DMEM培养液清洗1次后将沉淀的PBMCs用培养液混匀,细胞计数器计算细胞的浓度,将PBMCs置于含10%驴同源血清或胎牛血清的DMEM培养液的96孔培养板中培养,约为1×105个/孔,4 h后吸弃细胞液,除去未贴壁细胞,在加入含血清的DMEM培养液继续培养并定时观察细胞形态。每隔2 d更换相对应的培养液。
1.2.3MTT法检测细胞的活力在巨噬细胞培养后1、4、7、10 d,吸弃细胞培养液,加90 μL新鲜含血清DMEM培养液,再加入10 μL MTT溶液,CO2培养箱孵育4 h,然后吸弃上清,加入110 μL甲臜(formazan)溶解液,置于摇床低速振荡10 min,然后采用酶联免疫检测仪测量各孔的吸光度(D490 nm)。
1.2.4巨噬细胞纯度的检测在细胞培养后4 d,吸除细胞培养液,用PBS缓缓冲洗2遍贴壁细胞;然后加入0.25%胰蛋白酶消化10 min,在倒置显微镜下观察细胞绝大部分悬浮收缩变圆后,分别加入对应的培养液终止消化;离心收集所有细胞,加 400 μL PBS缓冲液混匀,再加入CD14抗体15 μL(空白组未加),在4 ℃冰箱中避光孵育30 min,1 000 r/min 离心5 min弃液,再用PBS混匀、离心洗涤2次;最后每管加入PBS 400 μL重悬细胞后,采用流式细胞仪检测细胞的纯度(CD14表达阳性率)。
1.2.5数据分析采用SPSS 19.0软件的单因素方差分析对数据进行统计学处理,所有试验至少重复3次,结果采用“平均值±标准差”表示,P<0.05或P<0.01分别表示数据间差异显著或极显著。
2结果与分析
2.1不同血清对细胞生长形态的影响
由图1可知,在显微镜下观察发现,培养1 d时2组细胞形态均为颗粒状且数量很多。在细胞培养后4 d,胞体明显增大,细胞已经出现分化,胞体由颗粒状向长梭状或不规则形状生长,眼观2组间无太大差异。然而在培养后7 d,2组均可见伪足出现(箭头所指方向),且驴血清组的分化能力优于胎牛血清组,另外2组细胞数量相比于培养后1 d明显减少。在细胞培养后10 d,驴血清组的分化更加成熟,但胎牛血清组中的细胞无论是分化能力还是数量均在下降。
2.2不同血清对细胞活力的影响
由图2可知,经MTT法检测,随着培养时间延长,2组的细胞活力均在逐渐降低。培养后4 d的2组细胞活力均显著低于培养后1 d的细胞活力(P<0.05),且胎牛血清组在培养后1、4、7、10 d的细胞活力均有显著差异(P<0.05)。
培养后1、4 d,2组的巨噬细胞活力没有显著差异,但在培养后7、10 d,驴血清组的细胞活力均显著(P<0.05)或极显著(P<0.01)高于胎牛血清组。
2.3驴巨噬细胞纯度的检测
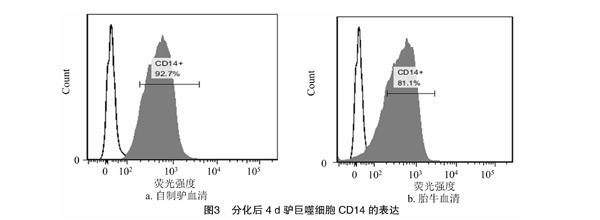
由图3可知,采用含10%驴同源血清、胎牛血清培养的驴巨噬细胞4 d CD14表达阳性率分别为(92.72±0.45)%、(81.16±2.13)%,驴同源血清培养的驴巨噬细胞 CD14表达阳性率显著高于胎牛血清培养的驴巨噬细胞。
3讨论与结论
巨噬细胞在炎症反应和宿主防御中发挥核心作用,促进先天免疫的建立,所以它得到了广泛研究[7-9]。分离培养单核巨噬细胞的方法多种多样,如从骨髓、腹腔、外周血中均可成功地分离培养巨噬细胞[10-12]。从外周血中分离出来的单核细胞具有很强的贴壁能力,而且容易在体外诱导分化为单核巨噬细胞。这种通过外周血单核细胞分化的巨噬细胞已被广泛用于科学研究工作中,是一种普遍被科研工作者接受的原代巨噬细胞模型。杨菲菲
利用不同仔猪血清浓度体外培养金华猪細胞表明,在10%仔猪血清浓度培养的细胞其传代活力强、增殖迅速,含10%血清浓度的培养液更适合原代细胞的培养[13],因此本试验采用含10%血清浓度的培养液培养细胞。体外培养恒河猴外周血单核巨噬细胞时发现,猴同源血清优于胎牛血清[6],贴壁细胞分化能力更强,胞体由颗粒状向长梭状或不规则形状生长,胞体由颗粒状逐渐伸出伪足,说明该方法培养的巨噬细胞已经具备了巨噬细胞的基本特征[14]。以上结论与本试验相一致,表明同源血清比异源血清更能诱导细胞的分化能力。可能由于血清内含有各种刺激或抑制细胞生长因子,在一定程度上起着保持或改变细胞生物学特性的作用[15]。
细胞相对衰减是衡量血清相对促细胞生长作用的一种评价方法[16]。在研究其他外周血单核巨噬细胞体外培养时,细胞培养的前几天是细胞的适应期,细胞数量变化比较大。一方面,细胞从体外分离过程中受到损伤并且要适应新的环境,所以有大量的细胞死亡。另一方面,在换液的过程中淋巴细胞被洗弃了。因此,采用MTT法检测细胞活力时发现细胞活力逐渐下降,并且刚开始下降速度差异比较大[16-18]。沈前程等采用MTT法检测培养贴壁单核巨噬细胞的相对活力,结果显示,贴壁细胞体外培养72~120 h时,细胞数量相对稳定,组间差异不显著(P>0.05)[18]。本研究也采用MTT法检测驴巨噬细胞活力,结果表明,细胞在培养后4、7 d,两者差异不显著,因此可在细胞培养后4~7 d这一相对平稳期开展后续的试验研究。
林炜明等在用10%人血清及人M-CSF培养人外周血巨噬细胞中发现,通过免疫磁珠分选后得到CD14的阳性率为85.5%[19]。尽管这些方法也能分离出巨噬细胞,但分离出来的成本更高,因此本试验采用同源血清进行培养,省去无需添加生长因子和免疫磁珠分选等步骤,采用流式细胞仪检测的单核巨噬细胞纯度为(92.72±0.45)%。猴巨噬细胞在培养后4、7 d的CD14细胞的阳性率分别为(91.7±2.33)%、(96.4±1.93)%[6],本研究结果与之相似,表明同源血清培养巨噬细胞是一种可行的方法。
综上所述,驴血清组培养的巨噬细胞的分化能力、活力和纯度均优于胎牛血清组,故更适合于驴巨噬细胞的体外培养,而究竟同源血清中哪几种成分起了重要的作用,还须作进一步相关试验研究。
参考文献:
[1]张宝红,钟恒禄,卢惠芳,等. 应用MTT比色法评价不同牛血清促细胞生长作用[J]. 中国畜牧兽医,2009,36(5):84-86.
[2]Yilmaz M,Ovali E,Akdogan E,et al. Autologous serum is more effective than fetal bovine serum on proliferation of bone marrow derived human mesenchymal stem cells[J]. Saudi Medical Journal,2008,29(2):306-309.
[3]宋珏,路通,谢林,等. 黄连解毒汤抗氧化作用的血清药理学研究[J]. 中国实验方剂学杂志,2010,16(4):118-122.
[4]王宵,黄国彪,陈俊,等. 不同同源血清对体外培养小鼠骨髓基质细胞的影响[J]. 广东药科大学学报,2018,34(5):618-622.
[5]傅欣,段小宁,张继英,等. 同源血清与胎牛血清培养兔关节软骨细胞的生物学特性[J]. 中国组织工程研究,2012,16(46):8599-8606.
[6]桑明,代明,周立,等. 恒河猴外周血单核巨噬细胞体外培养方法的建立[J]. 中国实验动物学报,2015,23(1):18-24.
[7]Wynn T A,Chawla A,Pollard J W. Macrophage biology in development,homeostasis and disease[J].Nature,2013,496(7446):445-455.
[8]Ginhoux F,Jung S.Monocytes and macrophages:developmental pathways and tissue homeostasis[J]. Nat Rev Immunol,2014;14(6):392-404.
[9]Morón-Calvente V,Romero-Pinedo S,Toribio-Castelló S,et al. Inhibitor of apoptosis proteins,NAIP,cIAP1 and cIAP2 expression during macrophage differentiation and M1/M2 polarization[J]. PLoS One,2018,13(3):e0193643.
[10]任凯夕,赵诣林,金超,等. 小鼠骨髓来源巨噬细胞体外培养及极化相关实验方法的建立[J]. 细胞与分子免疫学杂志,2013,29(3):310-313.
[11]吴春芳,刘崇武,游晓庆,等. 兔不同部位单核/巨噬细胞的分离、培养和鉴定[J]. 细胞与分子免疫学杂志,2011,27(5):576-578.
[12]杨志梅,符州,王莉佳,等. 人外周血单核巨噬细胞诱导、培养及鉴定[J]. 生物学杂志,2008,25(5):66-68.
[13]杨菲菲,屠平光,马美蓉,等. 不同仔猪血清浓度对金华猪耳缘组织成纤维细胞体外培养的影响[J]. 畜禽业,2018,29(9):5-6,8.
[14]Sha Z,Wang L,Sun L,et al. Isolation and characterization of monocyte/macrophage from peripheral blood of half smooth tongue sole (Cynoglossus semilaevis)[J]. Fish & Shellfish Immunology,2017,65:256-266.
[15]段小寧,张继英,傅欣,等. 应用同源血清培养大鼠关节软骨细胞生物学行为研究[J]. 中国运动医学杂志,2011,30(3):244-249.
[16]黄柏英,彭聪,祝和成. 应用MTT比色法评价新生小牛血清对培养细胞生长的影响[J]. 中南大学学报(医学版),2004,29(2):236-237.
[17]Jeanne M S,Kenneth W W,Tarwater P M,et al. SIV replication is directly downregulated by four antiviral miRNAs[J]. Retrovirology,2013,10(1):95.
[18]沈前程,林莹,王树艳,等. 水牛外周血单核巨噬细胞的培养与鉴定[J]. 中国畜牧兽医,2011,38(8):31-35.
[19]林炜明,戴爱玲,尹会方,等. 人外周血巨噬细胞培养及功能鉴定[J]. 中国免疫学杂志,2015(1):86-89.李倩,郭九峰,高海荣. 高压静电场胁迫对甘草生长过程中RNA的影响[J]. 江苏农业科学,2020,48(13):76-80.doi:10.15889/j.issn.1002-1302.2020.13.015
