ECMO救治心脏术后低心排综合征的临床疗效分析
2020-08-28温远祥许志锋吴永前郭荣龙
温远祥,许志锋,吴永前,郭荣龙
(北京大学深圳医院心血管外科,北京)
0 引言
低心排综合征也称为低心排出量综合征(Low Cardiac Output Syndrome,LCOS),指心脏术后各种原因导致的心脏泵血功能下降,导致机体组织灌注不足,出现多系统脏器功能不全综合改变,是心脏外科手术后较严重的并发症[1]。LCOS患者临床表现为心率加快、脉压差减小,血压下降,四肢血供不足、发冷,面色苍白或发绀,排尿量明显变少等症状,是造成患者心脏术后死亡的主要原因之一[2]。有数据显示,心脏外科术后LCOS发生率约为2%~6%,增加了术后死亡的风险,是临床治疗面临的巨大挑战[3]。体外膜肺氧合(ECMO)在心脏术后LCOS辅助治疗获得了良好效果,其原理是将静脉血引出进行气体交换后经离心泵加压后再泵入人体循环系统,提供呼吸循环支持,为后续心功能恢复赢得时间[4,5]。本研究回顾性分析 2015 年 1 月至 2019 年12月我院心血管外科18例LCOS应用ECMO救治患者,探讨ECMO在治疗LCOS的临床疗效。现将结果报道如下。
1 资料与方法
1.1 一般资料
纳入2015 年 1 月至 2019 年12月我院心血管外科18例LCOS应用ECMO救治的患者。纳入标准:①行心外科手术治疗术后出现LCOS,符合LCOS诊断标准;②行ECMO辅助支持治疗者。排除标准:①既往肝脏、肾脏其他重要脏器有器质性病变者;②既往合并呼吸系统疾病或肺癌者。本研究经医院伦理委员会批准,患者或家属均签订知情同意书。
18例 患 者,男 性10例,女 性8 例,年 龄42~76岁,平均(58.86±8.34)岁;心脏术前平均LVEF%为(48.67±10.03),辅助前乳酸值为(12.45±6.31)mmol/L。心脏瓣膜手术8例,大血管手术6例、冠状动脉旁路移植手术及其他手术4例,临床资料如表1所示。
1.2 ECMO设备与建立
通过股动静脉插管建立ECMO通路,应用改良 seldinger法行外周股静脉、股动脉穿刺置管,股动脉穿刺成功后应用2把progride血管缝合器预缝,股动脉、股静脉分别置入 18F和20F插管,股动脉远端常规置入6F灌注管增加下肢血供。ECMO由离心泵(Maquet,Jostra,德国)、膜式氧合器及肝素化管道(Medos,Lt7000,德国)、空氧混合器、股动静脉插管、变温水箱、氧饱和度监测仪等组成。
1.3 ECMO的管理
ECMO开机后,根据患者心率、血压及血流动力学参数调整泵流量,并保证动脉血氧饱和度>95%以上,气血流量比值维持在(0.6~0.8):1。采用持续机械通气,和同步间歇指令通气(SIMV)模式,FiO2:0.3~0.6,呼吸频率12-20次/mi,呼气末正压3~10H2O cm。辅助治疗期间,心脏超声评估患者心功能及血流动力学,同时配合影像学及血生化检查调整治疗。
1.4 ECMO的撤离
当患者心肺功能逐步恢复或心脏具有足够的射血功能,逐渐下调 ECMO流量,流量减到1-1.5L/min以下,同时适当延长ACT时间,维持数小时,待患者血流动力学稳定,氧合状况满意,生命体重平稳后即可考虑撤除。
1.5 统计方法
采用SPSS 21.0对数据进行统计分析。正态分布的计量资料结果采用(±s)表示,组间差异采用独立样本t检验分析,计数资料以(n/%)表示,组间比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 临床结果分析
18例患者中12例(66.67%)成功脱离ECMO支持,其中 8例(44.44%)存活出院,4例撤除ECMO后因严重并发症而死亡。无法撤除ECMO 6例患者中,4例因心功能无法恢复而撤机失败,2例因DIC严重渗血及多器官衰竭死亡。全部患者ECMO辅助时间、ICU住院时间及住院时间分别为(5.22±3.88)d、(13.26±6.14)d和(21.04±8.75)d,见表1。存活组患者ECMO辅助时间为(4.42±2.85)d,短于死亡组,ICU住院时间和住院时间为(14.74±4.86)d和(23.55±4.72)d,长于死亡组,但差异均无统计学意义。
表1 患者一般资料(±s,n)
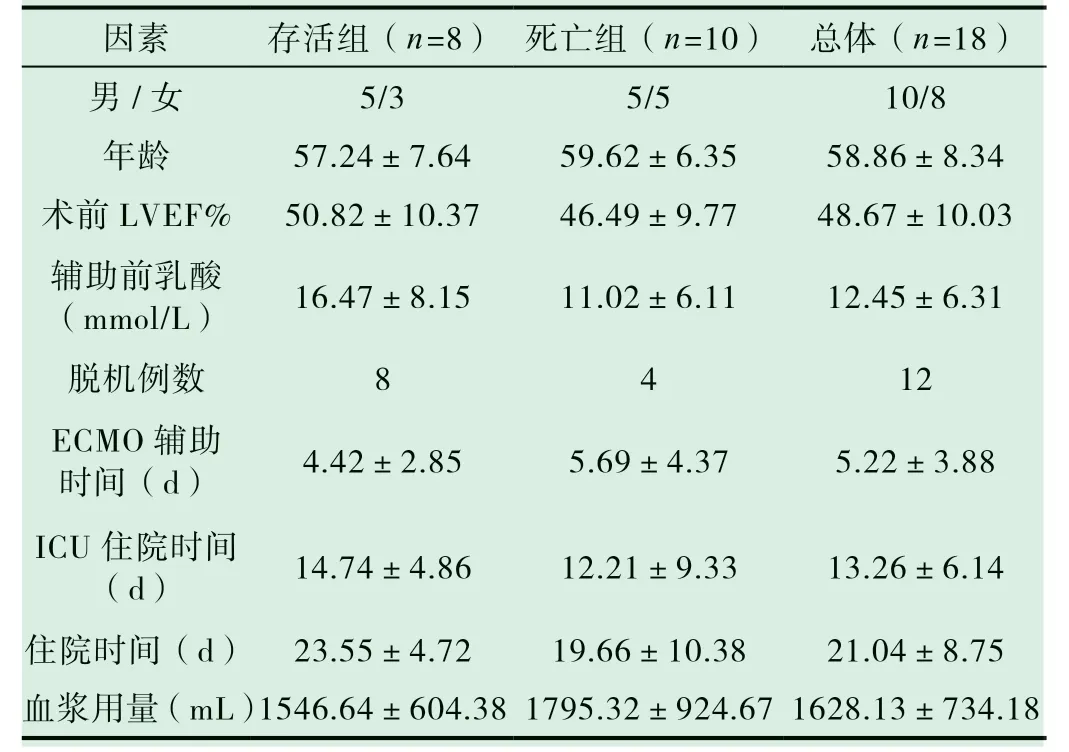
表1 患者一般资料(±s,n)
?
2.2 ECMO置管及术后并发症
所有VA ECMO患者均在监护室行股静脉-腋动脉插管,同时还进行了连续肾替代治疗(CRRT)。置管后,患者输血治疗情况表1所示。存活患者血浆用量(1546.64±604.38)mL,少于死亡患者(1795.32±924.67),但差异无统计学意义。
患者心脏手术方式不同导致术后并发症略有差异,具体见表2。7例EMCO患者发生出血,6例患者发生感染、2例患者出现下肢缺血。
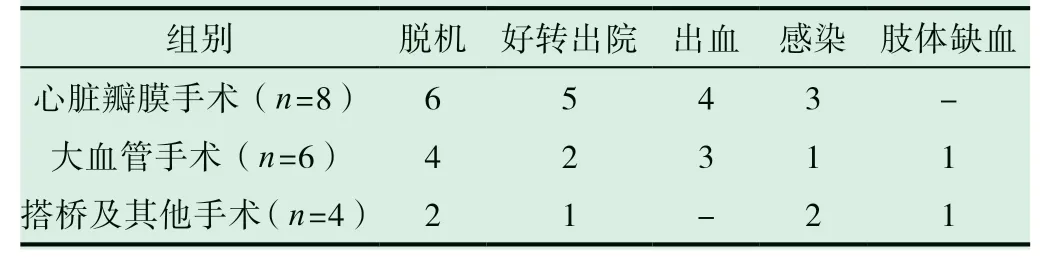
表2 术后并发症(n/%)
2.3 临床指标检测结果分析
存活组及死亡组患者血气PaO2、pH、总胆红素、ALT和BNP水平和死亡组患者比较,差异有统计学意义(P<0.05),PaCO2、乳酸、血红蛋白和肌酐水平在ECMO治疗后无统计学差异(具体见表3)。

表3 临床各指标检测结果
3 讨论
近年来,ECMO 作为一种机械性心肺辅助支持装置,逐渐应用于临床各种急危重症患者的抢救中,并取得良好疗效[6]。ECMO技术作为一项机械循环辅助装置,可提供双心室辅助、同时维持心肺功能,近年来在常规生命支持救治无效的危重心肺衰竭患者中应用逐渐增多。在无ECMO救治情况下,患者在心脏瓣膜置换术后一旦出现重度低心排综合征, 急性期死亡率高达75%[7],而临床研究表明 ECMO 辅助治疗可降低患者死亡率,为后续其他治疗赢得宝贵时间。
本研究中18例LCOS患者均应用VA ECMO 模式进行救治,12例(66.67%)患者成功脱机,其中8例(44.44%)患者存活出院,证实ECMO治疗在心脏术后可提高LCOS患者存活率,这和国内其他研究结果一致[4]。存活患者ECMO辅助时间短于死亡患者,说明存活患者恢复状态较好,EMCO辅助支持时间不长,死亡组患者由于心功能极差导致无法撤机,一直需要EMCO支持治疗,所以预后非常差。
本研究中18例患者行心脏瓣膜手术8例,大血管手术6例、冠脉搭桥及其他手术4例。手术方式的不同对ECMO结果也有影响:瓣膜置换术患者使用ECMO可有效改善心肌损伤,减轻右心负荷,泵血增加,因而有6例患者成功脱机,5例患者好转出院。但同时也存在出血和感染的风险,因此术后预防出血和抗感染治疗具有重要意义。大血管手术患者有4例成功脱机,2例好转出院;冠脉搭桥及其他手术2例成功脱机,1例好转出院,但术后患者发生出血、感染及肢体缺血等并发症。为预防出血,在ECMO等置管操作过程中,应把握好肝素用量,同时减少操作带来的损伤出血,必要时给予输血治疗,改善血液循环[8]。本研究中18例LCOS患者均进行了血浆输血治疗,增加机体灌注,减少远端肢体缺血的发生。
本研究对ECMO患者血气、乳酸、血红蛋白总胆红素、ALT、肌酐和BNP等指标进行了监测,发现存活组患者上述指标改善情况优于对照组,尤其是PaO2、pH、总胆红素、ALT和BNP水平显著低于死亡患者,这和国外学者研究相符[9,10],ECMO可有效增加血氧供应,减少乳酸、总胆红素、ALT等代谢的生成,缓解心肌损伤。
综上所述,ECMO为心脏术后逆转低心排量综合征的救治提供了可能,其置管时机的控制,保护性通气,监测血气、乳酸、心肌相关物质,有效控制、预防出血及抗感染是ECMO成功的关键。
