血浆miR-21、miR-155水平对胰腺癌的诊断价值
2020-08-27李昕冯瑾关兴
李昕 冯瑾 关兴


[摘要] 目的 研究胰腺癌患者血漿中微小RNA(miR)-21及miR-155的表达及其临床意义。 方法 选取2017年4月~2019年5月于河北省石家庄市第一医院就诊的88例胰腺癌患者作为胰腺癌组,50例慢性胰腺炎作为慢性胰腺炎组,50名健康体检者作为健康对照组。应用荧光定量PCR(qRT-PCR)检测三组血浆标本中miR-21、miR-155的表达,分析胰腺癌患者血浆miR-21、miR-155的表达与临床病理特征之间的关系,受试者工作特征曲线分析血浆miR-21、miR-155及两者联合检测对胰腺癌的诊断价值。 结果 胰腺癌组血清miR-21与miR-155表达均显著高于慢性胰腺炎组及健康对照组(均P < 0.05)。不同肿瘤分化、TNM分期胰腺癌患者血清中miR-21、miR-155的表达,差异均有统计学意义(均P < 0.05);不同性别、年龄、肿瘤直径、肿瘤位置、病理类型及是否伴淋巴结转移的胰腺癌患者血清中miR-21、miR-155的表达,差异均无统计学意义(均P > 0.05)。miR-21、miR-155联合检测的诊断价值高于任一单一指标(均P < 0.05)。 结论 胰腺癌患者血浆miR-21与miR-155表达升高,且两者表达与肿瘤病理分期、病理分级有关,联合检测血浆miR-21、miR-155在胰腺癌中具有较高的诊断价值。
[关键词] 微小RNA-21;微小RNA-155;胰腺癌;诊断
[中图分类号] R735.9 [文献标识码] A [文章编号] 1673-7210(2020)07(b)-0021-04
[Abstract] Objective To study the expression and clinical significance of microRNA (miR)-21 and miR-155 in plasma of patients with pancreatic cancer. Methods A total of 88 patients with pancreatic cancer treated in Shijiazhuang First Hospital from April 2017 to May 2019 were selected as the the pancreatic cancer group, 40 cases of chronic pancreatitis were treated as chronic pancreatitis group, and 40 healthy subjects were treated as healthy control group. Fluorescence quantitative PCR (qRT-PCR) was used to detect the expressions of miR-21 and miR-155 in plasma samples of the three groups, and the relationship between the expressions of miR-21 and miR-155 in plasma and clinicopathological features was analyzed in patients with pancreatic cancer. The subject operating characteristic curve was used to analyze the diagnostic value of plasma miR-21, miR-155 and the combined detection for pancreatic cancer. Results The expressions of serum miR-21 and miR-155 in the pancreatic cancer group were significantly higher than those in the chronic pancreatitis group and the healthy control group (all P < 0.05). The expressions of miR-21 and miR-155 in the serum of patients with different tumor differentiation and TNM stage pancreatic cancer were statistically significant (all P < 0.05). There were no statistically significant differences in the expressions of miR-21 and miR-155 in the serum of pancreatic cancer patients with different gender, age, tumor diameter, tumor location, pathological type or whether accompanied by lymph node metastasis (all P > 0.05). The diagnostic value of combined detection of miR-21 and miR-155 was higher than that of any single indicator (all P < 0.05). Conclusion The expressions of miR-21 and miR-155 are increased in patients with pancreatic cancer, and their expression is related to tumor pathological stage and pathological grade. Combined detection of plasma miR-21 and miR-155 has a high diagnostic value in pancreatic cancer.
[Keywords] MicroRNA-21; MicroRNA-155; Pancreatic cancer; Diagnosis
胰腺癌是我国癌症特异死亡的第六大原因,近年来胰腺癌发病率和死亡率逐漸增加,且预后较差,晚期肿瘤无法完全切除,5年生存率低于5%[1]。胰腺癌患者早期常无明显的临床表现,发现时已处于中晚期,丧失治疗的最佳时机,深入研究胰腺癌的发病机制并寻找早期诊断的血清标志物具有重要的临床意义。微小RNA(miRNA)是内源性的、小的非编码RNA。miRNA与靶基因信使RNA的特异性序列结合,改变信使RNA的稳定性抑制基因表达。较多证据显示,miRNA参与正常细胞的增殖、凋亡等生物学过程[2]。目前研究发现,乳腺癌[3]、非小细胞肺癌[4]等肿瘤中都存在miRNA的升高或降低异常表达的现象,通过影响下游癌基因的表达,改变肿瘤增殖、凋亡及浸润等行为。人类miR-21基因位于染色体17q23.1,研究发现[5]miR-21可通过促进转录因子Dp家族成员3的表达,导致复制起始因子和细胞周期分裂相关因子的表达上调,促进肿瘤细胞分裂及增殖等。miR-155基因位于人类染色体21q21.3,与基因表达的转录后调节有关。有报道显示[6]肿瘤细胞中miR-155表达上调,其可通过降低RhoA等基因信使RNA的稳定性,促进下游增殖等细胞信号通路传导,促进肿瘤进展。但目前miR-21、miR-155在胰腺癌血清中的表达尚不清楚,本研究通过检测胰腺癌患者血清中miR-21和miR-155表达及与临床病理特征的关系,探讨两者在胰腺癌诊断中的诊断价值。
1资料与方法
1.1 一般资料
选取2017年4月~2019年5月于河北省石家庄市第一医院(以下简称“我院”)诊断并治疗的88例胰腺癌患者作为胰腺癌组。其中,男51例,女37例;年龄40~72岁,平均(51.23±6.3)岁;肿瘤直径:≤2 cm者47例,>2 cm者41例;病理类型:腺癌59例,腺鳞癌29例;肿瘤TNM分期[7]:Ⅰ期34例,Ⅱ期39例,Ⅲ期15例;肿瘤分化:高分化20例,中分化33例,低分化35例;肿瘤位置:胰头部55例,胰体尾部33例;伴淋巴结转移47例,无淋巴结转移41例。选取同期于我院就诊的慢性胰腺炎患者为慢性胰腺炎组,其中,男28例,女22例;年龄41~71岁,平均(49.15±5.7)岁。另选取同期于我院参加健康体检者50名为健康对照组,其中男27名,女23名;年龄40~73岁,平均(48.67±6.2)岁。三组性别、年龄差异无统计学意义(P > 0.05),具有可比性。纳入标准:①经病理组织学检查,诊断为胰腺癌;②临床病理和随访资料完整;③本研究得到患者及家属的知情同意并签署知情同意书。排除标准:①合并细菌性感染、结核等感染性疾病;②有恶性肿瘤疾病病史;③合并严重的心肝肾等脏器功能不全;④有精神神经障碍性疾病;⑤有放化疗、免疫治疗史。本研究经我院医学伦理委员会审核批准,患者及家属均知情理解并签字。
1.2 方法
qRT-PCR检测血浆miR-21、miR-155的表达:留取各组清晨空腹静脉血5 mL,EDTA抗凝,4℃下1500 r/min,离心半径10 cm,离心10 min,将上清血浆移至EP管中,-70℃条件保存。取300 μL血样,Trizol法提取总RNA,总RNA溶于DEPC水,Narodrop检测其浓度及纯度。以1 μg总RNA为模板,进行反转录合成cDNA。得到cDNA产物后进行qRT-PCR反应,总反应体系20 μL,含模板cDNA 1 μL,Taq聚合酶0.15 μL、上游及下游引物1 μL、2×SYBR Green mix 10 μL及dNTPs 1 μL,DEPC水7 μL。条件:94℃ 2 min,94℃变性20 s,62℃退火30 s,70℃延伸10 s,共39个循环。miR-21的正向引物序列:5′-CGGCGGTTAGC-TTATCAGACTGA-3′,反向引物序列:5′-CCAGTGCA-GGGTCCGAGGTAT-3′,miR-155正向引物序列:5′-CGGCGGTTTAATGCTAATCGTGAT-3′,反向引物序列:5′-CATCACTCCAGGTGAACCCC-3′,内参基因U6正向序列:5′-GCTTCTTTGCAGCTCCTTCGT-3′,反向序列:3′-AGCGCAGCGATATCGTCATC-5′。结果用2-ΔΔCt法表示,miR-21、miR-155的相对表达量相对于内参基因U6的比值为2-ΔΔCt,ΔCt=Ct miR-21、miR-155-CtU6。
1.3 统计学方法
采用SPSS 22.0软件进行数据分析。计量资料用均数±标准差(x±s)表示,组间比较采用两独立样本t检验;计数资料用率(%)表示,组间比较采用χ2检验。受试者工作曲线(ROC)分析血浆miR-21、miR-155在胰腺癌中的诊断价值。以P < 0.05为差异有统计学意义。
2 结果
2.1 三组血浆中miR-21、miR-155表达比较
胰腺癌组血浆中miR-21的相对表达量为(3.834±0.932)明显高于慢性胰腺炎组的(1.128±0.276)及健康对照组的(0.826±0.203)(t = 17.973、20.155,P = 0.000、0.000);胰腺癌组血浆中miR-155的相对表达量为(5.120±1.312)明显高于慢性胰腺炎组的(0.427±0.121)及健康对照组的(0.817±0.241)(t = 22.531、20.543,P = 0.000、0.000)。见图1。
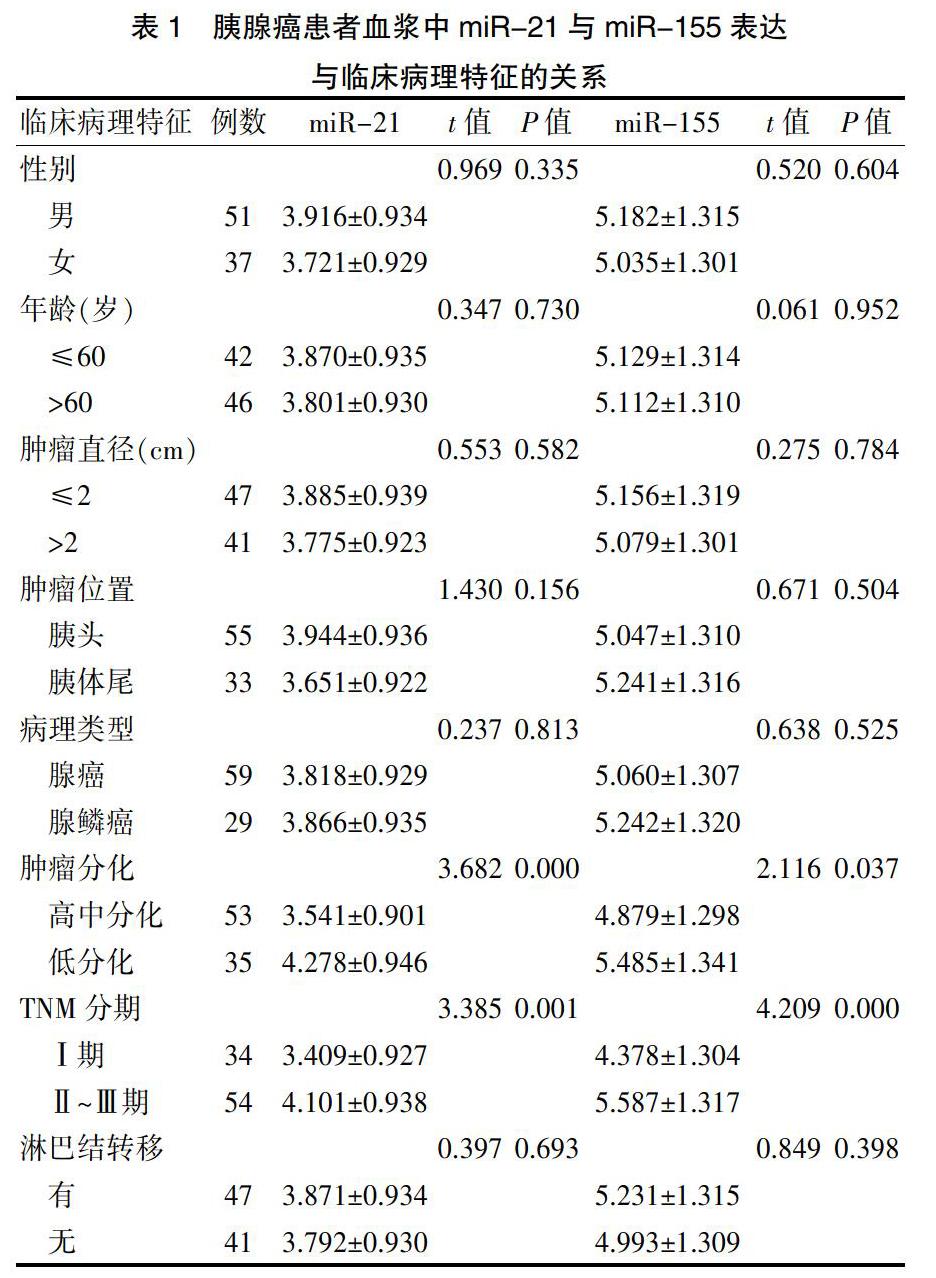
2.2 胰腺癌患者血浆中miR-21与miR-155表达与临床病理特征的关系
不同肿瘤分化、TNM分期胰腺癌患者血清中miR-21、miR-155的表达差异均有统计学意义(均P < 0.05);不同性别、年龄、肿瘤直径、肿瘤位置、病理类型及是否伴淋巴结转移的胰腺癌患者血清中miR-21、miR-155的表达,差异均无统计学意义(均P > 0.05)。见表1。
2.3 检测血浆miR-21、miR-155在胰腺癌中的诊断价值
miR-21、miR-155及联合检测的敏感性分别为78.5%、84.1%、92.2%,特异性分别为84.3%、83.7%、80.2%,準确度分别为90.5%、93.8%、97.0%,联合检测的敏感性及准确性高于单一指标。绘制miR-21、miR-155的ROC曲线,miR-21、miR-155及两者联合检测胰腺癌的曲线下面积分别为0.789、0.720及0.868,联合检测miR-21、miR-155诊断的诊断效能明显大于任一单一指标的诊断效能。见图2。
3 讨论
胰腺癌是常见的消化系统恶性肿瘤之一。胰腺癌解剖位置隐匿,手术治疗难度较大,术后肿瘤易发生局部复发及远处转移,患者死亡率较高,严重威胁人类健康[8-9]。目前胰腺癌的治疗包括手术治疗、放化疗、靶向治疗等,但治疗效果较差,5年总体生存率仅为5%[10]。因此,寻找早期诊断胰腺癌的血肿瘤标志物,早期积极治疗对延长患者生存预后时间具有重要临床意义。传统的用于胰腺癌的血肿瘤标志物如CA19-9等的敏感性和特异性不高,尚不能用于胰腺癌的早期诊断[11]。因此,有必要深入研究胰腺癌的分子机制。
miRNA是短的非编码RNA分子,在RNA聚合酶Ⅱ、Dicer核糖核酸酶作用下成熟,特异性识别结合靶基因,调控靶基因表达水平。有研究报道,乳腺癌[12]、非小细胞肺癌[13]等多种恶性肿瘤中,miR-21均异常表达升高,促进下游癌基因的表达,促进肿瘤细胞的增殖、浸润和转移的作用。本研究中,胰腺癌患者血浆中miR-21的表达明显上调。其机制可能是长链非编码RNA(LncRNA)MEG3对miR-21表达调控有关。有学者报道,LncRNA MEG3可作为分子海绵结合并抑制miR-21的表达,肿瘤细胞中LncRNA MEG3表达降低,导致LncRNA MEG3对miR-21表达抑制作用减弱,miR-21的表达升高[14]。此外,miR-21表达与肿瘤TNM分期、分化程度有关,其原因是miR-21抑制下游抑癌基因,如PTEN等的表达有关。研究报道,肿瘤中miR-21上调能直接抑制PTEN mRNA表达水平,促进肿瘤细胞的恶性增殖,导致肿瘤分期升高。而体外细胞实验中应用miR-21抑制剂显著上调PTEN表达,癌细胞的增殖、迁移和侵袭明显受到抑制[15]。此外,miR-21能够通过激活Akt信号通路的表达,促进肿瘤细胞E-钙黏素表达水平降低,而N-钙黏素等间质性表型表达增加,肿瘤分化程度降低[16]。
近年来研究发现[17],在肿瘤发生发展过程中,miR-155表达增加,通过抑制抑癌基因如PTPRJ的表达,发挥肿瘤促进的作用。本研究中,胰腺癌患者血浆中miR-155表达增加,其原因可能与肿瘤微环境中细胞因子促进miR-21的表达有关。研究显示,肿瘤微环境中转化生长因子-β1(TGF-β1)表达增加,能通过结合肿瘤细胞表面的TGF-β1受体,激活SMAD3、SMAD4等转录因子,进而促进miR-155的表达[18]。此外,不同肿瘤分期、肿瘤分化程度患者血浆中miR-155的表达水平具有明显差异。其机制可能与miR-155对糖原合酶激酶3β(GSK-3β)的表达调控作用有关。研究显示,miR-155表达增加后能够结合于GSK-3β的3′UTR区,促进GSK-3β的降解,导致Wnt/β-catenin信号通路的过度活化,引起肿瘤细胞发生局部浸润和远处转移,肿瘤分期分级升高[19-21]。本研究进一步探讨miR-21、miR-155及两者联合检测在胰腺癌中的诊断价值,结果显示血浆miR-21、miR-155联合检测与单一指标比较,具有较高的敏感性和准确性,且联合检测对胰腺癌诊断效能大于单一指标,提示联合检测血浆miR-21、miR-155对于胰腺癌患者具有较高的诊断价值,有助于提高胰腺癌早期诊断的准确性。
综上所述,胰腺癌患者血浆中miR-21与miR-155表达上调,miR-21与miR-155的表达与胰腺癌的肿瘤分期、肿瘤分化程度有关,联合检测血浆中miR-21、miR-155表达具有较高的敏感性和准确性,有望成为新的胰腺癌诊断的肿瘤标志物。
[参考文献]
[1] Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015 [J]. CA Cancer J Clin,2016,66(2):115-132.
[2] Zhang HD,Jiang LH,Sun DW,et al. The role of miR-130a in cancer [J]. Breast Cancer,2017,24(4):521-527.
[3] 董文珠,陈杭萍,陈赛贞,等.miRNA-628-3p调控乳腺癌细胞增殖的作用及机制研究[J].重庆医学,2019,48(18):3082-3086.
[4] 郭梦玲,王熙才,陈艳.miRNA在肺癌发生发展中的作用及其机制的研究进展[J].中国肿瘤生物治疗杂志,2019, 26(11):1281-1287.
[5] 苏俊玲,乌云,杨文静,等.miR-21通过负调节CYLD表达促进宫颈癌增殖[J].中国生育健康杂志,2019,30(6):534-540.
[6] Al-Haidari AA,Syk I,Thorlacius H. MiR-155-5p positively regulates CCL17-induced colon cancer cell migration by targeting RhoA [J]. Oncotarget,2017,8(9):14887-14896.
[7] 白雪莉,马涛,梁廷波.美国癌症联合委员会第8版胰腺癌分期系统更新简介及解读[J].中国实用外科杂志,2017,37(2):146-148.
[8] 孫玲,赵智强.84例中晚期胰腺癌的中医病机证素探析[J].国际中医中药杂志,2016,38(5):400-402.
[9] 张涛.中药单体及有效成分治疗胰腺癌的实验研究进展[J].国际中医中药杂志,2019,41(11):1270-1273.
[10] 张贤彬,董鑫,闫玉梅,等.手术联合辅助治疗与单纯手术治疗可切除胰腺癌临床疗效的Meta分析[J].中华消化外科杂志,2017,16(12):1222-1228.
[11] 秦牛,周鑫,杨晓俊,等.CA19-9及CA72-4联合检测在胰腺癌诊断中的应用价值[J].现代生物医学进展,2019,19(23):4463-4465,4495.
[12] 张波,邹莉.MiR-21对乳腺癌诊断价值的Meta分析[J].标记免疫分析与临床,2019,26(6):921-926.
[13] 陶新路,丁伯应.miR-21在非小细胞肺癌中的研究进展[J].世界最新医学信息文摘,2019,19(86):84-86.
[14] Wang P,Chen D,Ma H,et al. LncRNA MEG3 enhances cisplatin sensitivity in non-small cell lung cancer by regulating miR-21-5p/SOX7 axis [J]. Onco Targets Ther,2017,10:5137-5149.
[15] Xu J,Zhang W,Lv Q,et al. Overexpression of miR-21 promotes the proliferation and migration of cervical cancer cells via the inhibition of PTEN [J]. Oncol Rep,2015, 33(6):3108-3116.
[16] Liu CH,Huang Q,Jin ZY,et al. miR-21 and KLF4 jointly augment epithelial-mesenchymal transition via the Akt/ERK1/2 pathway [J]. Int J Oncol,2017,50(4):1109-1115.
[17] Zhang XF,Tu R,Li K,et al. Tumor Suppressor PTPRJ Is a Target of miR-155 in Colorectal Cancer [J]. J Cell Biochem,2017,118(10):3391-3400.
[18] Zhou X,Mao Y,Zhu J,et al. TGF-β1 promotes colorectal cancer immune escape by elevating B7-H3 and B7-H4 via the miR-155/miR-143 axis [J]. Oncotarget,2016,7(41):67196-67211.
[19] Wei RJ,Zhang CH,Yang WZ. MiR-155 affects renal carcinoma cell proliferation,invasion and apoptosis through regulating GSK-3β/β-catenin signaling pathway [J]. EurRev Med Pharmacol Sci,2017,21(22):5034-5041.
[20] Zhao J,Feng Y,Yan H,et al. β-arrestin2/miR-155/GSK3β regulates transition of 5′-azacytizine-induced Sca-1-positive cells to cardiomyocytes [J]. J Cell Mol Med,2014, 18(8):1562-1570.
[21] Feng Z,Xia Y,Zhang M,et al. MicroRNA-155 regulates T cell proliferation through targeting GSK3β in cardiac allograft rejection in a murine transplantation model [J]. Cell Immunol,2013,281(2):141-149.
(收稿日期:2019-11-28)
