营养缺陷型大肠杆菌高产L-苏氨酸的研究
2020-08-27周泉钱朱长俊杜雨桐罗奋杰钱广
周泉钱,朱长俊,杜雨桐,罗奋杰,钱广
(嘉兴学院生物与化学工程学院,浙江嘉兴 314001)
苏氨酸(Threonine)是一种重要的营养强化剂,有恢复人体疲劳、促进生长发育的效果。在医药上,由于苏氨酸的结构中含有羟基,对人体皮肤具有保湿作用,在体内还能促进磷脂合成和脂肪酸氧化。目前,生产L-苏氨酸的主要方法是大肠杆菌发酵法。草酰乙酸是L-苏氨酸的前体,而大肠杆菌的草酰乙酸主要来源于三羧酸循环[1],在此循环中天冬氨酰半醛(Aspartyl semialdehyde)和L-高丝氨酸(L-Homoserine)会分别生成副产物L-赖氨酸(L-Lysine)和L-甲硫氨酸(L-Methionine)。通过化学诱变后筛选出赖氨酸缺陷型大肠杆菌(Lys菌株)和赖氨酸、甲硫氨酸双重缺陷型[2]大肠杆菌(Met-Lys菌株),该菌株的L-赖氨酸和L-甲硫氨酸支路途径被阻断,干路途径的碳流量增加,从而使L-苏氨酸的产量增加。
1 材料与方法
1.1 实验材料
菌种:大肠埃希氏菌(Escherichia coli),本实验室保存。
试剂:按文献[3-4]配制5%(V/V)的硫酸二乙酯乙醇溶液(DES);pH=6.9磷酸缓冲盐溶液(PBS)0.100 mol/L;25%(V/V)硫代硫酸钠溶液;L-苏氨酸标准溶液1.630×10-4mol/L;四氯对苯醌乙醇溶液3.000×10-3mol/L;硼砂溶液0.100 mol/L。
器材:UV-1100紫外分光光度计,济南千司生物技术有限公司;SBA1243电子分析天平,哈尔滨德远科技开发有限公司;Eppendorf 5810R离心机,深圳市德优平科技有限公司。
1.2 实验方法
1.2.1 菌种活化及培养基种类
保存菌种进行划线分离,37 ℃恒温倒置培养24 h。
培养基种类:种子培养基;基本培养基;二倍氮源高渗培养基;赖氨酸补充培养基;甲硫氨酸、赖氨酸补充培养基;大肠杆菌发酵培养基[5]。实验流程图如图1所示。基本培养基、赖氨酸补充培养基及甲硫氨酸与赖氨酸补充培养基分别用MM、[Lys]、[Met、Lys]表示。
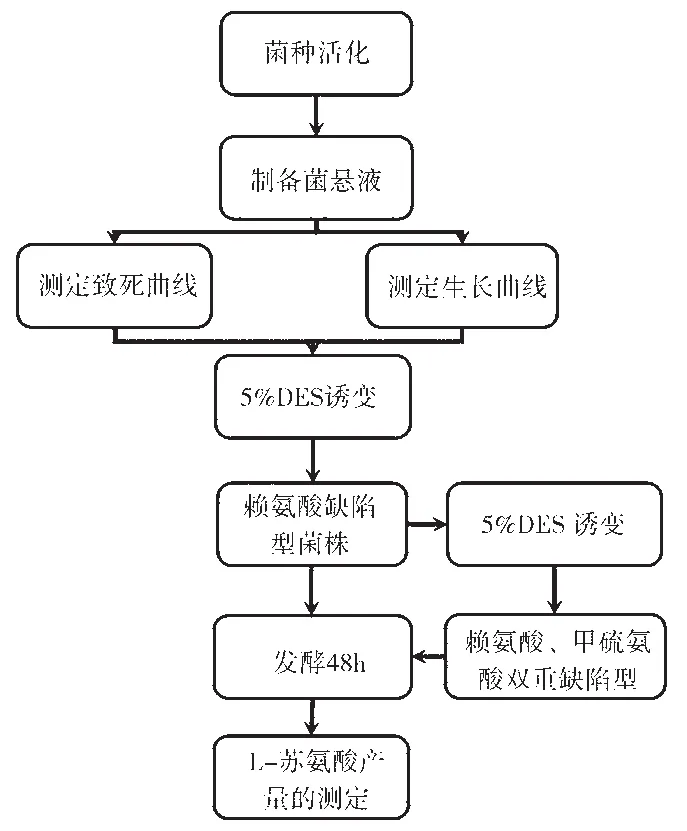
图1 实验流程图
1.2.2 测定生长曲线及致死曲线
取15个150 mL锥形瓶,按计划的培养时间长短分别编号为 0、1、2、3、4、6、8、10、12、14、16、18、20、24、K(K为空白对照组,其余编号数字代表培养小时数)。每个锥形瓶中加入20 mL肉汤培养基,并按1%接种量接种0.2 mL种子液;K组和“0”组接种完成后立即于600 nm处测定吸光度并记录数据,其余组37 ℃、180 r/min恒温震荡培养,相应时间到达后取出测定吸光度,处理数据并绘制生长曲线图[6]。
取11组1.5 mL的EP管,分别添加不同量的5%DES(0~100 μL,以10 μL的量递增),并用PBS定容至1.5 mL,诱变时长为15 min(从加入5% DES起到加入25%硫代硫酸钠溶液终止),取1.0 mL处理液加入1.0 mL 25%(V/V)硫代硫酸钠溶液终止诱变,然后各组取0.1 mL涂布于肉汤固体培养基上,3个平行,37 ℃倒置培养12 h,菌落计数,绘制致死曲线,计算公式如式1所示。

1.2.3 菌种诱变
Lys菌株的诱变:采用30 μL/mL菌悬液的比例进行诱变,诱变时长为15 min,诱变结束按照5%的接种量,移取2.5 mL处理液接种至50 mL[Lys]液体培养基中,37 ℃、180 r/min培养24 h,然后制成同体积的菌悬液。Met-Lys菌株的诱变过程同上,扩增培养的培养基改为50 mL[Met、Lys]液体培养基[7]。
1.2.4 筛选目标菌株
取0.1 mL经淘汰、纯化后的菌悬液涂布于[Lys]平板,涂布6个平板;37 ℃倒置培养24 h。从[Lys]平板上挑取72个菌落,对应点植至MM平板和[Lys]平板上;经培养后挑取在[Lys]平板上生长情况比MM平板好的菌株作为疑似菌株。将其编号,进行复检,分别在[Lys]平板和MM平板上进行划线,连续培养5代,比较第5代的菌株在[Lys]平板与MM平板上的生长情况,若[Lys]平板上的菌株生长情况比MM平板的好,则说明该菌株是可以稳定遗传的Lys菌株。
Met-Lys菌株的筛选:除涂布平板进行相应的变化,大致过程同上,获得稳定遗传的Met-Lys菌株。
1.2.5 发酵及L-苏氨酸产量的测定
按照5%的接种量分别将普通大肠杆菌、赖氨酸缺陷型和赖氨酸、甲硫氨酸双重缺陷型大肠杆菌的菌悬液接入20 mL发酵培养基中,每组3瓶,37 ℃、180 r/min培养48 h[8-9]。发酵结束后,将发酵液4 000 r/min离心20 min,取上清液稀释500倍,准确移取1.0 mL稀释液置于10 mL容量瓶中,加0.5 mL硼砂溶液(0.100 mol/L)和1.5 mL四氯苯醌溶液(0.003 mol/L),用蒸馏水稀释至刻度,摇匀,置50 ℃水浴40 min,水流冷却至室温,以相同方法制备试剂空白为参比,石英比色皿在352 nm处测吸光度A,求出L-苏氨酸的含量[10-12]。
2 结果与分析
2.1 大肠杆菌生长曲线和5% DES致死曲线的测定
由图2可知,实验室保存大肠杆菌在2 h内生长缓慢,2~6 h为对数生长期。5% DES对大肠杆菌具有很强的致死作用,如图3所示,添加量为30 μL时,致死率达到71.03%;添加量为50 μL时,致死率接近100%。在菌种的DES诱变过程中,要求致死率为70%~80%是最佳的诱变条件,因此,选取30 μL作为5% DES的添加量,进行大肠杆菌的菌种诱变。
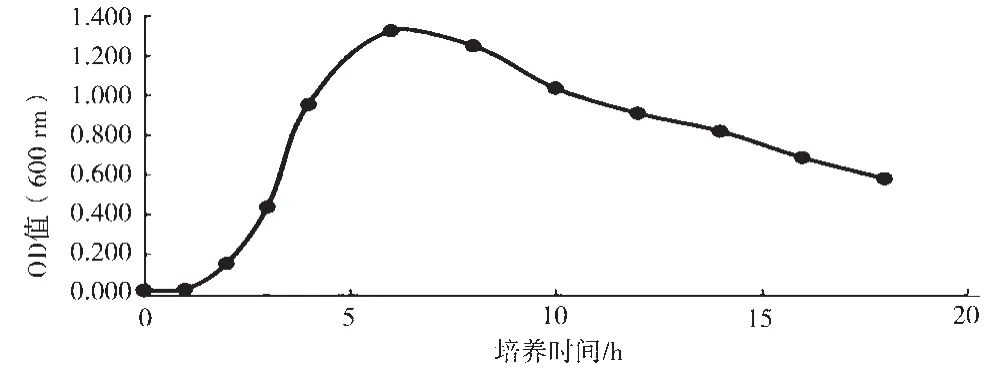
图2 大肠杆菌生长曲线图
2.2 营养缺陷型菌株的筛选
根据不同平板上菌落的生长情况可以初步筛选出疑似Lys菌株和Met-Lys菌株,然后进行下一步检测,初筛结果如图4所示。圈出的菌落在第2排的平板上的生长情况均比第1排的平板要好,因此可知圈出的菌落为疑似营养缺陷型菌株。
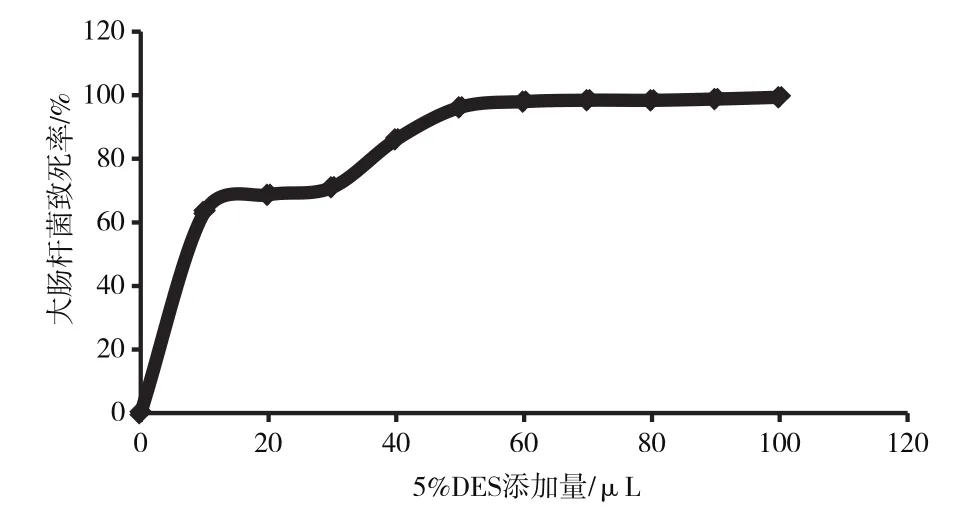
图3 大肠杆菌5% DES致死曲线图
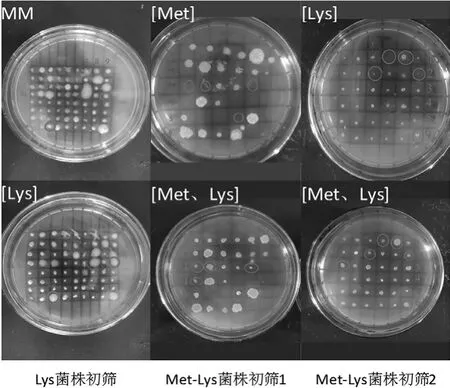
图4 营养缺陷型菌株的初筛结果
2.3 营养缺陷型菌株的复检
如图5所示,通过比较不同平板上疑似菌株的生长情况,可以发现营养缺陷型菌株在营养补充型培养基上的生长情况比MM培养基上要好的多,由此便可以确认筛选出了营养缺陷型菌株。

图5 营养缺陷型菌株的复检结果
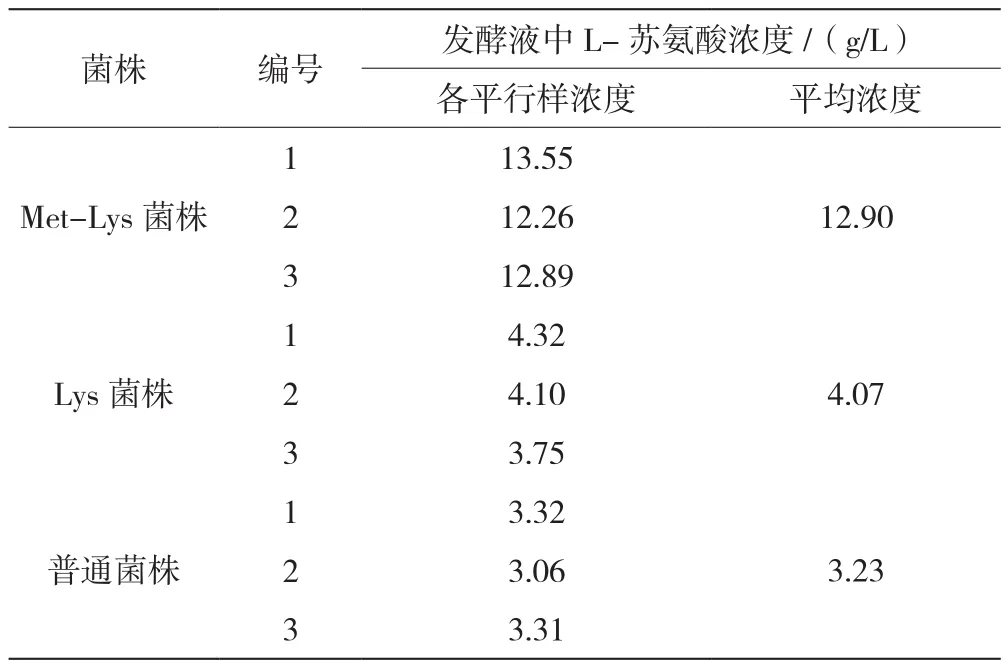
表1 营养缺陷型菌株与普通大肠杆菌菌株的L-苏氨酸产量
2.4 营养缺陷型菌株稳定性检测
连续培养5代后,可以发现Lys菌株和Met-Lys菌株都能较好地稳定遗传。
2.5 L-苏氨酸产量测定
如表1所示,Lys菌株的L-苏氨酸产量比普通大肠杆菌增加了26.01%,达到了4.07 g/L;Met-Lys菌株比普通菌株增加了299.38%,达到了12.90 g/L。结合胡丹等人[13]的研究发现,此次诱变出来的Met-Lys菌株比其使用的工程菌L-苏氨酸的产量(1.80 g/L)提高了6.17倍。
3 结论
赖氨酸缺陷型大肠杆菌和赖氨酸、甲硫氨酸双重缺陷型大肠杆菌均可以有效提高L-苏氨酸的产量,赖氨酸缺陷型大肠杆菌的L-苏氨酸产量比普通大肠杆菌增加了26.01%;赖氨酸、甲硫氨酸双重缺陷型大肠杆菌比普通大肠杆菌增加了299.38%。虽然选育出的单一营养缺陷型的突变株可以有效提高L-苏氨酸的产量,但是与双重突变株相比仍然存在一定的差距。本实验仅是通过化学诱变选育了双重营养缺陷型突变株,从而提高L-苏氨酸产量。接下来的研究可通过改变发酵条件或是加快L-苏氨酸的胞外分泌速度减弱L-苏氨酸反馈抑制,来进一步提高L-苏氨酸的产量。
