BALB/c裸鼠与BALB/c小鼠腹腔巨噬细胞吞噬功能的比较
2020-08-27严朗侍雯婧田逸君张吉芊竹陈基快
严朗,侍雯婧,田逸君,张吉芊竹,陈基快
(中国人民解放军海军军医大学海军医学系卫生毒理学教研室,上海 200433)
小鼠是目前最为常用的实验动物,其中的免疫缺陷小鼠,如BALB/c裸鼠和重症联合免疫缺陷(severe combined immunodeficiency,SCID)小鼠广泛应用于人类肿瘤研究中[1]。BALB/c裸鼠是先天性胸腺缺陷的突变小鼠,由于第Ⅷ连锁群内裸体位点基因发生纯合而形成,其特点是T细胞免疫功能缺陷,无接触敏感性和移植排斥反应,广泛用于免疫学、肿瘤学和疾病发生机理的研究[2]。已有不少研究表明BALB/c裸鼠T细胞明显减少或缺失,B淋巴细胞正常,但功能欠正常,免疫球蛋白主要是IgM,只含少量IgG[3]。然而BALB/c裸鼠的巨噬细胞吞噬功能尚不明确。
巨噬细胞是参与体内组织防御的一群重要的免疫细胞,一方面可以利用吞噬作用来清除外来病原体和自身细胞碎片,另一方面可以激发获得性免疫反应[4]。传统观点认为,巨噬细胞作为机体固有免疫细胞,具有抑制肿瘤生长的作用。但是最近研究表明,参与构成肿瘤微环境的巨噬细胞(Tumor-associated macrophage,TAM)具有促进肿瘤生长、侵袭、转移和耐药等作用[5]。BALB/c裸鼠作为肿瘤研究的重要工具鼠,明确其巨噬细胞的功能对于肿瘤发生发展、干预与预防研究至关重要。
本研究通过比较BALB/c裸鼠及野生型BALB/c小鼠两种不同品系的小鼠腹腔巨噬细胞吞噬功能,探讨两种不同小鼠巨噬细胞的功能,为后续裸鼠荷瘤实验结果分析提供理论参考。
1 材料和方法
1.1 试验材料
雄性6周龄SPF级BALB/c裸鼠和BALB/c小鼠各6只,体重18~20 g,购于上海斯莱克实验动物有限公司[SCXK(沪)2017-0005],饲养于海军军医大学实验动物中心SPF动物房[SYXK(沪)2017-0004]。所有小鼠饲养于12 h/12 h光照/黑暗条件下,自由采食和饮水,所有操作均符合海军军医大学实验动物伦理学要求(审批号:20180056)。
1.2 试剂与仪器
牛血清白蛋白BSA(上海生工生物有限公司,B600036-0250),RPMI1640培养基(Hyclone,SH30256.01),胎牛血清(Gibco,10099-141),磷酸缓冲液PBS(Hyclone,SH30256.01),青霉素、链霉素(Gibco,15140-122),巯基乙醇酸钠(Merck,1.08191.0500);FITC RAT IgG2a,Ctrl(400505),FITC F4/80(123107),™ Red ;荧光倒置显微镜(日本OLYMPUS,IX71),流式细胞仪(美国Beckman,CytoFLEX),小动物麻醉机(上海玉研科学仪器有限公司,ABS型),多功能酶标仪(美国Molecular Devices,SpectraMaxM2e)。
1.3 试验方法
1.3.1 小鼠腹腔巨噬细胞提取和培养
在实验前3天每天腹腔注射3%巯基乙醇酸钠(2 mL/只),用异氟烷麻醉小鼠,颈椎脱臼法处死小鼠,75%酒精浸泡1~2 min后在超净台中暴露出腹膜,用移液器吸5 mL无菌PBS液注入腹腔中,同时从两侧用手指揉压腹膜壁,吸取腹腔中液体入离心管内,4℃、1 000 r/min离心5 min,弃去上清液,重复2次,加入完全培养液(90% RPMI1640培养基+10%FBS+1%双抗)重悬。调整浓度至2×105个/mL,接种到6孔板中,每孔2 mL。5% CO2温箱孵育4 h后,换液,并用RPMI1640培养基洗1~2次,弃去未贴壁细胞,贴壁细胞为单层的巨噬细胞。
1.3.2 巨噬细胞流式细胞术鉴定
吸掉培养基,PBS洗1次,利用细胞刮收集巨噬细胞,吹打均匀后将细胞悬液分为两管,1号管为阴性对照,1∶300加入FITC RAT IgG2a,κisotype Ctrl,2号1∶300加入FITC anti-mouse F4/80抗体,避光、常温标记30 min,然后用流式缓冲液洗2遍,再用1 mL流式缓冲液重悬并移入流式管中,进行流式细胞术鉴定。
1.3.3 巨噬细胞吞噬荧光微球能力检测
取荧光微球与1%BSA以1∶100体积比混匀,浓度为5×106个/mL,37 ℃避光孵育30 min,超声处理5 min,临用前配。6孔板每个孔加入2 mL荧光微球,即1×107个/孔,96孔板每个孔加入100 μL,放入CO2培养箱中避光孵育1 h,弃上清,利用PBS缓冲液轻轻洗涤2次,最后加入1 mL PBS。利用荧光显微镜拍照,96孔板用多功能酶标仪在500和585 nm波段下读取荧光数值。同时,利用细胞刮收集细胞于上流式细胞仪检测。
1.4 数据处理
采用SPSS 23软件进行统计分析,计量资料以平均值±标准差表示,两样本均数比较采用t检验,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 细胞形态学观察结果
获取的小鼠腹腔细胞在含RPIM1640培养液中培养24 h后,细胞在显微镜下观察图像如图1所示。两种小鼠来源腹腔巨噬细胞形态不均一,可呈棱形、短杆状或椭圆形等,有伪足和突起,界限清楚,有钝圆形突起。两组间细胞密度肉眼未见明显差异。

图1 培养24 h后的腹腔巨噬细胞形态
2.2 腹腔巨噬细胞流式细胞术鉴定
流式细胞仪检测结果如图2所示,BALB/c小鼠腹腔巨噬细胞中F4/80阳性细胞比例为65.7%,表明该方法可以获得合适纯度的巨噬细胞。
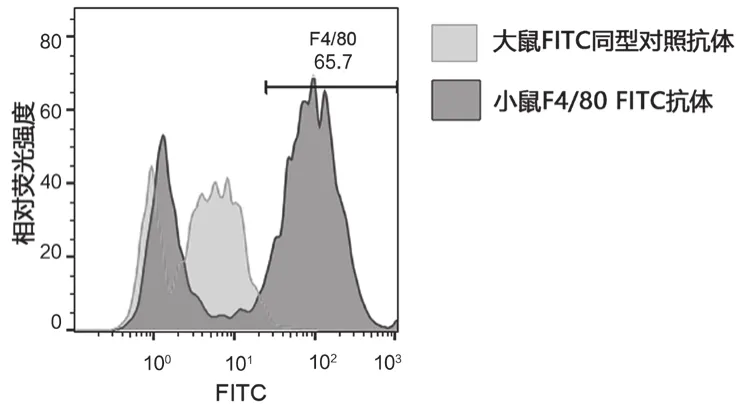
图2 BALB/c小鼠腹腔巨噬细胞F4/80阳性细胞纯度流式检测结果峰图
2.3 巨噬细胞吞噬荧光微球实验
利用荧光显微镜拍照可见红色荧光点为巨噬细胞吞噬的荧光微球,图3A可见BALB/c小鼠腹腔巨噬细胞大量吞噬荧光微球,而BALB/c裸鼠来源巨噬细胞吞噬荧光微球显著减少。图3B为多功能酶标仪检测读数结果,同样显示BALB/c小鼠腹腔巨噬细胞荧光读数显著大于BALB/c裸鼠来源巨噬细胞(P<0.05),有显著性差异。
用流式细胞术法比较两种小鼠腹腔巨噬细胞吞噬功能,结果如图4所示,可见BALB/c小鼠腹腔巨噬细胞平均荧光读数显著大于BALB/c裸鼠来源巨噬细胞,结果有显著性差异(P<0.05)。
BALB/c裸鼠为BALB/c带nu基因的同源近交系。裸基因是八号染色体上的隐性突变基因。病原体进入宿主体内首先启动固有免疫应答,巨噬细胞作为主要的固有免疫细胞,其吞噬作用在抗感染、抗肿瘤及免疫调节过程中发挥重要的作用[6]。研究表明,BALB/c裸鼠容易患病毒性肝炎和肺炎,提示BALB/c裸鼠巨噬细胞吞噬功能障碍[7]。因此对BALB/c裸鼠巨噬细胞的吞噬功能进行深入研究十分必要。

图3 小鼠腹腔巨噬细胞吞噬荧光微球功能检测
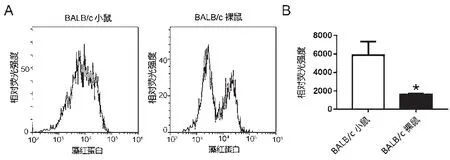
图4 流式细胞术检测小鼠腹腔巨噬细胞吞噬荧光微球功能
巨噬细胞是具有多种功能的免疫细胞,其不仅在先天免疫中发挥重要作用,也是机体细胞免疫中的一类关键细胞。目前,体外培养巨噬细胞来源很多,包括骨髓巨噬细胞、外周血巨噬细胞、腹腔巨噬细胞和肺脏巨噬细胞等,分离方法也有贴壁法、免疫磁珠分选法等[8-9]。本研究选取预先腹腔注射巨噬细胞刺激剂后腹腔灌洗提取腹腔巨噬细胞。该方法简单高效,提取巨噬细胞可满足蛋白检测、功能检测等多种分析方法。F4/80是检测巨噬细胞的常用膜表面标志,即表皮生长因子样激素受体1,主要表达于骨髓来源的单核细胞和巨噬细胞,尽管其在一些内皮样细胞和嗜酸性粒细胞中也有表达,但是目前F4/80是小鼠巨噬细胞公认的标志物。本实验提取的巨噬细胞比例为65%左右,和文献报道一致[10]。
巨噬细胞的吞噬作用是先天免疫中最基本的防御机制,与细胞胞吞作用密切相关。吞噬作用包括识别胞吞物、摄入和清除等复杂过程,与其表面存在的多种受体有关。之前研究对无胸腺小鼠的腹腔巨噬细胞吞噬功能存在争议。Vetvicka[11]等发现无胸腺小鼠腹腔巨噬细胞吞噬功能代偿性增加,可能与巨噬细胞表面FcR和补体受体增加有关。但是Ramos-Zepeda等[12]发现无胸腺小鼠腹腔巨噬细胞吞噬功能与野生型相比并无变化。这可能与无胸腺小鼠的种系不同以及吞噬功能的检测方法不同有关。此次研究发现BALB/c裸鼠吞噬荧光微球功能下降,并运用荧光显微镜、多功能酶标仪和流式细胞仪多种方法验证。另外,巨噬细胞提取过程的区别也可能是结果不一致的原因。
3 结论
裸鼠和野生型小鼠作为动物模型广泛应用于各种实验中,比较两种小鼠巨噬细胞吞噬作用有利于实验动物模型的建立与创新,促进动物实验向临床应用转化。本次研究结果表明,BALB/c裸鼠的腹腔巨噬细胞吞噬功能较BALB/c小鼠减弱,但是究竟那些基因改变影响裸鼠巨噬细胞吞噬功能还不明确,需要进一步的探索与研究。
