一种二维吖嗪共价有机骨架材料涂层毛细管的制备及其用于开管-毛细管电色谱分离硝基苯酚类环境内分泌干扰物
2020-08-26赵凌艺吕文娟牛效莹潘聪洁陈宏丽陈兴国
赵凌艺, 吕文娟, 牛效莹, 潘聪洁, 陈宏丽, 陈兴国
(兰州大学化学化工学院, 功能有机分子化学国家重点实验室, 甘肃 兰州 730000)
毛细管电色谱(CEC)是一种集成了毛细管电泳高分离效率和高效液相色谱高选择性的分离技术,具有样品消耗量低、分析速度快等优点[1,2]。开管-毛细管电色谱(OT-CEC)作为CEC的模式之一,虽具有毛细管柱制备简单、电渗流稳定及柱效较高等优点[2,3],但其柱容量和相比较低的缺点却在一定程度上限制了它的发展[2]。因此,选择适当的固定相来克服上述缺点以提高分离效率成为OT-CEC的研究热点。近年来,已有较多有关多孔有机骨架材料用作OT-CEC新型固定相材料的报道[4-15]。
共价有机骨架材料(COFs)作为一种由有机结构单元通过共价键连接而成的新型多孔晶体材料[16-18],因其比表面积较大、稳定性较高及孔径易于调控等优点[17,18],在储气[19]、催化[20]和吸附[21]等领域得到了广泛的应用。同时,优异的特性和独特的结构也使得COFs在分析化学中具有巨大的应用潜力[22-25]。迄今为止,已有的研究表明COFs可成功应用在色谱分离[12-15,26,27]和样品前处理[28-30]中,但其作为固定相用于CEC分离的相关报道较少[12-15,31,32]。
环境内分泌干扰物(EEDs)是指在进入人体后会干扰体内正常内分泌物质作用并破坏内分泌系统稳定性的一大类外源性化合物[33]。研究表明EEDs会造成出生缺陷、人类生育能力降低和生殖系统肿瘤发生率增加[34,35]。研究已证实在空气、水、土壤等介质中存在约50~70种EEDs[34]。目前,分离检测EEDs的方法主要为气相色谱-质谱联用法[36]和高效液相色谱-质谱联用法[37],但这些方法存在操作复杂、样品用量大等问题,因此开发简单、高效、样品用量少的CEC方法用于分离检测EEDs是十分必要的。
鉴于此,本工作通过共价键合的方式将一种二维吖嗪共价有机骨架材料ACOF-1涂覆于毛细管内壁,制备了ACOF-1涂层毛细管,以其为分离通道建立了分离硝基苯酚类环境内分泌干扰物的OT-CEC方法,并以4种硝基苯酚作为模型分析物对方法的性能和分离机理进行了评价和研究。
1 实验部分
1.1 仪器与试剂
Beckman P/ACE MDQ毛细管电泳仪(美国Beckman Coulter有限公司);D/max-2400 X射线粉末衍射仪(Rigaku,日本);Nicolet Nexus 670型傅里叶变换红外光谱仪(Nicolet,美国);JSM-6701F场发射扫描电子显微镜(JEOL,日本)。熔融石英毛细管(内径75 μm,外径375 μm,河北省永年光导纤维厂)。
水合肼、3-缩水甘油醚氧基丙基三甲氧基硅烷(GLYMO)购自美国Sigma-Aldrich试剂公司。1,4-二氧六环购自日本东京化成工业株式会社。乙酸、2-硝基苯酚(2-NP)、4-硝基苯酚(4-NP)、2,4-二硝基苯酚(DNP)、2,4,6-三硝基苯酚(TNP)购自上海阿达玛斯试剂有限公司。甲醇、乙腈、丙酮和甲苯购自天津利安隆博华医药化学有限公司。上述试剂均为分析纯,实验用水为超纯水。
1.2 合成ACOF-1
按文献[19]报道的合成方法做适当修改后合成ACOF-1:向安瓿瓶中加入60 mg 1,3,5-均苯三甲醛和2.0 mL 1,4-二氧六环,振荡直至固体粉末溶解。随后,向混合物中依次加入0.2 mL乙酸水溶液(6 mol/L)和38 μL水合肼。在液氮浴中快速冷冻及真空条件下火焰密封安瓿瓶。将恢复室温的安瓿瓶放置于烘箱中,120 ℃下反应72 h。反应结束后立即取出安瓿瓶并趁热将其从颈部打碎,将混合物转移至离心管中离心分离得到黄色固体。用丙酮洗涤数次后置于真空烘箱中于25 ℃干燥过夜,即得到浅黄色ACOF-1粉末。
1.3 制备ACOF-1涂层毛细管
首先,依次用甲醇(10 min)、超纯水(10 min)和1.0 mol/L NaOH(15 min)冲洗新的熔融石英毛细管,用橡胶塞密封毛细管两端后放入100 ℃烘箱中加热2 h。然后,分别用0.5 mol/L HCl(30 min)、超纯水(10 min)、甲醇(10 min)和丙酮(10 min)冲洗毛细管,氮气吹干毛细管并在120 ℃下加热1 h。之后,在预处理过的毛细管中充满GLYMO-甲苯(5∶95, v/v)溶液,两端密封,于100 ℃下加热6 h后依次用甲苯(10 min)、甲醇(10 min)和丙酮(10 min)冲洗,再用氮气吹干即得到GLYMO涂覆的毛细管。最后,将ACOF-1的甲醇溶液(1.0 g/L)泵送并充满GLYMO涂覆的毛细管,两端密封后在70 ℃下反应4 h。之后,用甲醇和丙酮彻底冲洗,除去残留的ACOF-1并用氮气吹干,即得到ACOF-1涂层毛细管。在整个制备过程中,通入溶液时施加于毛细管的压力均为0.07 MPa。图1为ACOF-1涂层毛细管的简要制备过程示意图。
1.4 缓冲溶液和标准溶液配制
配制0.1 mol/L的硼砂溶液作为缓冲溶液储备液,使用前用0.45 μm醋酸纤维素膜过滤,用超纯水和有机添加剂(甲醇或乙腈)稀释并调节至适当pH,得到运行缓冲溶液。
使用乙腈为溶剂配制质量浓度为4.0 g/L的分析物标准储备溶液,于4 ℃下储存。分析前用运行缓冲溶液稀释得到工作溶液。
1.5 电泳条件
涂层毛细管在首次使用之前,用运行缓冲液冲洗3 min;两次运行之间,用超纯水和运行缓冲液分别冲洗5 min。工作溶液超声脱气后通过压力进样(3.447 5 kPa)注入毛细管中,进样时间3 s,分离电压为-23 kV,运行缓冲溶液为15 mmol/L硼砂缓冲液(含10%(v/v)甲醇,pH 9.20),紫外检测波长为214 nm,毛细管温度为25 ℃。
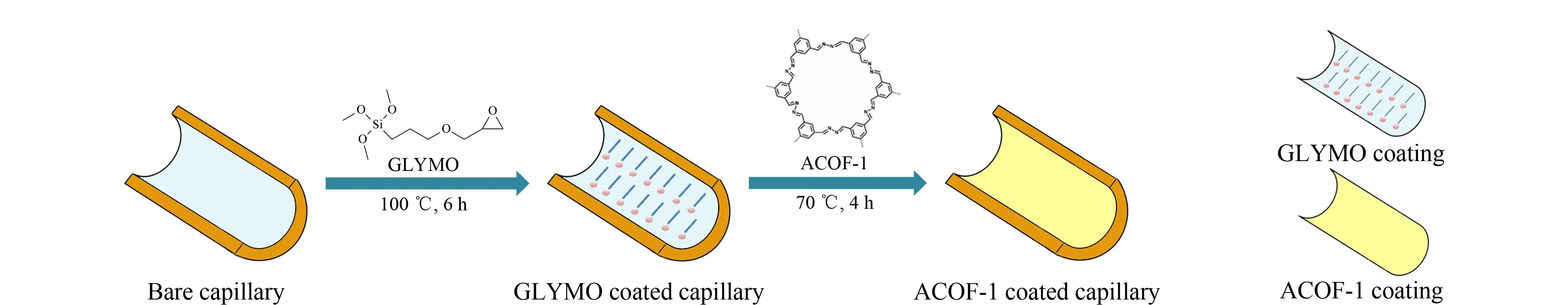
图 1 ACOF-1涂层毛细管的制备示意图Fig. 1 Schematic diagram for the preparation of the ACOF-1 coated capillary
2 结果与讨论
2.1 ACOF-1的合成和ACOF-1涂层毛细管的制备
原文献[19]合成方法的试剂加入顺序依次为1,3,5-均苯三甲醛、水合肼、1,4-二氧六环、乙酸。实验结果发现:若最后加入水合肼,所得产物的X射线粉末衍射特征峰强度更高。为了使所合成的ACOF-1的晶型更好,本实验将试剂加入顺序调整为1,3,5-均苯三甲醛、1,4-二氧六环、乙酸、水合肼。制备涂层管时,利用GLYMO作为硅烷偶联剂将环氧基修饰在毛细管内壁上。之后引入ACOF-1,借助环氧基开环并与ACOF-1中氨基的反应[38]将ACOF-1固定在毛细管内壁。
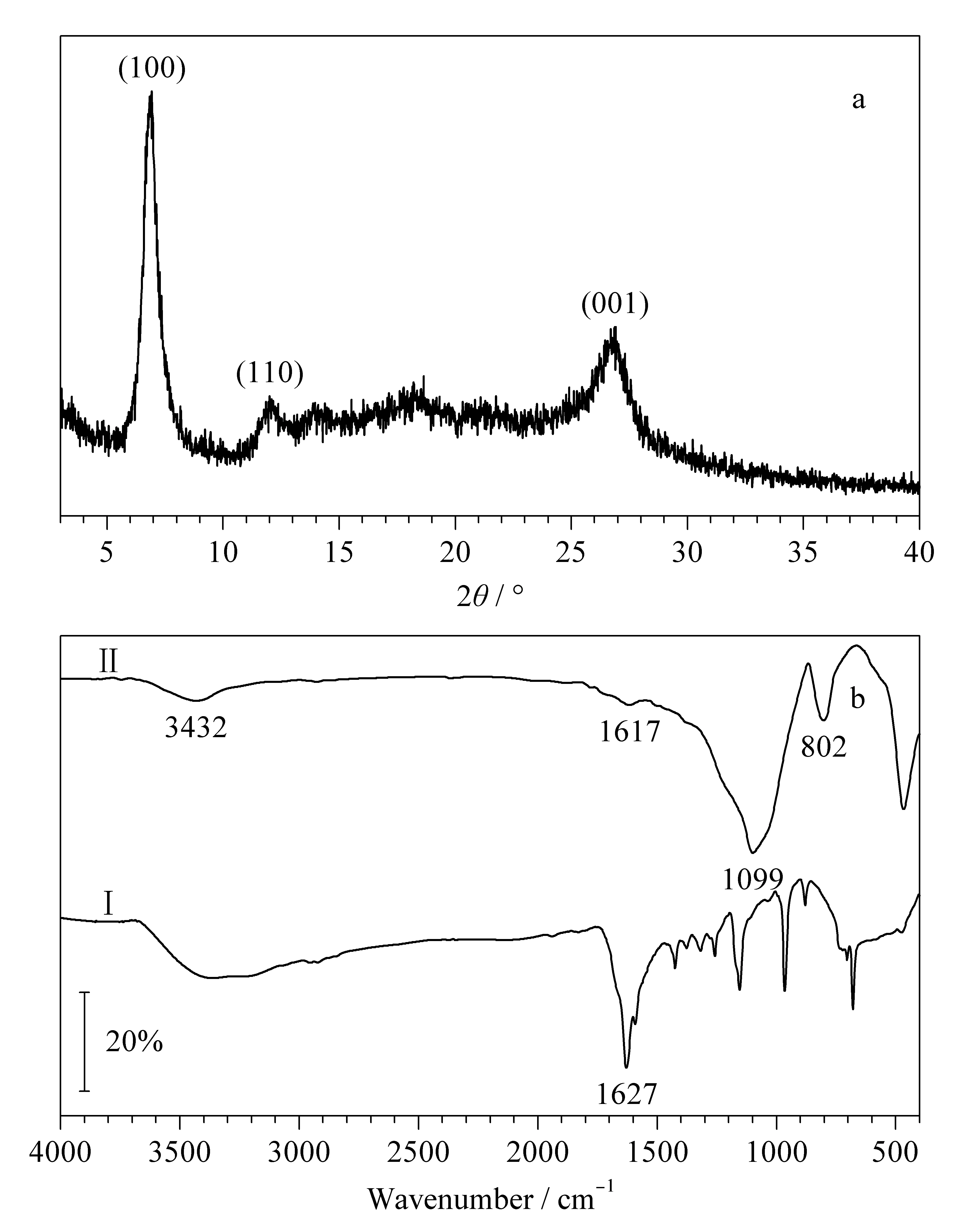
图 2 (a)合成的ACOF-1的XRD谱图与(b)合成的ACOF-1 (Ⅰ)和ACOF-1涂层毛细管(Ⅱ)的红外光谱图 Fig. 2 (a) X-ray powder diffraction (XRD) pattern of the synthesized ACOF-1 and (b) FT-IR spectra of the synthesized ACOF-1 (Ⅰ) and the ACOF-1 coated capillary (Ⅱ)
2.2 ACOF-1和ACOF-1涂层毛细管的表征
2.2.1XRD和FT-IR表征
图2a为合成的ACOF-1的X射线粉末衍射(XRD)谱图,其中7.14°、12.31°和27.45°处的衍射峰分别对应于(100), (110)和(001)晶面,这些衍射峰的位置与文献[19]报道的ACOF-1模拟XRD谱图中衍射峰位置一致,表明成功合成了ACOF-1。通过傅里叶变换红外光谱(FT-IR)对合成的ACOF-1和粉碎的ACOF-1涂层毛细管进行了表征,结果见图2b。谱图中802 cm-1和1 099 cm-1处的吸收来源于Si-O-Si的对称和不对称拉伸,3 432 cm-1的宽吸收为O-H的伸缩振动,1 617 cm-1及1 627 cm-1处的吸收为C=N的伸缩振动。FT-IR结果说明成功制备了ACOF-1涂层毛细管。
2.2.2扫描电子显微镜表征
利用扫描电子显微镜对裸毛细管和ACOF-1涂层毛细管的内壁进行表征,以观察毛细管内壁形态结构的变化。表征结果显示裸毛细管的内壁非常光滑(见图3a),而ACOF-1涂层毛细管的内壁则变得粗糙并可观察到涂层材料的分布(见图3b-d),表明ACOF-1被成功涂覆于毛细管内壁。由于ACOF-1涂层的厚度会影响分离效果。为确保涂层厚度一致,实验通过在制备过程中控制GLYMO和ACOF-1的浓度和通入时间实现这一目的。

图 3 (a)裸毛细管和(b、c、d) ACOF-1涂层毛细管内壁的扫描电镜图Fig. 3 Scanning electron micrograph images of (a) the bare capillary and (b, c, d) the ACOF-1 coated capillary
2.3 分离条件的优化
2.3.1有机添加剂
向缓冲溶液中加入适量的有机添加剂,可有效提高分析物在缓冲溶液中的溶解度,从而影响分离效率。实验考察了甲醇、乙腈等常用有机添加剂对分离效率的影响,结果表明使用甲醇的效果更好。因此后续实验选择甲醇作为有机添加剂并进一步对缓冲溶液中甲醇的含量进行优化。优化结果表明在添加10%(v/v)的甲醇后,分离所用时间明显缩短且各分析物峰形得到改善,但继续增加甲醇含量,分离度反而下降,最终导致分析物无法实现分离。因此,选择10%(v/v)作为有机添加剂甲醇的最佳含量。
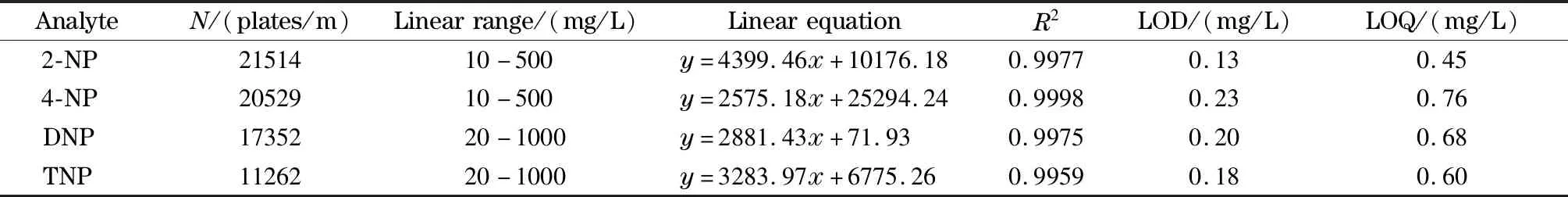
表 1 4种硝基苯酚分析物的柱效、线性范围、线性方程、决定系数、检出限、定量限
2.3.2缓冲溶液pH
缓冲溶液pH的变化会影响分析物的电离状态而使分析物的电泳迁移行为发生改变。实验考察了pH在8.80~9.40的范围内对4种硝基苯酚分析物分离的影响。结果表明,当pH从8.80增大到9.00时,各分析物达到基线分离。继续增大pH至9.20,各分析物不仅可实现基线分离且峰形得到改善,但当pH增至9.40时,迁移时间却大幅延长。综合考虑分离度、峰形和迁移时间的影响,选择pH 9.20作为缓冲液最佳pH。
2.3.3缓冲溶液浓度
实验在10~20 mmol/L范围内考察了硼砂浓度对分离效率的影响。结果表明,随着硼砂浓度的增大,分离度无明显变化,但迁移时间明显缩短。实验结果同时表明在15 mmol/L时各分析物的峰形更好,故选择15 mmol/L作为硼砂缓冲溶液的最佳浓度。
2.4 方法评价
在最佳分离条件下,4种硝基苯酚分析物的电泳分离谱图见图4。
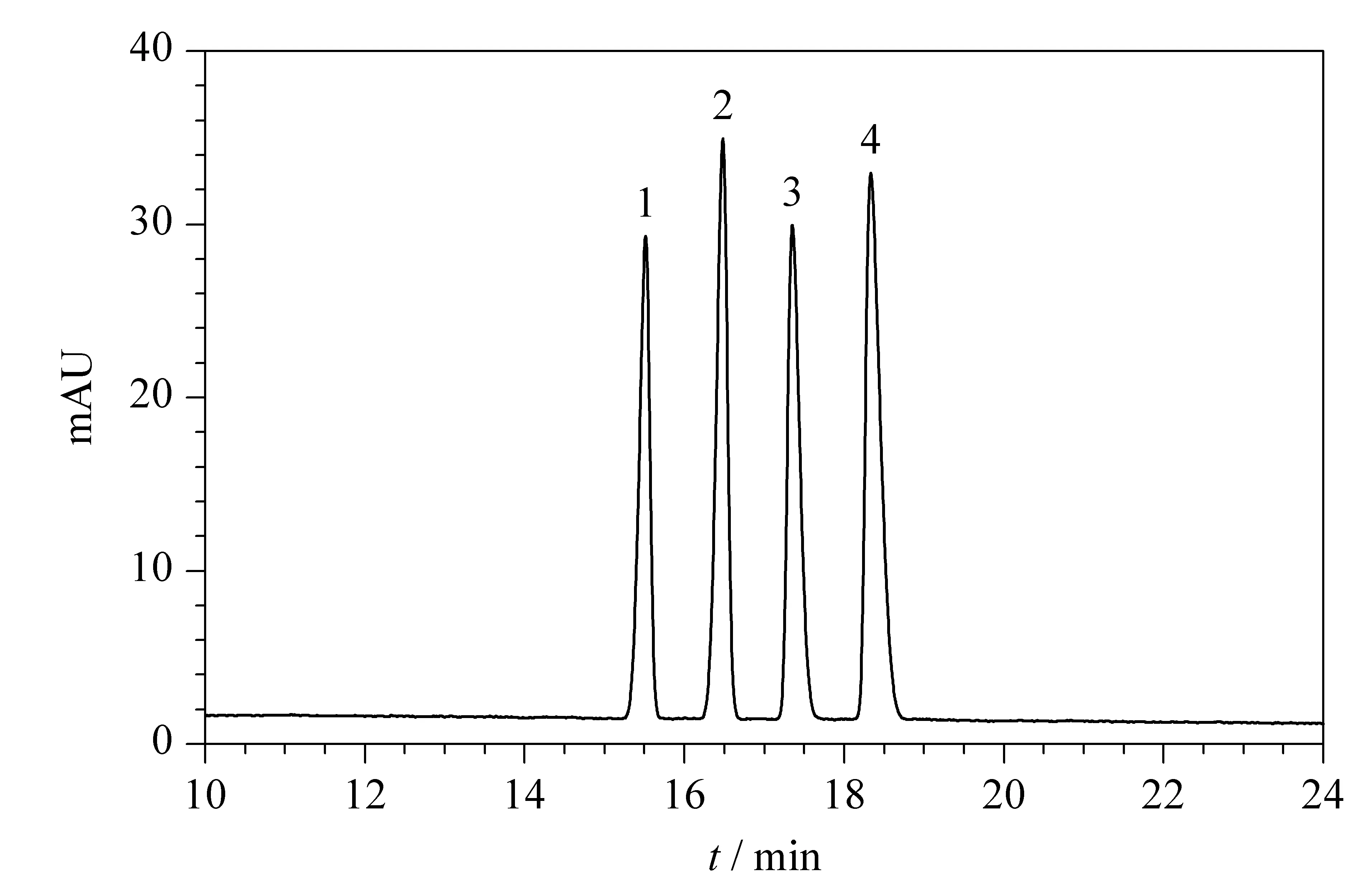
图 4 ACOF-1涂层毛细管分离4种硝基苯酚分析物的标准电泳谱图Fig. 4 Typical electropherogram of four nitrophenol analytes with the ACOF-1 coated capillary Buffer solution: 15 mmol/L borate with 10% (v/v) CH3OH, pH 9.20. Applied voltage: -23 kV. Detection wavelength: 214 nm. Capillary: 50.2 cm total length (40.0 cm effective length). Peak identification: 1. 2-nitrophenol (2-NP); 2. 4-nitrophenol (4-NP); 3. 2,4-dinitrophenol (DNP); 4. 2,4,6-trinitrophenol (TNP).
由图4可看出,以ACOF-1涂层毛细管为分离通道可在20 min内实现4种硝基苯酚分析物的基线分离,具有较高的分离效率;由表1可看出柱效较高,说明ACOF-1涂层毛细管对4种硝基苯酚分析物具有良好的分离性能。在最佳条件下,对不同浓度的硝基苯酚分析物进行了分离测定。4种硝基苯酚分析物的线性范围、线性方程、决定系数、检出限和定量限见表1。由表1可知,该方法的性能优异。
实验通过各分析物迁移时间和峰面积的日内、日间及柱间相对标准偏差(RSDs)对该方法的重现性和稳定性进行评价,结果见表2。由表2可知,4种硝基苯酚分析物的迁移时间的日内、日间和柱间RSDs分别1.4%~1.5%、5.7%~6.8%和3.6%~5.5%;峰面积日内、日间和柱间RSDs分别为0.6%~1.6%、2.5%~7.0%和3.5%~9.4%。上述结果表明该方法分离硝基苯酚分析物具有良好的重现性和稳定性。
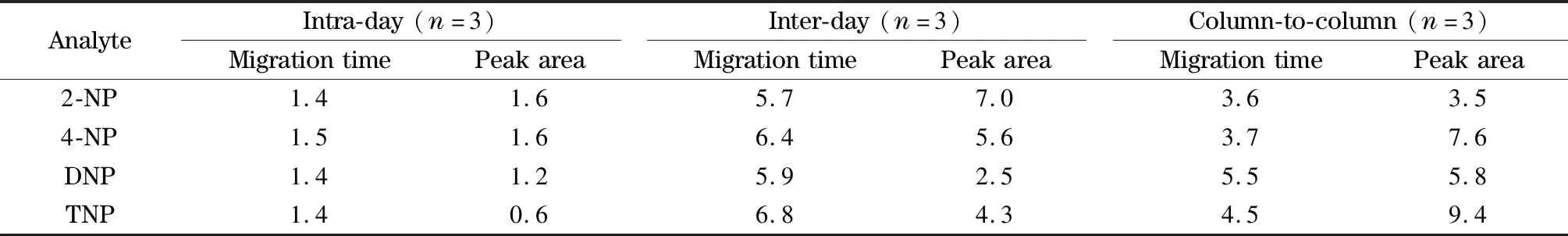
表 2 4种硝基苯酚分析物的迁移时间和峰面积的日内、日间及柱间相对标准偏差
2.5 分离机理
由ACOF-1的结构可知,ACOF-1涂层与分析物之间可能存在疏水相互作用和尺寸选择作用。分析物的相对疏水性可用其辛醇-水分配系数(Kow)衡量。由表3可知,4种硝基苯酚分析物的疏水性大小依次为4-NP<2-NP 表 3 4种硝基苯酚分析物的化学结构、log Kow、分子尺寸和分子体积 4种硝基苯酚分析物的分子尺寸和分子体积见表3。各分析物的分子尺寸均小于ACOF-1的孔径(0.94 nm),表明它们均可进入到ACOF-1孔道内。但各分析物分子体积的大小会影响它们通过ACOF-1孔道的难易程度,分子体积越小的越容易通过。实验结果显示各分析物的迁移顺序与它们分子体积由小到大的顺序一致,表明ACOF-1涂层毛细管对4种硝基苯酚分析物的分离主要基于ACOF-1孔结构的尺寸选择作用。 本文通过共价键合方式制备了ACOF-1涂层毛细管,建立了以其为分离通道分离硝基苯酚类内分泌干扰物的OT-CEC新方法。在最佳条件下,该方法可在20 min内实现2-硝基苯酚、4-硝基苯酚、2,4-二硝基苯酚、2,4,6-三硝基苯酚4种硝基苯酚模型分析物的基线分离并具有较高的柱效和良好的稳定性。ACOF-1孔结构对分析物的尺寸选择是影响分离行为的主要作用。本工作表明COFs可作为固定相材料用于OT-CEC分离检测EEDs.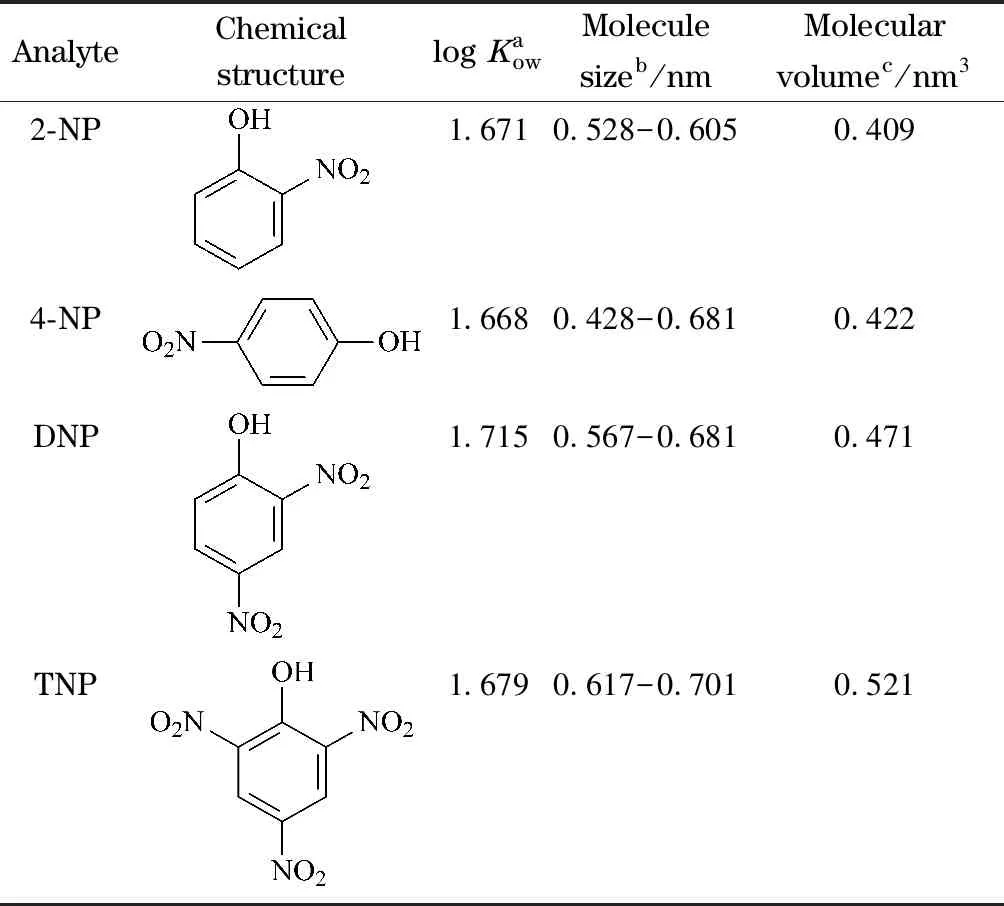
3 结论
