两种表征核酸适配体-靶蛋白亲和作用的毛细管电泳方法比较
2020-08-26孟庆威谢剑炜
孟庆威, 郭 磊, 谢剑炜
(1. 军事科学院军事医学研究院毒物药物研究所, 抗毒药物与毒理学国家重点实验室, 北京 100850;2. 东曜药业有限公司, 江苏 苏州 215024)
核酸适配体是一类通过指数富集配体的系统进化技术得到的单链寡核苷酸(RNA或单链DNA, ssDNA),是分析化学、生物医学领域内一类重要的“明星分子”,在分析传感、治疗药物、临床诊断等方面开展了多样化探索实践[1]。与抗体抗原亲和识别方式比较,相似的是,适配体与靶分子间亦具备空间互补之特征,经多种静电、疏水等作用力产生特异性识别;不同的是,适配体作为寡核苷酸分子本身,存在结构易变性、多样性,其三维结构受体系微环境,如界面特性、溶液离子种类/浓度等调控的影响较为显著,某种程度上对适配体的具体应用造成了一定阻碍[2]。目前认为,对于适配体及其靶分子,最好利用至少两种方法进行相互作用评价,以深入理解其作用方式及特性。
目前常见的互作评价技术包括荧光、凝胶电泳迁移率变动分析、CE、等温滴定量热法、表面等离子体共振等[3,4],其中CE技术因其多模式方法、体系生物相容性强的特点,已成功发展了亲和CE(ACE)、CE-前沿分析(FA)、预平衡-毛细管区带电泳(PE-CZE)等多种评价方法[5,6]。例如,近年来Krylov课题组[7,8]发展了一系列动力学CE方法,从CE分离状态中的复合物形成和解离的偏微分方程解析解入手,可针对单张谱图,从平衡混合物的非平衡CE(NECEEM,也即PE-CZE)[9]、柱塞-柱塞动力学CE[10]等多种模式同时求解解离常数(Kd)和动力学速率常数。一般认为CE-FA适用于测定快解离的结合过程,而PE-CZE适用于慢解离(解离动力学低于CE中的峰分离时间量度)的结合过程。但亦有PE-CZE研究快解离[11]、微流控芯片CE-FA研究慢解离[12]的结合作用的报道。
CE技术本质上是高压电场下的分离技术,适配体-靶分子复合物在分离过程中不断发生解离;另外,适配体是结构柔性分子,其与靶蛋白的结合易受体系微环境影响,最终造成多种CE互作评价体系测定的Kd结果存在明显差异。例如,对于凝血酶及其特异性作用于肝素结合位点的29mer ssDNA适配体(Kd经硝酸纤维素膜过滤法测定为0.5 nmol/L[13]),本课题组前期使用PE-CZE测得Kd值为200~255 nmol/L[14];张新祥课题组使用PE-CZE结合化学发光测得Kd为124±7 nmol/L[15]; Riley等使用毛细管等速电泳,以NECEEM计算29mer与凝血酶的Kd为128±9 nmol/L[16]; Gong等应用芯片ACE测得Kd值为43 nmol/L[17]等。这就使得基于CE的互作评价方法的可靠性受到限制。甚或2019年,Wakui等使用磁珠辅助CE体外筛选得到Kd值为4.5~8.2 nmol/L的数种凝血酶适配体,但反而选用表面等离子体共振对其亲合力进行评价[18]。
因此,亟须科学设计和系统比较,针对同一体系使用多种CE方法表征测定适配体-靶分子间亲和作用,从而有效说明CE方法的适用性。本研究即针对该29mer-凝血酶亲和作用为模型体系,使用CE-激光诱导荧光(LIF)检测,引入CE-FA评价方法,并比较其与PE-CZE的异同,进而经多种方式进行Kd拟合,详细讨论了两种方法下6种方式的拟合结果及适用范围,以实现优选与比较印证。
1 实验部分
1.1 仪器与试剂
Beckman P/ACE 5000型毛细管电泳仪,配备激光诱导荧光检测器(氩离子激光器,激发波长488 nm,发射波长520 nm),液冷控温模式(美国Beckman公司); 32 Karat仪器控制与数据处理软件(美国Beckman公司);未涂层熔融石英毛细管(河北永年光纤厂)。
人α-凝血酶(8.3 mg/mL,活性3 432 Units/mg,美国Haematologic Technologies公司); 5′端荧光素标记的凝血酶适配体F29mer(5′-AGTCCGTGGTAGGGCAGGTTGGGGTGACT-3′,上海生工生物技术公司,经UltraPAGE或HPLC纯化);牛血清白蛋白(BSA,北京欣经科生物技术公司);三羟甲基氨基甲烷(Tris,美国Angus公司);甘氨酸(上海生工生物技术公司); NaOH、甲醇(国药集团北京化学试剂公司),所有试剂纯度至少为分析纯。
1.2 实验方法
分离毛细管的总长度为37 cm,其中有效分离长度30 cm,内径为50 μm。新毛细管使用前以甲醇、水和1 mol/L NaOH分别冲洗10、5和30 min进行活化。每天实验前,毛细管分别用0.5 mol/L NaOH、H2O和运行缓冲液各冲洗5 min。每次分离间用0.5 mol/L NaOH、H2O及电泳缓冲液分别冲洗2、1和3 min。气动进样:0.5 psi(3 447 Pa),分离电压:15 kV,分离温度:15 ℃,数据采集频率:5 Hz。运行缓冲液:Tris-甘氨酸缓冲液(2×TG,内含50 mmol/L Tris、384 mmol/L甘氨酸,pH 8.5)。
CE-FA法中,(1)进样分离的样品中含终浓度200 nmol/L的凝血酶和终浓度为10~200 nmol/L的F29mer,同时以F29mer浓度对平台峰高绘制标准曲线,非线性回归(公式1)测定Kd值:
(1)
其中,n:结合比;K:结合位点的结合常数,与Kd互为倒数关系;Cf:游离适配体浓度;Cb:结合适配体浓度;R=Cf/Cb,游离适配体与结合适配体的比值。
(2)进样分离的样品中含终浓度100 nmol/L的F29mer和终浓度为0~400 nmol/L的凝血酶,同时以F29mer平台峰的降低及F29mer-凝血酶复合物平台峰的升高进行Kd值的非线性拟合(单点结合模型,公式2)。
(2)
其中,Bmax:特异结合的F29mer或凝血酶的最大浓度;y: F29mer-凝血酶复合物峰高或游离F29mer峰高,x:加入的凝血酶浓度,Kd: F29mer-凝血酶复合物的解离常数。
PE-CZE法中,(1)进样分离的样品中含终浓度100 nmol/L的F29mer和终浓度为0~400 nmol/L的凝血酶,以F29mer谱峰的降低及F29mer-凝血酶复合物谱峰的升高进行Kd值的非线性拟合(公式2)。
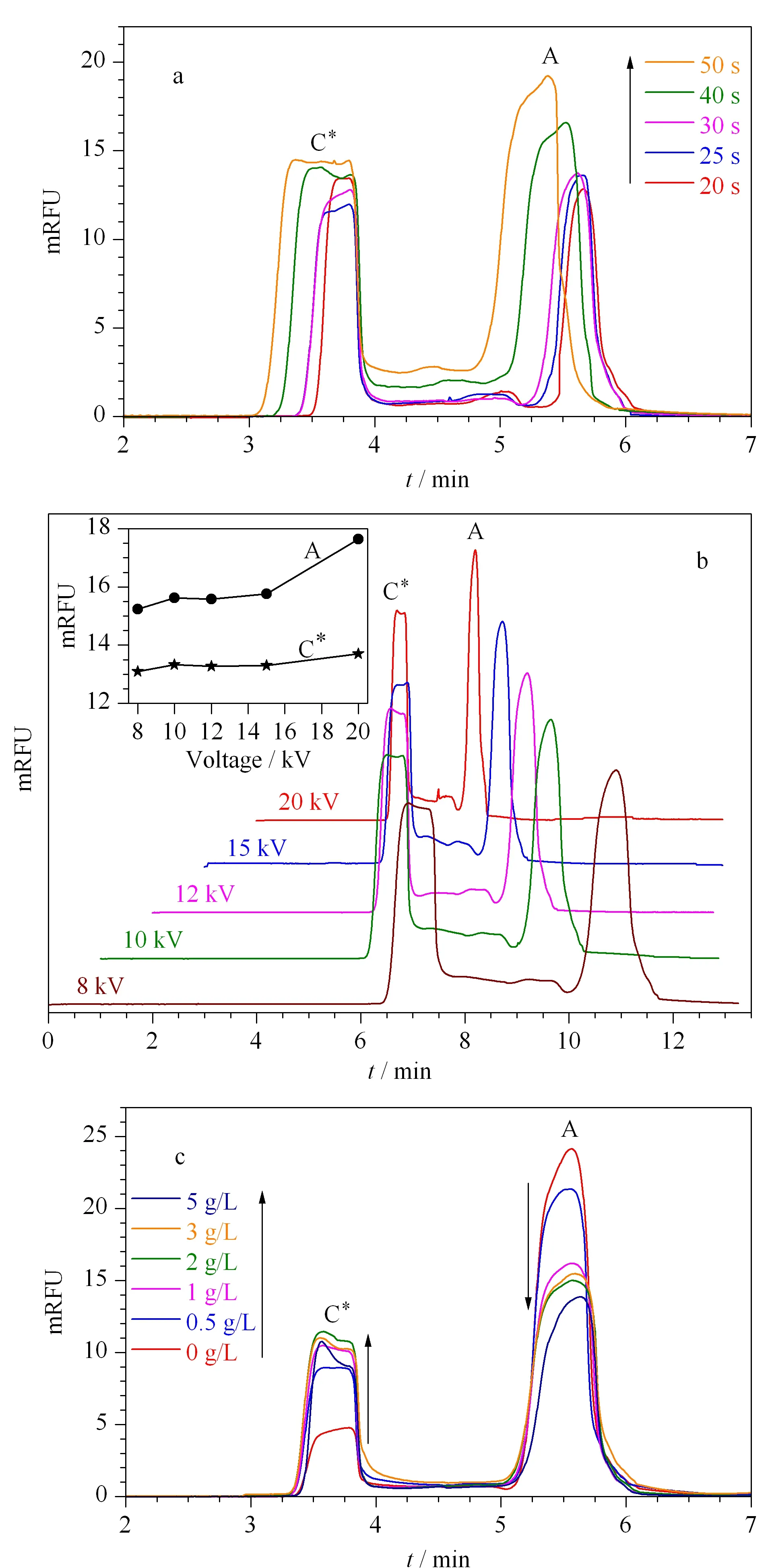
图 1 CE-FA分离条件的优化Fig. 1 Optimization of capillary electrophoresis-frontal analysis (CE-FA) separation conditions a. injection time; b. separation voltage; c. added amount of bovine serum albumin (BSA). A: free F29mer; C*: complex peak; mRFU: milli- of relative fluorescence unit.
(2)对于部分PE-CZE谱图,采用NECEEM方法计算Kd(公式3)。
(3)
其中,P0:凝血酶的初始浓度;L0: F29mer的初始浓度;Aa:游离F29mer的峰面积;Ab:两峰间延伸的桥面积;Ac: F29mer-凝血酶复合物的峰面积。
所有数据点均重复测定3次,取平均值进行计算拟合。所有拟合使用OriginPro 2016软件(美国OriginPro公司)进行;组间数据的统计学分析采用单因素方差分析(one-way ANOVA, Graphpad Prism 8,美国Graphpad Software公司)进行显著性比较。
2 结果与讨论
2.1 CE-FA
CE-FA方法研究靶蛋白-适配体分子互作的前提条件是,使用系列浓度的适配体与靶蛋白,通过气动或电动进样引入一段较长的预平衡混合物区带,分离过程中,复合物和游离适配体间的淌度存在明显差异,但复合物分子和蛋白质分子的淌度一致,否则需要淌度校正[19];仅游离适配体和复合物分离开来,并形成无弥散的平台峰;以及适配体平台峰的峰高与游离浓度呈线性关系。目前常在绘制游离适配体的标准曲线基础上,经结合适配体/游离适配体浓度比(R)对游离适配体浓度(Cf)非线性拟合,即给出Kd值和结合比等[12]。
2.1.1CE-FA分离条件优化
本研究使用CE-LIF检测,未标记的凝血酶不能被观测到,其对荧光标记适配体(F29mer)和其复合物峰的检测不产生明显干扰。选用较低工作温度(15 ℃)、较短毛细管长度及生物相容性较好的缓冲体系2×TG(pH 8.5)[14],在37 ℃经0.5 h孵育完全后进样。进样时间30 s,即进样长度约为毛细管总长的11%,得到了稳定的复合物及游离适配体平台峰,说明在该条件下F29mer-凝血酶复合物在高压电场分离时仍能稳定存在。8~15 kV工作电压时,复合物及游离适配体的平台峰高均可正常维持且基本不变,说明CE-FA法的平台峰高基本不受工作电压的影响。加入1 g/L BSA可提高CE-FA分离的重复性,同一样品的迁移时间重现性极好,且平台峰高偏差<2%(见图1)。在该分离条件下,凝血酶(相对分子质量约36 700,等电点7.02)和复合物并不能形成有效分离,非常符合CE-FA法的前提条件。
2.1.2CE-FA法测定F29mer-凝血酶结合作用
CE-FA测定中,首先以F29mer标准溶液的平台峰峰高(Y, mRFU)对浓度(X, nmol/L)作图,得到良好的线性关系(Y=0.126X+1.915),线性范围为5~200 nmol/L,相关系数(r2)为0.994(n=7),峰高重现性良好(RSD为2.73%)。
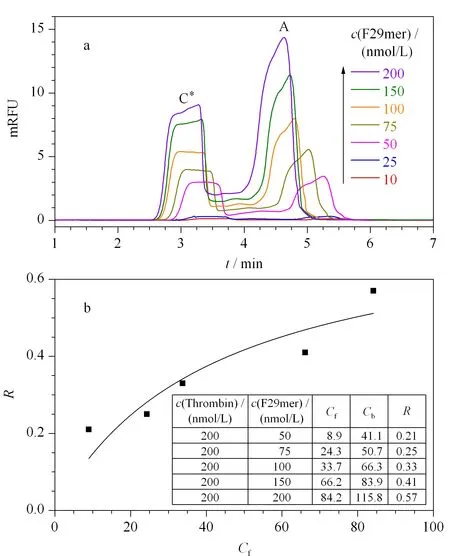
图 2 F29mer-凝血酶相互作用的(a)CE-FA谱图及(b)R-Cf非线性拟合Fig. 2 (a) CE-FA electrophoregrams of F29mer-thrombin interaction and (b) non-linear fitting by R versus Cf values Cf refers to free aptamer concentration, and R refers to ratio of Cf to the binding aptamer concentration (Cb).
然后固定凝血酶为200 nmol/L,加入终浓度为10~200 nmol/L的F29mer,开展CE-FA测定(见图2a)。随着F29mer浓度增加,游离F29mer的平台峰高明显降低,复合物的平台峰高逐渐增高。将上述不同浓度样品经CE-FA分离后得到的F29mer平台峰高的值,代入F29mer的线性方程中,得到对应不同浓度样品的游离F29mer浓度Cf。
运用非线性回归(公式1)进行数据处理,求解出相互作用参数,即F29mer与凝血酶间的Kd值为42±28 nmol/L(结合常数K为(2.4±0.9)×107L/mol,r2=0.834),n=0.768,取n=1,即1分子的F29mer与1分子的凝血酶结合。以往CE-FA法中,除非线性拟合外,常对所得到的系列Cf、Cb、R值等,采用如Scatchard线性回归(R/Cf对R作图)和Klotz线性回归(1/R对1/Cf作图)等进一步进行线性变换,从而得到Kd值。考虑到线性变换实际上是非线性拟合的特殊表现形式,且在线性转换时往往错误估计了实验误差的贡献大小[20],在此不再进行线性变换。
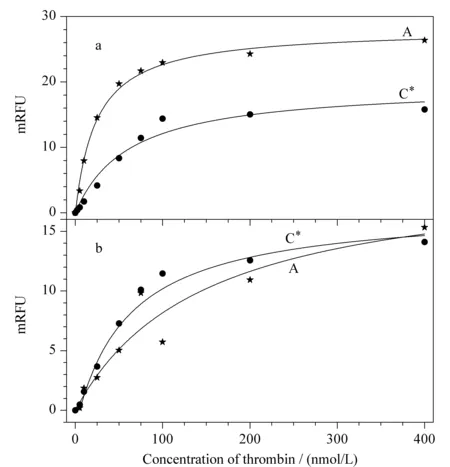
图 3 由(a)CE-FA法的平台峰高变化和(b)PE-CZE法谱峰峰高变化对凝血酶浓度进行非线性拟合Fig. 3 Non-linear fitting curves of (a) plateau peak height in CE-FA and (b) peak height in preequilibrium-capillary zone electrophoresis (PE-CZE) versus concentration of thrombin A refers to the relative decrease of (plateau) peak height of free F29mer; C* refers to the relative increase of (plateau) peak height.
另行固定F29mer为100 nmol/L,加入终浓度为5~400 nmol/L的凝血酶,经CE-FA分离分析。同样,随着凝血酶浓度增加,游离F29mer峰高明显降低,复合物峰高明显升高。针对该系列浓度样品所得到的不同复合物和游离F29mer平台峰高值,直接使用游离F29mer平台峰高降低值或复合物平台峰高升高值,对凝血酶浓度进行非线性拟合(公式2,见图3a),得到的Kd值列于表1。
2.2 PE-CZE
2.2.1PE-CZE法测定F29mer-凝血酶结合作用
在PE-CZE模式下(进样10 s),游离F29mer和复合物呈现尖锐的高斯峰,同样使用游离F29mer峰高降低值或复合物峰高升高值,对凝血酶浓度进行非线性拟合(公式2,见图3b)。得到的Kd值列于表1。

表 1 CE-FA与PE-CZE方法下F29mer-凝血酶亲和作用参数
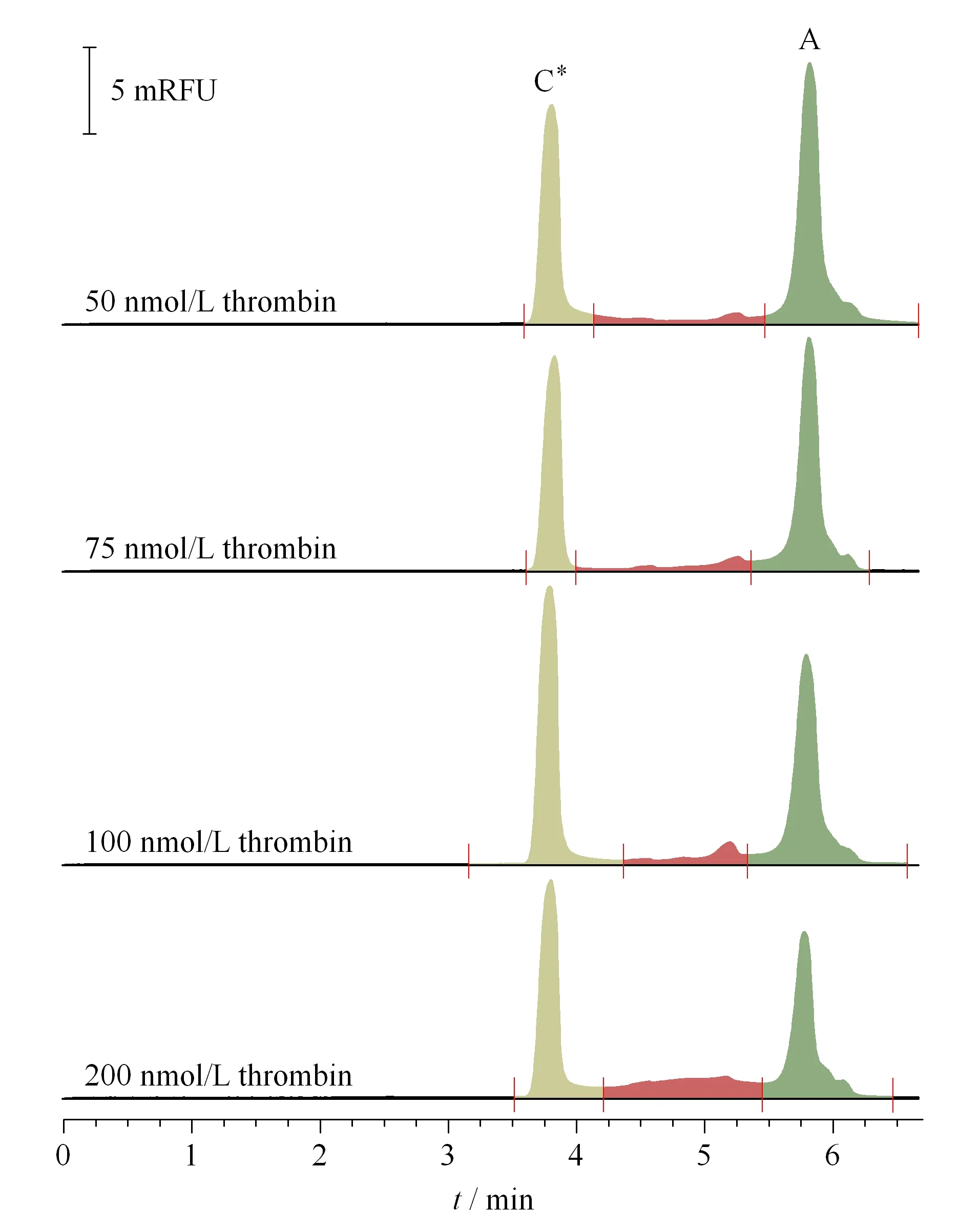
图 4 PE-CZE模式下用于NECEEM法计算的峰-桥曲线Fig. 4 Peak-bridge curves calculated by non-equilibrium CE of equilibrium mixtures (NECEEM) in PE-CZE mode
2.2.2应用NECEEM法计算Kd
亦针对PE-CZE法中单个浓度下的谱图,开展了NECEEM法的计算求解。典型的NECEEM电泳图由两个峰和两个峰之间平滑过渡的“指数型桥”组成,通常利用峰和桥的面积,经公式3计算得到Kd。2011年,Cherney等[21]经过系统分析后指出,实验计算的解离速率常数(koff)和Kd值与模拟电泳图计算值的偏差不会超过15%,只需从视觉上识别出峰和桥,即可认为是合理边界。屈峰课题组进一步证实了这一点[22]。本研究也采用设定峰高阈值后自动积分的方式,不考虑面积积分带来的误差。当F29mer固定为100 nmol/L时,选择适配体1/2~2倍浓度的靶蛋白共存时的谱图进行计算(见图4)。可以看出,此时的“指数桥”部分相对均较为明显。凝血酶浓度为50、75、100、200 nmol/L时,所对应单个谱图计算得到的Kd值分别为72、33、36和82 nmol/L,平均值为56±25 nmol/L。
2.3 多种拟合方式的比较
以上不同拟合方式下测定的F29mer-凝血酶的Kd值均列于表1。所有拟合值经one-way ANOVA单因素方差分析进行显著性检验,除PE-CZE(A)给出的Kd(147±63 nmol/L)与其他数值间存在显著性差异(P> 0.05)外,其他Kd值均居于24~64 nmol/L间,不存在显著性差异,即结果间较为一致。这也说明了CE-FA法在本体系中的适用性。
对于本模型体系,CE-FA法与PE-CZE法相比,其区别仅在于进样量不同,但峰形上产生了明显差异。在高压电场下,CE-FA法中复合物平台峰中始终维持着较稳定的结合平衡;而PE-CZE法中,复合物峰更倾向于解离,即游离适配体的浓度被高估,那么由PE-CZE (A)给出的Kd值就会偏高,甚至与其他方式所测定的Kd值间产生显著性差异。CE-FA法的平台峰高基本不受迁移时间、电渗流及工作电压的影响,相对PE-CZE法而言较为稳定,耐用性较强。CE-FA法中的3种拟合方式符合度较好,其中以CE-FA法中依据平台峰高对分析物浓度变化的非线性拟合更为简便。然而,R-Cf非线性拟合方式还可给出对于同一结合位点的分子结合比,但需保证游离适配体标准曲线的精密度较高。
PE-CZE法中的单张谱图还可经NECEEM法进行数据计算处理,但尚需选择适配体的适当浓度范围。例如,Kanoatov等[23]曾指出,如果靶物质T和配体L的初始浓度(T0和L0)选择不当,极可能造成Kd值的较大误差,一般推荐L0≤2Kd,Kd+0.5L0≤T0≤2Kd。这就为未知Kd的互作体系带来了较大的不确定性。在此选择凝血酶的浓度为F29mer的0.5~2倍,且观察到明显的两峰间“指数桥”为前提,多点拟合后取均值,有效规避了Kd值未知的问题。
3 结论
本研究针对目前CE在适配体-靶蛋白亲和作用评价表征时存在的差异性,基于F29mer-凝血酶体系引入CE-FA方法,并开展了同一体系条件下的CE-FA及PE-CZE方法及不同拟合模式比较的系统研究。总体而言,在确保适配体-靶蛋白复合物稳定存在的前提下,CE-FA法可与PE-CZE互为印证,提高了亲和作用评价的可靠性。结合本模型体系,我们提出,在CE亲和评价时,首选推荐使用多浓度平台峰高变化进行非线性拟合的CE-FA法,可相对有效克服对高压电场对复合物分离的影响,具有适用范围广、方法稳定、拟合结果简便准确等特点。未来可结合电动与气动双分离模式,提高CE-FA体系对生理缓冲体系高离子强度的耐受性,使得Kd拟合的准确度进一步增强。
