聚多巴胺表面修饰毛细管电色谱的研究进展
2020-08-26易高圯纪柏安夏之宁付琦峰
易高圯, 纪柏安, 夏之宁, 付琦峰*
(1. 西南医科大学药学院, 四川 泸州 646000; 2. 重庆大学药学院, 重庆 401331)
在毛细管电泳(CE)分离分析技术的研究中,原始的熔融石英毛细管只能提供阴极流向的电渗流(EOF),容易引起样品分离时间窗口过小等问题[1,2]。毛细管内壁硅羟基解离程度的易变性也容易致使CE分离的重现性变差。另一方面,由于静电及疏水等相互作用,未修饰熔融石英毛细管容易吸附蛋白质等荷正电的化合物,进而引起峰形拖尾、分离效率降低等问题。此外,更重要的是熔融石英毛细管内壁只含有亲水性硅羟基,功能单一,无法提供疏水、π-π堆积、阳离子-π以及亲和作用等色谱保留机制,不能满足各类复杂样品体系尤其是中性和手性样品的分离需求。因此,有必要在CE中引入各种毛细管内壁功能化改性策略,以拓展其实际应用潜力。常见的改性策略主要分为物理吸附涂层[3]和化学键合涂层[4]。其中,物理吸附涂层通过静电相互作用、范德华力和氢键等作用将聚电解质[5]、羧甲基壳聚糖[6]和纳米硅[7]等固定相吸附于毛细管内壁,制作方法较为简便。但是该策略制备的固定相普遍稳定性较差,使用寿命较短,阻碍了其在CE中的广泛应用。化学键合涂层与毛细管内壁之间的结合更加牢固,涂层稳定性更好,使用寿命较长[1,8],但是也存在制备过程繁杂、耗时等缺点。
多巴胺(DA)在弱碱性条件下自发氧化聚合形成的贻贝仿生聚多巴胺(PDA)涂层在几乎所有种类的基底表面都具有较强的黏附性能且制备过程简便易行[9]。除了强黏附性之外,PDA涂层由于富含酚羟基、氨基等活性功能基团,还可作为反应平台进行二次表面修饰,既能与多种金属离子发生螯合或氧化还原反应,亦可与含有巯基或氨基基团的分子发生迈克尔加成或席夫碱反应,进而制备出相应的功能化表面涂层材料。由于PDA功能化涂层的制备过程与物理吸附涂层一样简便,而表面黏附涂层的稳定性又可与共价键合涂层相媲美[10],因此非常适用于毛细管内壁的功能化修饰。2008年,Yin等[11]首次基于PDA的强黏附性质,制备了PDA涂层开管毛细管电色谱(OT-CEC)柱,并用于生长素的分离分析。此后,PDA涂层材料在CEC中的巨大应用价值逐渐得到了研究者们的广泛关注。
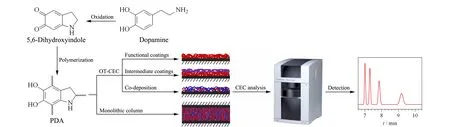
图 1 聚多巴胺及其衍生材料在毛细管电色谱中的应用示意图Fig. 1 Schematic of the application of polydopamine (PDA) and its derivation materials in capillary electrochromatography (CEC)OT: open-tubular.
本文综述了近几年PDA涂层材料在CEC领域的主要应用,首先概述了近3年PDA的形成机理及其表面化学的最新发展,然后总结了近10年PDA涂层材料在CEC中的应用进展,主要包括PDA涂层OT-CEC柱的制备与应用和PDA功能化整体柱的制备与应用(见图1)。
1 聚多巴胺表面化学的最新进展
1.1 聚多巴胺的形成机理
PDA由DA氧化自聚合得到,自2007年PDA类材料被首次报道以来,有关PDA形成机制的研究已有很多,但迄今为止尚未完全阐明PDA的结构和形成机制。近年来,关于PDA结构的研究不断深入,但PDA的精确结构仍有待确定。Bielawski等[12]采用固体光谱和晶体学技术对PDA结构进行了分析,提出PDA不是一个共价聚合物,而是中间产物5,6-二羟基吲哚(DHI)单体通过电荷转移、π-堆积和氢键等相互作用结合在一起形成的超分子聚合体。具体来说,DA在碱性条件下先自氧化成多巴胺醌,通过迈克尔加成反应,分子内环化及氧化重排生成DHI, DHI相互聚合形成一系列低聚物,再通过π-π相互作用等组装成超分子聚合体,即PDA。2016年,丁国生研究组[13]概述了PDA的形成机理,他们指出,在PDA形成过程中DA的共价聚合和非共价自组装同时存在,共价作用在PDA形成初期起着至关重要的作用,而非共价键则是在低聚反应大部分完成后开始发挥作用。PDA结构中存在未聚合的DA单元,未聚合的DA可与其氧化产物DHI自组装,形成(DA)2/DHI复合结构。此后,Buehler等[14]采用分子动力学模拟和密度泛函理论计算方法,系统地分析了从二聚物到四聚物等一系列可能的早期聚合的DHI低聚物,并提出一套分子模型,描述PDA的结构多样性。该研究表明,PDA由近平面的低聚物组成,这些低聚物可能通过π-π相互作用堆积在一起,形成类似石墨的层状聚集体。Filip等[15]采用同位素标记法并结合固态核磁共振技术对PDA的结构进行了详细研究,对在3种不同氘化方案下制备的PDA样品进行分析,发现PDA中含有大量质子化的低聚物单体,且大多数苯/吲哚环为刚性结构,这可能是由π-π堆积作用引起的。此外,该研究还对同位素和自然丰度样品进行了对比分析,证明了PDA中存在单体偶联和低聚物聚合等形成路径。Chai等[16]采用不同分析方法对PDA涂层、DHI涂层和DA/DHI涂层进行了对比研究,结果表明,DA和DHI都是PDA涂层形成的必要中间体,且DHI在控制PDA涂层厚度方面起着关键作用。另一方面,Marco等[17]对PDA水下强黏附特性的化学基础进行了研究。结果表明,除儿茶酚基外,初级氨基对PDA在基底的黏附过程也起着重要的促进作用。DA在自氧化过程中会先产生醌基,在较高DA浓度的情况下,由于多巴胺-醌或醌-醌型的双分子偶联过程,生成低聚物并产生黏附交联结构。在1 mmol/L(或更低浓度)的缓冲液中,DA的自氧化并不足以形成紫外可检测涂层,当己二胺或其他胺存在时,即可形成不同厚度的涂层。长链二胺在较低多巴胺浓度下可促进涂层的形成,且脂肪链越长,促进作用越强。这是因为脂肪链可通过占据PDA结构的关键位置或抑制分子内环化,抑制聚集体的形成,这有利于涂层的黏附。

图 2 聚多巴胺与含巯基及氨基化合物发生迈克尔加成反应示意图Fig. 2 Schematic of Michael addition reaction of PDA with amino or thiol compounds
1.2 聚多巴胺涂层的制备
PDA涂层的传统制备方法是将待涂层基底置于弱碱性DA水溶液体系中,利用溶解氧的氧化作用诱导DA逐渐自聚合为PDA,并原位沉积于基底表面。该方法的涂层沉积速度很慢,往往需要数十小时的反应才能获得较为理想的涂层效果,因此发展PDA涂层的快速沉积方法是增强PDA涂层实用性的重要手段。影响PDA沉积速率的因素有很多,包括DA浓度[18]、缓冲溶液的pH值[19]和类型[20],以及氧化剂的种类和浓度[21]等。在这些因素中,氧化剂对PDA涂层沉积速度的影响尤为重要。Ouyang等[21]首先发现强氧化剂过硫酸铵能显著加速PDA的形成速度,即使在中性水溶液体系中也能引发DA的自聚合反应。之后,Wei等[22]进一步利用过硫酸铵的强氧化性,成功诱导DA在酸性水溶液中聚合为PDA。Ponzio等[23]比较了3种不同氧化剂(过硫酸铵、高碘酸钠和硫酸铜)对PDA沉积的影响。结果表明,高碘酸钠引发的DA聚合可获得最大PDA膜厚度。此外,Zhang等[24]利用硫酸铜/双氧水复合体系引发DA加速聚合,该方法所获得的PDA沉积速率与过硫酸铵体系相当,可达43 nm/h。除了化学氧化剂之外,Du等[25]发现利用紫外光辐照产生的活性氧也可促进PDA在基底表面的沉积,且涂层反应的进行与否可通过光辐照作为“开关”实时加以控制。另一方面,Lee等[26]发现微波辐射也是一种加速PDA沉积的有力手段:DA向PDA转化的早期阶段由溶解氧引发;随后,微波加热诱导产生的大量自由基可促进PDA涂层的快速形成。此外,苏磊研究组[27]利用振荡法制备聚多巴胺涂层,涂层表现出超亲水性,良好的抗牛血清蛋白(BSA)、大肠杆菌和金黄色葡萄球菌吸附的性能。该制备方法简便易行,涂层具有良好的抗生物污染性能。
PDA不仅能直接沉积在各种基底表面达到改性修饰的目的,还可作为二次反应平台辅助固定其他功能分子,从而赋予基底表面以更多功能特性。例如,含有氨基、巯基等基团的化合物可通过席夫碱反应或迈克尔加成反应固定于PDA涂层表面(见图2)。因此,通过PDA辅助制备各类功能化表面涂层材料是增强PDA涂层实用性的另一重要手段。例如,Li等[28]首先基于PDA的强黏附性质制备了PDA涂层聚苯乙烯微球,然后利用PDA对仿生硅化反应的促进作用,在PDA功能化聚苯乙烯微球表面原位生长二氧化硅纳米颗粒,进而利用硅烷化反应将疏水性烷基链修饰在二氧化硅纳米颗粒表面,成功制备出兼具超疏水和超亲油特性的覆盆子状复合纳米粒子。
上述基于多步反应的PDA介导功能化涂层策略过程繁杂,制备效率较低。2012年,Lee等[29]提出了PDA与其他功能分子一步共沉积涂层策略,即将待涂层基底置于DA和其他功能分子的混合溶液中,在DA氧化自聚合形成PDA的同时,与之共存的功能分子也会与PDA一起共沉积涂层于基底表面。在此之后,PDA辅助一步共沉积原理作为一种灵活简便的功能化涂层方法受到了相关领域研究者越来越多的关注。Zhang等[30]利用氢键作用成功地将聚乙二醇、聚乙烯吡咯烷酮和聚乙烯醇等亲水性高聚物与PDA共沉积涂层在硅片表面。宁成云课题组[31]利用一步电化学聚合法在7 075铝合金表面制备了聚吡咯/聚多巴胺(PPy/PDA)复合涂层,PPy高分子链和PDA高分子链之间形成网络互穿结构,能很好地阻止氯离子等穿透涂层腐蚀基底,显著提高了铝合金有机涂层的耐蚀性。
PDA涂层反应通常在水相体系中进行,导致上述PDA辅助一步共沉积涂层方法与疏水性功能分子的兼容性较差,难以直接固定疏水性功能材料。针对这一问题,You等[32]提出利用哌啶作为DA在纯有机溶剂中氧化聚合反应的引发剂,在纯乙醇体系中成功制备出PDA涂层。该方法是基于有机溶剂体系进行涂层反应,因此能与疏水性功能分子兼容。在这一研究基础上,Liu等[33]进一步将各类具有不同程度碱性的有机胺作为DA脱质子反应的引发剂,诱导DA在纯有机溶剂中大量转化为自由基中间体,进而促使DA通过自由基反应历程交联聚合形成PDA涂层。这种有机相中直接形成PDA涂层的方法具有较强的普适性和灵活性,不仅可通过改变有机胺的浓度或者种类来对PDA涂层的形成过程加以调控,也能用于PDA与其他疏水性功能分子的一步共沉积,有助于拓展PDA辅助一步共沉积涂层方法的应用潜力。
2 聚多巴胺涂层OT-CEC
2.1 聚多巴胺及其类似物直接作为OT-CEC固定相
近年来,基于PDA的功能化涂层材料在OT-CEC领域得到了广泛应用,按照其制备方法可分为PDA及其类似物直接涂层OT-CEC、PDA二次功能化OT-CEC及PDA介导一步共沉积涂层OT-CEC 3大类。Yin等[11]首次利用PDA涂层作为OT-CEC的固定相,用于分离4种生长素,分离的机制可能是π-π相互作用或亲疏水相互作用。该方法利用溶解氧诱导灌注于毛细管内的DA溶液氧化自聚合成PDA并原位沉积于毛细管内壁,即为PDA涂层OT-CEC柱。由于溶解氧的含量及氧化能力有限,PDA的沉积效率偏低,因此该研究采用了多次重复涂层的方法来增加PDA涂层的厚度,制备效率较低。为此,Xiao等[34]使用强氧化剂过硫酸钠加速PDA在毛细管中的沉积速率,制备的PDA涂层含有丰富的羧基,具有强亲水性能,可抑制蛋白质的吸附,将获得的PDA涂层柱用于蛋清和纯牛奶样品中蛋白质的分离分析。该方法能显著缩短PDA的涂层时间,提高了开管柱的制备效率。另一方面,PDA涂层在表面分子印迹聚合物(MIP)制备领域也有一定的应用潜力:DA本身可作为功能单体,其后续氧化聚合形成PDA的反应为自发进行,无须额外引入特殊的引发剂和交联剂,简便易行。据此,Wang等[35]首先以四氧化三铁(Fe3O4)纳米颗粒(NPs)为载体,DA为功能单体,L-色氨酸、L-酪氨酸或S-氧氟沙星等为模板分子,制备了一系列PDA涂层磁性分子印迹微球;随后利用外加磁场将其吸附于微芯片电泳的分离通道内壁;进而基于这些PDA-MIP涂层固定相对手性模板分子的特异性结合能力,成功实现了这几种手性化合物的CE手性分离分析。聚醚醚酮(PEEK)材料具有耐高压和高强度等优良性能,常作为毛细管电泳-质谱联用技术(CE-MS)的固定相和喷雾发射极。但PEEK毛细管由于其内表面呈化学惰性,直接用于CE分离通道时容易造成分离效能偏低、EOF大小难以调控且稳定性差等问题。Zhou等[36]利用PDA涂层修饰PEEK毛细管,使其内表面富含氨基、酚羟基等活性功能基团。实验结果表明,该PDA修饰PEEK毛细管柱的EOF灵活可控,对氨基酸、酚类、植物激素等几类带电化合物具有良好的分离性能。
L-去甲肾上腺素(L-NE)与左旋多巴(L-DOPA)是DA的手性类似物,在弱碱性条件下也可以发生氧化自聚合,形成具有较强黏附性的聚去甲肾上腺素(PNE)与聚左旋多巴。受此特性启发,Qiu等[37]将L-NE的弱碱性溶液填充到毛细管内,利用溶解氧诱导PNE原位生长于毛细管内壁,成功制备了手性PNE涂层OT-CEC柱,并用于组氨酸、苯丙氨酸和缬氨酸3种氨基酸对映体的手性分离。这一结果暗示由手性L-NE分子自发聚合而成的PNE也具有一定数量的手性功能基团,但具体的手性识别与分离机制还有待研究。Chen等[38]利用CuSO4/H2O2体系所产生的活性氧作为引发剂,诱导L-DOPA在毛细管内快速自聚合形成手性聚左旋多巴并沉积在毛细管内壁。该聚左旋多巴涂层柱具有良好的手性分离性能,可对胺类药物和氨基酸等多类手性化合物实现手性分离。除了NE与L-DOPA之外,DA的类似物还有很多。这些DA类似物一方面继承了DA的强表面黏附性等优良特性,另一方面还可能具有DA所不具备的手性等特殊性质,因此在功能化OT-CEC涂层柱制备领域有着较大的应用潜力。
2.2 聚多巴胺二次功能化OT-CEC
虽然PDA及其类似物可直接用作OT-CEC的固定相,但是由于涂层前驱体的种类不够丰富,PDA及其类似物涂层固定相的表面性质与功能较为单一,难以满足各类复杂样品的多样化分离需求。为了拓展PDA在OT-CEC中的应用潜力,有必要对其进行二次功能化修饰,PDA结构中富含的酚羟基、醌基、氨基和羧基等官能团,可通过迈克尔加成或席夫碱反应,与金属离子的螯合或氧化还原反应以及静电吸附和氢键等非共价相互作用,将一系列功能材料固定于涂层表面,进而制备出具有强亲/疏水、π-π堆积、阳离子-π以及亲和作用等保留机制的功能化表面涂层材料。截至目前,许多功能分子如聚合物、生物材料和纳米材料等已被用于PDA涂层柱的二次修饰,显著提升了PDA在OT-CEC中的应用价值。
2.2.1聚多巴胺辅助固定聚合物
CE用于蛋白质等复杂生物样品的分离时,生物大分子易吸附在毛细管内壁上,可造成峰形拖尾、重现性变差、分离效率下降等问题。在毛细管内壁修饰亲水性聚合物涂层以抑制生物大分子的吸附是解决这些问题的有效办法。Zeng等[39,40]利用PDA作为基底涂层,将一系列带有氨基的亲水性聚合物(包括聚乙二醇、两性离子聚合物[41]以及聚(2-甲基-2-唑啉)[42])通过迈克尔加成或席夫碱反应固定到PDA涂层毛细管内壁上,所获得的亲水性功能化毛细管柱具有很好的抑制蛋白质吸附性能,已成功应用于蛋白质混合样品以及食品蛋白的分离分析。另一方面,该研究组利用聚乙二醇甲基醚甲基丙烯酸酯(PEGMA300)和2-氨基乙基甲基丙烯酸酯(AEMA),通过原子转移自由基聚合(ATRP)法合成了聚(PEGMA300-co-AEMA),并利用PDA的二次反应活性,将聚(PEGMA300-co-AEMA)共聚物固定在PDA修饰的毛细管内壁上,以用于蛋白质的分离分析[43]。此外,该研究组还通过ATRP法合成了一种由甲基丙烯酸磺甜菜碱(SBMA)和AEMA组成的两性离子共聚物(SBMA-co-AEMA),进而利用相似的策略制备了两性离子共聚物/PDA涂层毛细管柱,最终成功将其用于溶菌酶、细胞色素C和核糖核酸酶A等4种蛋白质的CEC分离分析[41]。
2.2.2聚多巴胺辅助固定生物材料
生物材料具有良好的生物相容性和对特定类型目标分析物的选择性亲和性,在分离领域受到广泛关注。Martma等[44]报道了利用PDA涂层作为生物材料(如细胞膜碎片溶液、磷脂混合物和线粒体)的黏合剂制备生物材料涂层OT-CEC柱。结果表明,该方法制得的生物材料涂层柱可实现对4种阴离子化合物(芦丁、槲皮素、咖啡酸和水杨酸)的高效CE分离,分离的机制可归结为PDA涂层引入的疏水、静电等相互作用。此外,Chen等[45]提出了利用PDA和透明质酸(HA)制备功能化OT-CEC柱的新方法。具有强亲水性能的HA通过静电相互作用与PDA相结合并固定于毛细管内壁,所制得的HA改性涂层柱能有效抑制蛋白质的吸附,20 min内可实现溶菌酶、细胞色素C、BSA和核糖核酸酶A等蛋白质的基线分离。许多生物材料本身存在手性结构,具有手性识别位点,可用于手性涂层毛细管柱的构建。Qiu等[46]报道了利用PDA涂层作为二次反应平台,将BSA固定在聚二甲基硅氧烷(PDMS)微通道内壁,进而构建手性选择性OT-CEC柱的简便方案。PDA良好的生物相容性有助于维持BSA的手性选择性和生物活性。该研究组利用制备出的BSA功能化芯片,成功实现了色氨酸、酪氨酸和苏氨酸等对映体的高效基线分离,分离机制归因于不同对映体结构与BSA结合能力不同,进而利用对映体在BSA修饰的分离通道中的保留能力不同而实现分离。
酶具有高效催化能力,将酶固定于毛细管内壁构建固定化酶微反应器(IMER),可用于在线酶分析及酶抑制剂的筛选。Cheng等[47]利用PDA基底涂层将胰蛋白酶辅助固定在毛细管内壁入口处,毛细管的其余部分用作CE分离通道,成功构建了新型IMER-CE酶分析平台。他们进一步利用该平台测定了胰蛋白酶的酶反应动力学常数,并对多种中药中可能存在的胰蛋白酶抑制剂活性成分进行了筛选研究,展示出了较大的应用潜力。另外,Wu等[48]利用PDA的黏附作用及二次反应能力建立了β-葡萄糖苷酶IMER-CE酶分析方法,并利用该平台进行了酶动力学研究和酶抑制剂筛选。他们从12种黄酮类化合物中筛选出了β-葡萄糖苷酶抑制活性组分,并通过分子对接实验进一步验证了它们与酶结合的有效性。丙氨酸氨基转移酶(ALT)在生物学和临床研究中具有重要作用。Qi等[49]开发了利用聚合物@Fe3O4纳米颗粒构建的丙氨酸氨基转移酶反应器,用于手性配体交换毛细管电泳筛选酶抑制剂。他们采用可逆加成-断裂链转移聚合法制备了聚(N-丙烯氧基丁二酰亚胺),通过丁二酰亚胺基团将聚(N-丙烯氧基丁二酰亚胺)固定在磁性Fe3O4纳米颗粒上,并利用ALT中的氨基与琥珀酰亚胺基团反应,制备出固定化酶反应器ALT@PNAS@MNPs。将ALT@PNAS@MNPs作为假固定相,在PDA涂层的毛细管中,可实现丙氨酸、谷氨酸等对映体的基线分离;而在没有涂层PDA的裸毛细管柱中,样品出峰时间较快,没有达到基线分离。该研究组进一步将制得的固定化酶反应器用于4种谷丙转氨酶抑制剂D-环丝氨酸(DCS)、壳聚糖(CTS)、牛磺酸去氧胆酸(TDCA)和卡托普利(CAP)的酶抑制研究,结果表明,4种抑制剂的抑制顺序为DCS>TDCA>CTS≫CAP。
2.2.3聚多巴胺辅助固定纳米材料

多孔超分子框架结构材料具有超高的比表面积和孔隙率,且框架结构和孔隙尺寸灵活可调,在色谱分离中具有良好的应用前景。截至目前,用于CEC分离的多孔框架结构材料主要有金属有机骨架(MOFs)和共价有机骨架(COFs)。它们均具有较大的比表面积,永久的孔隙率和良好的稳定性。PDA含有丰富的氨基和邻苯二酚基团等反应位点,可与金属离子发生较强的配位相互作用,因此适用于MOFs涂层OT-CEC柱的构建。Chen等制备了一系列MOFs材料(包括ZIF-8[55]和Zn2L[56]),通过共价和非共价相互作用固定在PDA修饰的毛细管内壁,进而制备出一系列新型MOFs涂层OT-CEC柱,并成功用于酸性、碱性和中性化合物的高效分离分析,分离的机制可归结为化合物与涂层之间的偶极-偶极相互作用、阳离子-π交互作用等。COFs是由有机配体通过共价键连接而成的,在色谱分离领域中具有与MOFs相当的巨大应用潜力。然而,与MOFs相比,COFs不含金属离子,其固定化操作更具有挑战性。COF-5由1,4-苯二硼酸(BDBA)和2,3,6,7,10,11-六羟基三亚苯(HHTP)组成,而HHTP含有和PDA涂层相似的儿茶酚结构。受此启发,Bao等[57]使用BDBA作为连接剂将COF-5固定在PDA涂层毛细管内壁上,结合层层自组装策略提高相比,制备出的COF-5涂层柱具有较大相比,且具有反相作用机理。利用几种化合物疏水性和电子密度的差异以及π-π堆积相互作用等,可实现几种中性、酸性和碱性化合物的基线分离。
其他多种纳米材料也可以通过PDA辅助固定原理制成功能化OT-CEC柱。Zhang等[58]利用PDA介导生物矿化原理在PDA涂层毛细管内原位生长纳米羟基磷灰石(HAP),在毛细管内壁引入偶极-偶极相互作用,阳离子-π相互作用、疏水作用、π-π交互作用等保留机制,制备出的HAP涂层OT-CEC柱可用于分离烷基苯、酚和胺类化合物。层状双金属氢氧化物(LDHs)是一类由带正电荷的金属氢氧化物和层间填充可交换的阴离子所构成的层柱状化合物。Yu等[59]基于金属离子与PDA涂层上酚羟基独特的配位结合作用,将LDHs原位生长在PDA修饰的毛细管内壁,并用于中性和酚类化合物的CE分离分析,相关的分离机制可归结为儿茶酚和LDHs之间的配位效应、阳离子-π相互作用和疏水作用。
2.3 聚多巴胺介导一步共沉积涂层OT-CEC
如前所述,利用PDA涂层的二次反应能力可将很多种类的功能化材料固定在毛细管内壁,拓宽了PDA在OT-CEC固定相制备领域的应用潜力。但是,这种基于多步反应的PDA辅助修饰策略不仅过程繁杂,制备效率较低,而且可兼容的功能化材料种类有限。相比之下,PDA辅助一步共沉积涂层原理更为简便灵活,适用范围更为广泛。2018年,Xu课题组[60]对PDA共沉积机制进行了分类和讨论,总结了PDA一步共沉积涂层在材料科学,特别是分离膜和生物材料方面的潜在应用。同时,该方法在功能化OT-CEC固定相制备领域的应用潜力也已经显现。Chen等[61]将聚丙烯酰胺(PAM)与DA的混合溶液注入毛细管内,在溶解氧的氧化作用下逐渐在毛细管内壁原位形成PDA/PAM共沉积涂层。与PAM直接涂层方法相比,PDA的引入能显著提升PAM固定效果的稳定性。PAM的强亲水性能,可抑制蛋白质的吸附,制备的PDA/PAM共沉积柱可用于碱性蛋白质混合样品及鸡蛋清蛋白的高效基线分离。另外,Yan等[62]将具有强亲水性能的梳状共聚物聚(2-甲基-2-恶唑啉)(PMA)与DA共分散溶解于Tris-HCl体系中,利用CuSO4/H2O2触发DA快速自聚合形成PDA,使PMA与PDA快速共沉积涂层于基底表面。所获得的PDA/PMA共沉积涂层具有良好的蛋白质抗性,而且能抵抗几乎所有血小板的黏附。该研究组进一步将其应用于毛细管内壁的表面改性,所制得的PMA功能化涂层柱在碱性蛋白混合物和蛋清蛋白的CE分离中展现出了良好效果。
Zhang等[63]将具有优异防污性能的2-甲基-2-恶唑啉(PMOXA)与DA混合后一步共沉积涂层于毛细管内壁,制备了具有强抑制蛋白质吸附性能的PMOXA抗污涂层毛细管柱。因此,该涂层柱可成功用于奶粉中乳清蛋白和乳白蛋白的分离分析。在优化条件下,对脱脂奶粉中三聚氰胺的浓度进行了测定,三聚氰胺的检出限(LOD)可达0.097 mg/mL。此外,PMOXA防污材料在研究蛋白质与药物的相互作用中也具备较大潜力。Du等[64]合成了聚乙烯亚胺-g-2-甲基-2-恶唑啉(PEI-g-PMOXA)抗污聚合物,并与PDA共沉积涂层于毛细管内壁,用于对乙酰氨基酚与BSA的相互作用的分析,其结果具有较好的准确性。本研究组[65]采用共沉积涂层策略,在毛细管内壁同时沉积PDA和PEI,并引入Fe3+后处理操作以进一步增强所得涂层的稳定性。通过改变PDA/PEI的质量比或PEI的相对分子质量等制备参数,可对PDA/PEI共沉积涂层柱EOF的大小和方向进行大范围的灵活调控。利用这些具有不同EOF性质的涂层柱,成功实现了对芳香酸和苯胺类化合物的高效基线分离(见图3)。
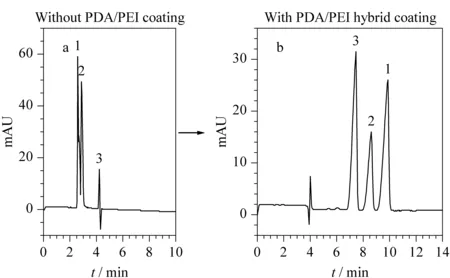
图 3 PDA/PEI共沉积涂层修饰(a)前、(b)后毛细管柱对苯胺类化合物的分离色谱图Fig. 3 Separation chromatograms of aniline compounds in OT-CEC column (a) before and (b) after modification of polydopamine/polyethyleneimine (PDA/PEI) hybrid coating 1. p-anisidine; 2. N,N-dimethylaniline; 3. p-toluidine.
受β-环糊精(β-CD)强手性识别能力和PDA强黏附性等性质的启发,Guo等[66]利用一步共沉积策略将PDA/β-CD共同涂覆于毛细管内壁,并对该β-CD涂层柱的手性分离性能进行了评价。结果显示,在所考察的7种手性药物中,有4种对映体可在该涂层柱上实现CE基线分离,其余手性药物也有一定程度的分离效果。因此,可推断有较多数量的β-CD是镶嵌固定在共沉积涂层中,其暴露在涂层表面的腔体结构可与手性对映体产生不同程度的包络作用。
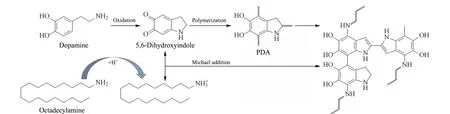
图 4 PDA/ODA共沉积反应示意图Fig. 4 Reaction schematic for the co-deposition of PDA and octadecylamine (ODA)
Qiu等[67]基于DA对重金属离子的螯合反应和还原能力,结合一步共沉积涂层策略,成功制备了具有较高相比的PDA/AuNPs涂层芯片CEC。微芯片通道内壁的亲水性得到显著改善,以此分离介质能对5种氨基酸(精氨酸、脯氨酸、组氨酸、缬氨酸和苏氨酸)实现快速、高效分离。具体来说,该方法是将DA和氯金酸的混合溶液共同注入PDMS微通道内,一方面氯金酸作为氧化剂可促进DA快速自聚合形成PDA,另一方面DA可将氯金酸还原为纳米金;所形成的PDA与纳米金之间具有较强的螯合作用,可一步快速共沉积到芯片通道内。Zhang等[68]采用类似策略在芯片CE的微通道内壁修饰PDA/AuNPs涂层,进而利用Au-S键作用将硫代脱氧核糖核酸固定在PDA/AuNPs改性微通道表面,最终制成PDA/AuNPs/DNA复合功能涂层芯片CEC。由于DNA具有独特的手性螺旋结构和手性识别能力,该手性功能化芯片CEC可用于分离色氨酸对映体:在优化条件下,65 s内实现了色氨酸对映体的基线分离,分离度可达2.95。本研究组[69]在此基础上,综合利用PDA涂层的多种物理化学特性,并结合一步共沉积和层层自组装涂层策略,成功制备了具有较高相比的PDA/AuNPs/硫醇(thiols)层层自组装涂层OT-CEC柱。由于硫醇含有长疏水烷基链,制得的毛细管柱具有较强的反相保留作用。随着自组装层数的增加以及共沉积纳米金数量的增多,PDA/AuNPs/thiols涂层柱固定相的比表面积和相比相应增加,对5种烷基苯化合物的分离效能也逐渐得到提升。在优化制备条件下,该疏水功能化涂层柱能够实现对烷基苯类化合物的高效基线分离。

图 5 裸毛细管、聚多巴胺涂层毛细管和不同层数聚多巴胺/硬脂胺共沉积涂层毛细管对烷基苯类化合物的分离色谱图 Fig. 5 Separation chromatograms of alkylbenzenes in bare, PDA coated and PDA/ODA co-deposited OT-CEC columns with different coating times 1. benzene; 2. methylbenzene; 3. ethylbenzene; 4. n-propylbenzene.
现有PDA介导一步共沉积涂层OT-CEC柱的相关研究主要是在水相体系中进行[70,71],这导致共沉积涂层方法与疏水性功能分子的兼容性较差,难以直接固定疏水性功能材料。近期,在有机溶剂中利用有机胺辅助制备功能化PDA涂层的新策略已被提出[32]。受此启发,本研究组[72]首次将PDA在有机相中的涂层方法和一步共沉积涂层原理共同引入到功能化OT-CEC柱的制备领域,成功制备出具有反相作用机理的PDA/硬脂胺(ODA)共沉积涂层OT-CEC柱(见图4),并用于烷基苯和黄体酮等中性化合物的高效分离分析。在这项研究中,ODA既是PDA涂层的疏水改性剂,又是DA自聚合反应的引发剂:一方面ODA作为有机碱可诱导DA在无水乙醇中发生氧化自聚合形成PDA;另一方面具有氨基的ODA又可与PDA发生共价交联反应,最终导致PDA与ODA共沉积涂层于毛细管内壁。PDA/ODA涂层柱因掺杂有ODA的十八烷基链而具有较强的疏水性;结合重复涂层操作可进一步增强其疏水性,对于疏水性化合物的分离能力也相应增强(见图5)。
3 聚多巴胺修饰CEC整体柱
聚多巴胺不仅可作为毛细管内壁的涂层材料应用于OT-CEC,也可用于制备功能化整体柱。Ji等[73]利用溶胶-凝胶方法以及PDA的强表面黏附性制备了PDA修饰硅胶基质的氧化石墨烯-聚多巴胺(GO-PDA-CSM)毛细管电色谱整体柱,并将其用于氨基酸和苯胺类化合物的CE分离。结果显示,相比于PDA涂层OT-CEC柱,PDA修饰整体柱具有更大的相比和更多的相互作用位点,对这两类待测样品的分离能力也更强。该研究组进一步利用PDA的二次反应活性,通过GO上的羧基或环氧基与PDA上的氨基进行化学反应,制备了GO及PDA双功能化修饰的硅胶基质毛细管电色谱整体柱,并将其应用于烷基苯类化合物以及麻黄碱/伪麻黄碱异构体的分离分析。与PDA涂层整体柱和GO修饰整体柱相比,GO/PDA双功能化整体柱具有更高的分离效能,分离的机制可归结为GO与分析物之间的π-π以及疏水相互作用等,将PDA作为预涂层可增强固定相与分析物之间的相互作用。实验结果表明,GO对麻黄碱/伪麻黄碱异构体的分离起着重要作用,而PDA作为中间涂层,可以大大提高GO-PDA-CSM的色谱分离效能。
4 结论与展望
综上所述,PDA涂层材料以其简便易行的制备过程、优异的表面黏附性、良好的生物相容性、较强的二次反应活性和化学稳定性等优点,在毛细管电色谱尤其是OT-CEC领域获得了广泛应用,展现出了广阔的应用潜力。虽然PDA及其衍生材料在CEC领域中的应用越来越广泛,但是截至目前,研究者们对于PDA的形成和涂层机理仍然没有一个明确的定论,还需进一步的深入研究。现有技术制备出的PDA涂层厚度普遍较低且耗时较长,单次涂层厚度普遍在50 nm以下,制备时间往往长达数小时到数十小时。前期很多研究会采用重复涂层的策略以改善PDA在毛细管内的涂层效果,但是该方法更加耗时,制备效率也更低。为了提高PDA修饰CEC柱的制备效率,越来越多的研究者转而采用强氧化剂诱导PDA快速沉积策略来制备PDA涂层柱。但是这类方法所获得PDA涂层效果的可控性较差,有待于进一步探索出重现性更好且可操作性更强的PDA快速共沉积涂层CEC制备策略。另一方面,在有机相中直接合成功能化PDA涂层OT-CEC柱的策略虽然已被提出,但是其在疏水性功能材料杂化PDA涂层CEC中的应用价值还有待后续更多研究。此外,PDA涂层本身的多孔性较差,比表面积较低,将其修饰在多孔整体柱基质表面会显著改善这一问题。但是截至目前,PDA涂层在整体柱CEC领域的相关研究还很少,其应用潜力有待拓展。总之,随着PDA涂层和形成机理研究的不断深入,聚多巴胺这一延展性极强的仿生材料将会在毛细管电色谱技术的发展中发挥更加重要的作用。
