CRISPR/Cas9基因编辑技术在水生甲壳动物中的应用进展*
2020-08-26郭华荣陶奕文
郭华荣,陶奕文
(1. 中国海洋大学海洋生命学院海洋生物遗传与育种教育部重点实验室,山东 青岛 266003;2. 中国海洋大学海洋生物进化与多样性研究所,山东 青岛 266003)
甲壳动物是节肢动物门中的一个亚门,因体表有一层几丁质外壳而得名。甲壳动物的种类有2.6万种之多,大多数生活在海洋里,少数栖息在淡水中和陆地上。其中的虾蟹类营养丰富,味道鲜美,是重要的水产养殖经济品种。而另外一些小型甲壳动物则成为鱼类等经济动物的饵料或生态环境指示生物,在水生食物链中占有重要地位。
随着越来越多的甲壳动物全基因组序列的公布[1-2],其生长、发育和免疫等重要经济性状相关基因的生物学功能的研究也引起了人们更多的关注。而CRISPR/Cas9基因编辑技术因其操作简便、快速和成本低的特点,也迅速在少数几种水生甲壳动物中得到了成功应用[3-8]。但是由于显微注射技术在应用上的局限性,导致该技术在许多重要海水养殖经济物种如对虾中的应用受到限制,基因编辑效率低下,难以广泛开展。本文对CRISPR/Cas9基因编辑技术在水生甲壳动物中的应用进行了综述和展望,为今后海水养殖虾蟹类的基因功能研究以及遗传育种研究提供参考。
1 CRISPR/Cas9基因编辑技术简介
CRISPR/Cas9英文全称为Clustered regularly interspaced short palindromic repeat/CRISPR-associated nuclease 9,即成簇的有规律地间隔排列的短回文重复序列及其核酸酶9。CRISPR簇是一个广泛存在于细菌和古细菌基因组中的特殊的DNA重复序列,由一个前导区(Leader)、多个短而高度保守的重复序列区(21~48 bp,参与发夹结构的形成)和多个间隔区(Spacer,26~72 bp,来源于入侵的病毒和质粒的基因组)组成。CRISPR/Cas系统是细菌中较为有效的一种获得性免疫系统:细菌-病毒(噬菌体)[9-11]。这一发现完全颠覆了人们关于获得性免疫的概念,即并非只有抗体可以实现免疫记忆,生命在其非常原始的形态时如细菌,就已经学会利用碱基的互补配对原则,在核酸水平上实现了这种免疫记忆,只是后来进化了,有了更多的细胞分工和蛋白合成能力,才发展出抗体而取代了这一机制。细菌在与噬菌体的斗争中发展出了CRISPR/Cas系统,当细菌被噬菌体侵染后,要么死掉,要么战胜噬菌体。而胜利活下来的细菌会将噬菌体的一小段DNA片段插入自己的重复序列区中,成为一个新的间隔序列。当该病毒DNA再次进入细菌时,它就会被间隔序列所转录的gRNA(guide RNA)所识别,并激活与其结合的Cas核酸酶,切割入侵病毒的DNA双链,从而实现保护自身安全和防御入侵的目的[12-14]。
人们利用细菌中这一靶向切割基因组DNA的机制设计了CRISPR/Cas9基因编辑技术,以实现对靶基因功能的分析[15-17]。其中,Cas蛋白有10多种,但由于Cas9的酶活性较高,且不需其它蛋白的辅助,因而最先被选中。在CRISPR/Cas9基因编辑系统中,如图1所示,最初设计的CRISPR是由一个基因特异性的CRISPR RNA (crRNA,即gRNA)和一个反式激活CRISPR RNA (tracrRNA,即gRNA scaffold) 形成的短双链RNA: crRNA/tracrRNA,其与Cas9蛋白结合形成核糖核蛋白体(Ribonucleoprotein,RNP),利用其中的gRNA与靶基因的互补结合,从而引导Cas9核酸酶切割靶基因的DNA双链。后来,Jinek等(2012)发现将crRNA和tracrRNA串联形成的单个嵌合gRNA(Single gRNA,sgRNA)也可以行使双链crRNA/tracrRNA的作用,从而大大简化操作[17]。因此,之后的CRISPR/Cas9基因编辑系统主要由cas9和sgRNA两个基因编辑元件组成。当cas9和sgRNA作用于靶序列,形成DNA双链断裂后,将激活细胞内的两种DNA修复机制:同源重组修复(HDR)和非同源末端连接(NHEJ)。当NHEJ参与断裂基因的修复时,可引起基因的移码突变,导致靶基因的敲除;当系统中加入其它外源基因片段时,这些外源基因片段就有很大可能被插入靶位点,从而实现基因的敲入。
另外,Cas9核酸酶含有2个酶切活性位点:HNH 和RuvC-like,分别负责切割DNA双链的互补链和非互补链。Cas9核酸酶切割的位点为间隔序列邻近基序(Protospacer adjacent motif,PAM) 之前的第4个核苷酸处(见图1)。PAM序列具有种属的特异性,例如来自于酿脓链球菌(Streptococcuspyogenes)的SpCas9的PAM序列为NGG,而来自于金黄色葡萄球菌(Staphylococcusaureus)的SaCas9的PAM序列为NNGRRT/NNGRRN(R指A/G),来自狗链球菌Streptococcuscanis的ScCas9的PAM序列为NNGN,仅需1 个G[18]。PAM序列不属于gRNA,而是gRNA 3’末端的紧邻序列,PAM序列的存在是激活Cas9的酶活性所必需的,只有DNA靶位点附近存在PAM时,Cas9才能准确切割。
总之,CRISPR/Cas9基因编辑技术是一种由gRNA引导的Cas9核酸酶靶向编辑技术,其操作简便快速,成本低,已广泛用于基因的敲除、插入和敲降。自2013年首次应用于真核细胞的基因编辑以来,以日新月异的速度在不断发展[19-20]。不仅广泛应用于基因功能的研究和疾病的治疗[21-22],还在模式生物中用于快速制备突变个体,研究生长和发育的机制以及遗传学规律[23-24],以及重要经济物种优良性状的改良[25-26]。
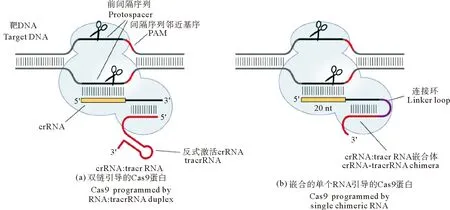
图1 双链crRNA/tracrRNA(a)和单链sgRNA(b)引导的Cas9核酸酶靶向切割DNA双链示意图[17]Fig.1 Schematic diagram of the targeted deawage of double-strand DNA by Cas9 nndease which is guided by double-strand crRNA/tracrRNA(left)and single strand RNA(Right)
2 CRISPR/Cas9基因编辑技术的效率问题
CRISPR/Cas9基因编辑技术的核心元件为sgRNA和Cas9,大量研究表明,sgRNA的准确靶向、Cas9蛋白的高效表达以及基因编辑元件的有效递送是决定该技术的靶向性和基因编辑效率的三个关键因素[27]。其中,将基因编辑元件高效递送到靶细胞内是实现基因编辑的前提条件。目前,上述基因编辑元件的递送可以通过物理方法如显微注射和电穿孔等,也可以通过生物学方法,以病毒载体(如逆转录病毒、慢病毒、腺病毒和腺相关病毒等)或非病毒载体(即表达质粒)介导[28]。目前,在模式动物中上述基因编辑元件的递送方法已很成熟。其中,显微注射到小鼠、斑马鱼和果蝇等的受精卵/早期胚胎中,或者线虫的生殖腺中是应用最广泛、最成功的递送方式[23,29-31]。在分裂活跃的哺乳动物、鱼类和昆虫的体外培养细胞系中,也有各种有效的脂质体转染方法以及病毒介导的基因转移与表达系统,可以用来递送上述基因编辑元件[32-35]。但是,对于众多非模式动物来说,往往由于缺乏有效的基因编辑元件递送工具,而严重限制了CRISPR/Cas9技术的应用[ 3,36]。
目前,sgRNA和Cas9的递送形式主要有三种:(1) DNA质粒,即编码sgRNA和Cas9的表达质粒;(2) RNA形式,即体外转录的Cas9 mRNA和sgRNA;(3) RNP形式,即sgRNA和Cas9蛋白复合物。相比较而言,以DNA质粒为递送形式,操作简单,且编辑作用持续的时间更长,但编辑效率要受到靶细胞转录和表达sgRNA与Cas9的效率的限制;以RNA或RNP为递送形式,编辑作用更快,但是需要体外制备上述编辑元件[3]。
sgRNA的准确靶向和降低脱靶率是CRISPR/Cas9基因编辑效率方面的另一备受关注的问题。为此,科学家们将Cas9蛋白的其中一个活性位点突变,构建dCas9(dead Cas9)突变体,以实现对靶基因单链的切割。然后通过在靶位点的互补链和非互补链上分别设计两个gRNA,二者相距不超过20 bp,以单链缺刻(nick)的形式打断靶基因双链,可以显著提高编辑的效率,减少脱靶率。也有科学家将Cas9的两个酶切活性位点全部突变,使其失去切割DNA活性,但是保留结合gRNA的能力,但是将其标记上报告基因如GFP或转录因子等,则可以实现靶基因的细胞定位和实时示踪。另外,科学家们通过改变了组成spCas9蛋白的1 400个氨基酸中的3个氨基酸,成功将脱靶效应降低到了几乎无法检测的水平[37]。也有人通过缩短sgRNA的长度,制造sgRNA近PAM的3’端核心序列的单碱基差异以及改变Cas9蛋白的构象等方式有效提高了基因编辑的靶向性,降低脱靶率[38-39]。
3 CRISPR/Cas9基因编辑技术在水生甲壳动物中的应用
CRISPR/Cas9基因编辑技术在节肢动物中,特别是昆虫中已经有了广泛的应用[32,36]。近几年,CRISPR/Cas9基因编辑技术在少数几种水生甲壳动物如鳃足类中的大型蚤(Daphniamagna)和蚤状溞(D.pulex)、片脚类中的夏威夷明钩虾(Parhyalehawaiensis)以及十足类中的脊尾白虾(Exopalaemoncarinicauda)中也得到了很好的应用[2-3,5-8]。这些甲壳动物均为抱卵,早期胚胎能够耐受显微注射操作。可以说,CRISPR/Cas9技术在上述水生甲壳动物中的成功应用得益于其显微注射技术的成功建立,即基因编辑元件在甲壳动物中的递送方式主要是通过显微注射,递送形式包括DNA质粒、RNA和RNP三种。但是,显微注射的方式和方法以及孵育的介质因甲壳动物种类的不同而有所不同(见表1)。详情如下。
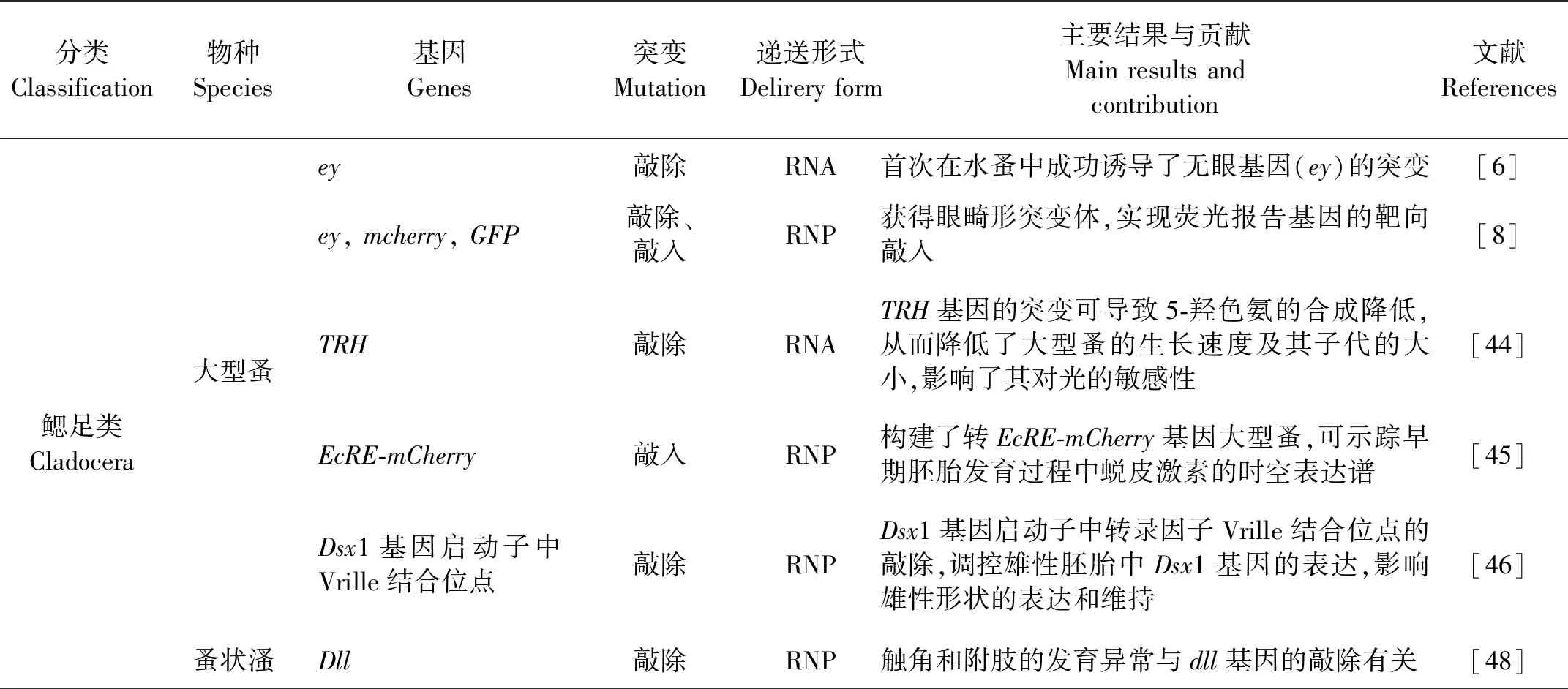
表1 CRISPR/Cas9基因编辑技术在水生甲壳动物中的应用总结

续表1
3.1 水蚤(Water flea)
水蚤是淡水生境中的小型浮游甲壳动物。由于它们在水生食物链中占有重要地位,具有高度的表型可塑性,繁殖能力强,个体小,易于观察,一直被用作基础生物学、进化和生态学研究的动物模型[40]。另外,水蚤在通常情况下是营单性生殖的,只有当其处于不利的环境条件下才会营有性生殖[41]。因此,水蚤也是研究生殖方式转换机制的难得的实验动物模型。目前,CRISPR/Cas9技术已经成功应用于两种水蚤:大型蚤和蚤状溞。
3.1.1 大型蚤(D.magna) 大型蚤无眼基因(ey)基因与哺乳动物pax6基因同源,一般认为其在眼部的发育中起着关键作用。Nakanishi等[6]首次将CRISPR/Cas9基因编辑技术应用于大型蚤ey基因的敲除,将Cas9 mRNA和 sgRNA显微注射到大型蚤的单细胞期胚胎中,成功诱导了无眼基因(ey)的突变。发现18%~47%的幼体的眼睛发育畸形,但是可发育成熟并产卵,其子一代中约有8%的个体仍然出现了眼睛畸形的表型,表明ey基因的突变表型可传递给子代。2017年Kumagai等[8]又采用CRISPR/Cas9技术靶向编辑了大型蚤ey基因的第10个外显子,基因编辑元件的递送形式采用RNP形式,即将Cas9蛋白与ey-sgRNA孵育后,注射到大型蚤的单细胞期胚胎中,成功导致靶基因的突变,观察到了眼畸形的表型,获得的体细胞诱变率和可遗传诱变率分别高达96%和40%。另外,作者还成功实现了荧光报告基因的靶向敲入,在幼体中观察到了荧光信号,而成体中只有生殖腺中可观察到荧光信号表达。
5-羟色氨是一种吲哚衍生物,最早是从血清中发现的,又名血清素,广泛存在于哺乳动物组织中,特别是在大脑皮层和神经突触内的含量很高。在昆虫中,5-羟色氨具有调控蜕皮激素和保幼激素分泌的作用,从而调控昆虫卵子的发生和卵黄的合成。在十足目甲壳动物中,5-羟色氨还具有促进生长激素的分泌、调控动物的行为和代谢的作用[42-43]。而色氨酸羟化酶(Tryptophan hydroxylase, TRH)则是5-羟色氨合成反应的限速酶。为了解甲壳动物中5-羟色氨的功能,Rivetti等[44]采用CRISPR/Cas9技术在大型蚤中成功制备了7个TRH基因的缺失突变株,并分析了这些突变株中5-羟色氨在调节大型蚤生长、繁殖和行为上的作用。结果表明,TRH是5-羟色氨生物合成中的关键酶,TRH基因的突变可导致5-羟色氨的合成降低,而5-羟色氨的缺乏不仅降低了大型蚤的生长速度及其子代的大小,还影响了其对光的敏感性。
在节肢动物的生长发育过程中,蜕皮激素在调节其胚胎发育和生长繁殖中起着非常重要的作用。Adhitama等[45]利用CRISPR/Cas9技术将蜕皮激素诱导性表达的mCherry报告基因 (Ecdysone response element (EcRE)-controlled mCherry,EcRE-mCherry) 敲入大型蚤的基因组中,构建了转EcRE-mCherry基因大型蚤,从而可以实时了解大型蚤早期胚胎发育过程中蜕皮激素的时空表达谱,同时这种转基因水蚤还可以成为监测水环境中蜕皮激素活性的指示生物。
动物的性别决定机制与其转录因子Doublesex (Dsx)的上游调控通路的差异有关。而大型蚤的环境性别决定则是通过Dsx的同源基因Dsx1在雄性个体中的特异性表达来实现的。Ishak等[46]利用CRISPR/Cas9技术靶向敲除了雄性胚胎Dsx1基因启动子中的转录因子Vrille结合位点,发现Dsx1基因的表达显著下降;在雌性胚胎中过表达Vrille基因,则上调Dsx1基因的表达,并诱导雌性胚胎产生了雄性特征。这表明,转录因子Vrille负责激活雄性胚胎中Dsx1基因的表达,促进和维持雄性形状,但是在雌性胚胎中该转录因子则被失活。
研究发现,以RNA形式,即Cas9 mRNA和 gRNA[6,44],或RNP形式,即Cas9蛋白和gRNA结合[8],显微注射到大型蚤的单细胞胚胎中都可以取得较好的基因编辑效果。显微注射需要选择2~3周大的大型蚤排卵后的1 h之内进行,注射体积要控制在0.2 nL之内,收集后的单细胞期胚胎暂存于冰浴的含80 mmol/L蔗糖的M4培养基(M4-蔗糖)中,每一个注射后的胚胎需要转移到96孔板的单个孔内,每孔添加100 mL含80 mmol/L蔗糖的M4培养基,23 ℃孵化3 d[6,47]。
3.1.2 蚤状溞(D.pulex),又称淡水枝角水蚤 在脊椎和无脊椎动物中,Distal-less基因(Dll)编码远端附肢发育所必须的转录因子的同源结构域。Hiruta等[48]通过显微注射Cas9 RNP,在淡水枝角水蚤中建立了CRISPR/Cas9基因编辑技术,设计了针对Dll基因的dll-sgRNA,并将Cas9/dll-sgRNA 核糖核蛋白复合物注射到单细胞期胚胎中,发现注射后胚胎的第二触角和附肢的发育均异常。由于在Dll靶位点检测到了缺失突变,可见基因敲除是成功的,实验中观察到的触角和附肢的发育异常与dll基因的敲除有关。其中,第二触角和附肢的发育有严重缺陷的突变体不能顺利蜕皮,在成体前死亡,而有轻度或无表型缺陷的突变体是可存活的,并且可育的。
在淡水枝角水蚤的显微注射条件方面,也可以通过显微注射Cas9/sgRNA SNP到单细胞胚胎中来实现基因编辑,所需胚胎也是来源于至少2周大的淡水枝角水蚤,在其排卵后1 h之内收集,但是,收集后的单细胞期胚胎要暂存于冰浴的含60 mmol/L蔗糖的M4培养基(M4-蔗糖)中。注射完成后,转移到含2%琼脂和M4-蔗糖的6孔培养板中,18 ℃孵化[48]。
3.2夏威夷明钩虾(P. hawaiensis)
夏威夷明钩虾是生活于浅水区的海洋片脚类甲壳动物,以碎屑为食。在26 ℃下的胚胎发育大约需要10 d,生命周期为7~8周[49]。其身体结构是片脚类的典型代表。由于夏威夷明钩虾全年都可以繁殖,且拥有典型的身体结构,使其成为重要的新兴模式生物[50]。
在两侧对称动物中,Hox基因对于维持身体的前后和左右对称至关重要。Serano等[51]对夏威夷明钩虾的Hox基因进行了克隆、表达和基因组结构分析,并通过CRISPR/Cas9介导的同源重组技术,靶向敲入了eGFP基因,示踪了触角足突变基因(Antennapedia,Antp)的组织表达谱,发现该基因仅表达于前胸部,为解析Hox基因在节肢动物发育和进化中的作用奠定了基础。
Martin等[7]将CRISPR/Cas9靶向诱变技术和RNAi敲除技术联用,在夏威夷明钩虾中解析了6个Hox基因:Ubx、abd-A、Abd-B、Antp、Scr和Dfd的功能。发现基因Ubx的表达可抑制颚部的发育,但促进鳃的发育;基因Abd-A和Abd-B是身体后部附肢的正确发育所必需的;基因Antp决定了爪的形态;基因Scr和Antp与颚肢的发育有关;基因Dfd与触角的发育有关。总之,上述研究结果很好地揭示了不同Hox基因的时空表达是如何调控附肢的发育的。
在夏威夷明钩虾的显微注射条件方面,基因编辑元件可以RNA 形式,也可以RNP形式,通过显微注射递送至胚胎中,实现对靶基因的定向编辑。其中,Martin等[7]是以1∶2的摩尔比将Cas9 mRNA和sgRNA混合,注射体积约为40~60 pL,注射剂量为400~600 ng/μL RNP。而Serano等[51]则是将333 ng/μL Cas9蛋白与200 ng/μL sgRNA的剂量注射于胚胎中。注射用的单细胞期胚胎需要在前一天晚上收集,并置于过滤消毒海水中,于18 ℃条件下培养。后来,Farboud等[28]又进一步改进了显微注射的条件,即在2 μmol/L Cas9蛋白与4~8 μmol/L sgRNA的RNP复合物中添加0.05%酚红,室温孵育10 min后,再显微注射到胚胎中,然后将注射后胚胎转移到培养皿中,置于密封良好的塑料器皿中,内衬湿纸巾以保持湿度,置于26 ℃培养箱中培养,设置12 h/12 h的明暗周期。
3.3 脊尾白虾(E. carinicauda)
脊尾白虾为十足目甲壳动物,生活于咸淡水中,生长发育速度快,繁殖周期短,是很好的甲壳动物实验模型。近年来,随着人工繁育技术的日渐成熟,脊尾白虾也发展成为中国一种重要水产养殖经济品种[52]。近几年,CRISPR/Cas9基因编辑技术也已在脊尾白虾中得到成功应用。
节肢动物的外骨骼是由几丁质和硬化蛋白构成的刚性支架。为了生长和发育,节肢动物已经发展出一种蜕皮机制来定期替换它们旧的外骨骼[53]。在蜕皮过程中,几丁质酶在降解旧角质层的过程中起主导作用[54-56]。Gui等[57]克隆了脊尾白虾的几丁质酶4(Chitinase 4)(EcChi4),并采用CRISPR/Cas9技术成功敲除了脊尾白虾的EcChi4基因,并发现这种突变可以遗传给下一代。基因编辑元件的递送形式为RNA,即Cas9 mRNA和EcChi4-gRNA。作者针对脊尾白对虾的发育特点所建立的显微注射方法,为CRISPR/Cas9技术在脊尾白虾中的进一步应用奠定了技术基础。随后,Sun等[58]进一步发现脊尾白虾的EcChi4基因主要表达于肝胰腺,且在感染副溶血性弧菌或嗜水气单胞菌后会上调表达。于是作者利用CRISPR/Cas9技术将EcChi4基因敲除,发现当脊尾白虾受到副溶血性弧菌或嗜水弧菌的攻击时,EcChi4基因敲除组的死亡率明显高于野生型脊尾白虾,表明EcChi4基因参与了脊尾白虾的免疫防御作用。由于无脊椎动物在免疫防御过程中会大量释放活性氧,以阻止外来病原微生物的入侵,但活性氧在体内的大量累积会造成严重的细胞损伤,而类胡萝卜素可以作为氧自由基清除剂对机体起到保护作用。类胡萝卜素异构加氧酶(Carotenoid isomerooxygenase,EcNinaB-X1)是一种类胡萝卜素加氧酶,具有降解类胡萝卜素的作用。 Sun等[59]采用CRISPR/Cas9技术敲除了脊尾白虾EcNinaB-X1基因,发现该突变体在受到副溶血性弧菌或嗜水弧菌的攻击时存活率明显高于野生型。同年,Sun等[60]又敲除了脊尾白虾另一个类胡萝卜素加氧酶基因:β, β-胡萝卜素 9’, 10’-加氧酶(EcBCO2),得到的突变体的肝胰腺呈现更深的橙色,并且具有更高的抗病性。因此,该基因可以作为对虾分子标记辅助育种的候选基因,用于培育抗病抗逆对虾。
在甲壳动物中,蜕皮抑制激素(Molt-inhibiting hormone, MIH)是一种重要的负调控因子,在抑制蜕皮过程中起着关键作用。Zhang等[61]利用CRISPR/Cas9技术敲除了脊尾白虾EcMIH基因,并分析了基因敲除脊尾白虾的表型变化。从注射的250个胚胎中,共筛选出12个敲除虾(EcMIH-KO),突变率高达4.8%。发现EcMIH-KO虾的体长明显增加,幼虫的变态时间明显缩短,而且EcMIH-KO虾未出现死亡和畸形等问题,为对虾的分子遗传育种奠定了技术基础。
在脊尾白虾的显微注射条件方面,基因编辑元件的递送均是采用RNA形式,注射到单细胞期胚胎中。其中,收集的单细胞胚胎首先暂存于4 ℃无菌海水中,然后以200 ng/μL Cas9 mRNA和100 ng/μL sgRNA 的剂量注射,注射后胚胎马上转移到含有灭菌海水的培养皿中,室温下于100 r/min的速度于摇床上培养。15 d后,脊尾白虾即可孵化出来[57-61]。
4 结语和展望
CRISPR/Cas9基因编辑技术因其简单、快速和成本低的特点,自建立以来就广受欢迎,很快被应用到各种动物、植物及其体外培养细胞的基因编辑研究中,成为人们探究基因功能、修复受损基因、沉默有害基因以及改良经济物种种质性状的重要工具,大大推动了生物学领域的研究与发展。目前,该技术仅在少数几种水生甲壳动物包括两种水蚤(大型蚤和蚤状溞)、夏威夷明钩虾和脊尾白虾中得到了很好的应用。但是,几种重要的海水养殖经济虾类如刀额新对虾(Metapenaeusensis,俗称基围虾)、南美白对虾(Litopenaeusvannamei)、日本囊对虾(Penaeusjaponicus)和中国对虾(Fenneropenaeuschinensis)中却未见任何相关报道。造成这一困局的主要原因是显微注射技术在应用上的局限性。不难看出,水蚤、夏威夷明钩虾和脊尾白虾均是抱卵,其早期胚胎能够耐受显微注射操作,也就是说,CRISPR/Cas9基因编辑技术在上述4种小型甲壳动物中的成功完全得益于显微注射技术的建立。而上述几种对虾产卵后,均不抱卵,其受精卵为均黄卵,针刺后极易破裂,导致显微注射后胚胎的孵化率很低,又由于对虾受精卵的卵裂速度快,40~55 min即完成第一次卵裂,限制了可注射胚胎的数量,进而导致对虾的基因编辑效率低下。因此,亟需开发其它温和的递送方式,例如对虾病毒介导的基因递送工具以及纳米递送载体等,以解决目前对虾基因编辑效率低下,难以广泛开展的问题。
蟹也是中国一种重要的人工养殖经济物种,如淡水生活的中华绒螯蟹、海水生活的三疣梭子蟹和拟穴青蟹,其生长发育和抗逆抗病相关基因的功能研究也日益得到人们的关注。但是,CRISPR/Cas9基因编辑技术在蟹类中的应用尚未见任何成功报道。在蟹类中缺乏有效的基因编辑元件(Cas9和sgRNA)递送方法或递送工具,可能也是限制CRISPR/Cas9技术在蟹类中应用的主要原因,因为这是在非模式动物中开展基因编辑工作的前提条件和亟待解决的瓶颈问题。
随着越来越多的水生甲壳动物如南美白对虾[1]的全基因组测序结果的公布,CRISPR/Cas9基因编辑技术应用于甲壳动物中的条件将日趋成熟。因此,发展高效的甲壳动物基因递送工具是势在必行的,一旦突破,必将推动甲壳动物在生态、遗传、发育和进化等各方面研究的飞速发展。当然,CRISPR/Cas9基因编辑技术仍然存在脱靶问题,但随着哺乳动物中CRISPR/Cas9基因编辑技术的不断发展和日臻完善,将大大促进其在甲壳生物基因功能研究中的的应用。
