黄海大型底栖动物食物网结构和营养关系研究*
2020-08-26刘晓收倪大朋张志南
刘晓收,倪大朋,钟 鑫,张志南
(1. 中国海洋大学海洋生命学院,山东 青岛 266003; 2. 中国海洋大学海洋生物多样性与进化研究所,山东 青岛 266003)
食物网是生态系统中多种生物及其营养关系的网络,是生态学上最经典的概念之一[1]。食物网描述了生物群落内不同生物体之间复杂的营养相互作用,并整合了生态系统水平上的物质和能量流动过程[2-3]。研究食物网可以了解生态系统的物质循环和能量流动过程、生物群落组成、结构以及物种之间复杂的取食关系[2,4]。底栖食物网是海洋食物网的主要组成部分,海洋生态系统的重要环节。底栖生物是海洋生态类群中物种多样性最高的类群,现在已知80%的底栖生物集中在沿岸浅海陆架[5]。海洋底栖动物中许多种类是经济鱼虾蟹的天然饵料,有些是水产养殖和捕捞对象,而且底栖动物还是生物监测的敏感指示生物[6]。尤为重要的是,底栖动物在海洋生态系统的能量流动和物质循环中起着承上启下的作用,一方面摄取底栖微藻、底栖细菌和沉积物有机质等初级生产者、分解者、有机碎屑以及其他底栖动物,另一方面为更高营养级提供食物来源[7]。因此,底栖食物网动态变化过程与海洋生态系统中有机质的传递过程有密切的关系[8]。
搞清生态系统中各物种间的营养关系是建立食物网的主要途径。传统的研究方法是食性分析法,主要是消化道内含物法,通过分析捕食者消化道内含物的种类组成和数量,确定食物网的基本结构和食物关系[9]。该方法的优点是直观,但采样量大,带有偶然性,且结果倾向于保留在消化道内的难消化食物[10-11]。近年来,稳定同位素示踪技术广泛应用于水域食物网中,用于揭示有机物质的循环途径和探究消费者之间的营养关系[12]。该方法所取样品是生物体的一部分或全部,得到的数据反映的是生物长期生命活动的结果[13],且可以分析食物网的动态变化过程[14]。利用生物天然碳氮稳定同位素可以有效地揭示其有机物来源、消费者的食物组成以及各生物在食物网中所处的营养级。消费者和其食物的碳稳定同位素比值接近,平均富集在0.1‰~0.4‰之间,是食物来源的良好示踪指标,可确定消费者的食物来源,而消费者的氮同位素比值随营养级升高有明显的富集,在不同营养级有大约3.4‰的富集度,可用来确定食物网的结构和营养级[15-16]。将碳、氮稳定同位素联合使用能更有效地辨识有机质的最初来源和消费者的营养位置[17]。
黄海地处中纬度,是一个南北伸长的海域,西临山东半岛和苏北平原,东边是朝鲜半岛,北端是辽东半岛,约为38万km2,最深处在黄海东南部,约为140 m。由于其东、北和西面都被陆地所环绕,仅西北部有狭窄的通道同渤海相连接,南端经过东海和太平洋相沟通,因而黄海是一个较为封闭的海域[18]。关于黄海水域底栖动物的群落结构和生物多样性研究已有不少报道[19-22],但关于黄海大型底栖动物的食物来源、营养水平特别是底栖食物网结构的研究还未见报道。本文运用碳氮稳定同位素技术,对黄海海域大型底栖动物的食物源和营养级进行了研究,并初步构建了黄海底栖食物网,以期为近海生态系统能量流动和物质循环的模拟提供资料。
1 材料与方法
1.1 样品采集与前处理
于2017年12月搭乘“东方红2号”科学考察船在黄海海域12个站位(见图1)分别采集了用于稳定同位素分析的浮游植物、浮游动物、沉积物有机物(以下简称SOM)、底层水悬浮颗粒有机物(以下简称POM)和大型底栖动物样品。站位详细信息和样品采集情况见表1。
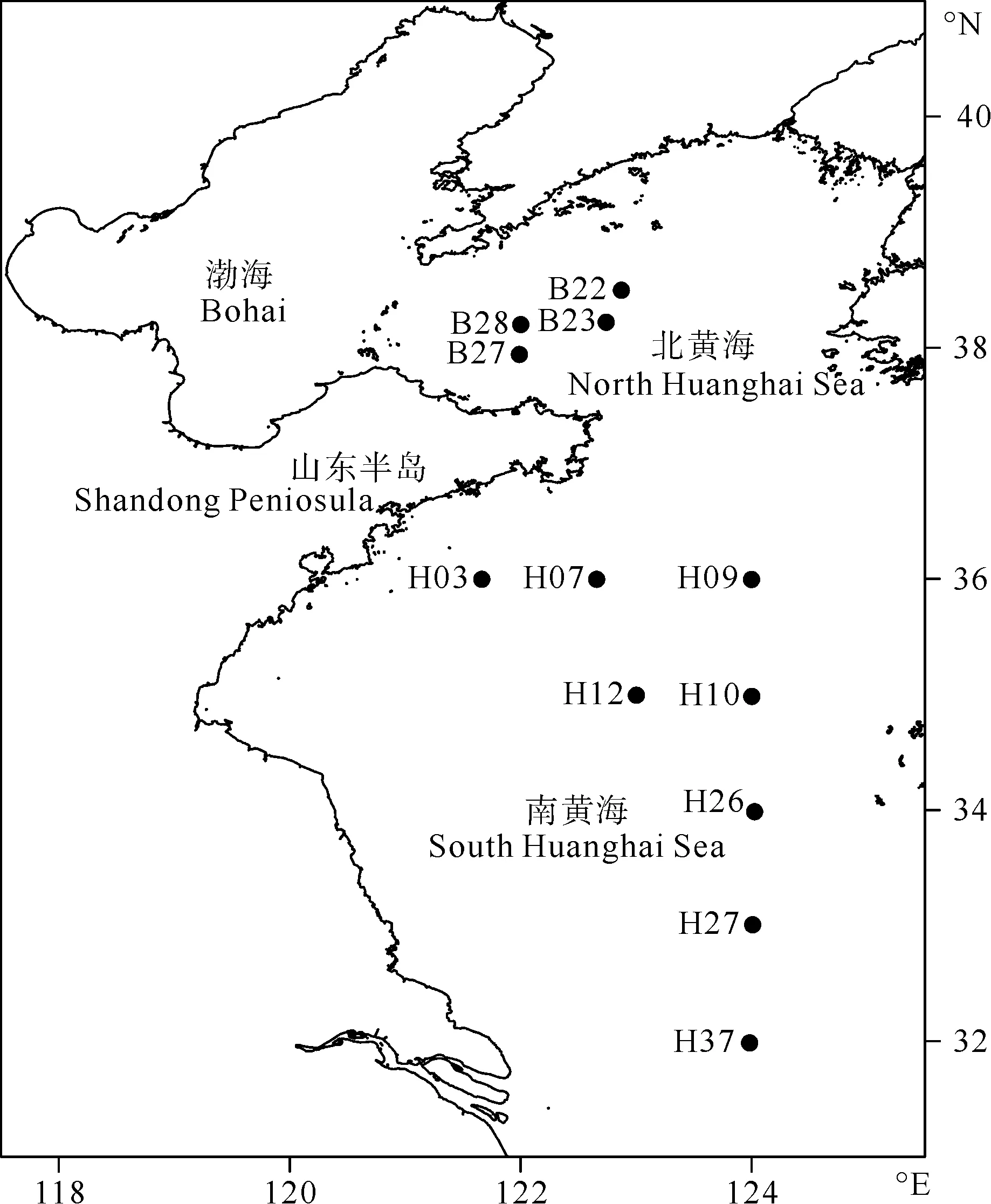
图1 黄海野外采样站位图
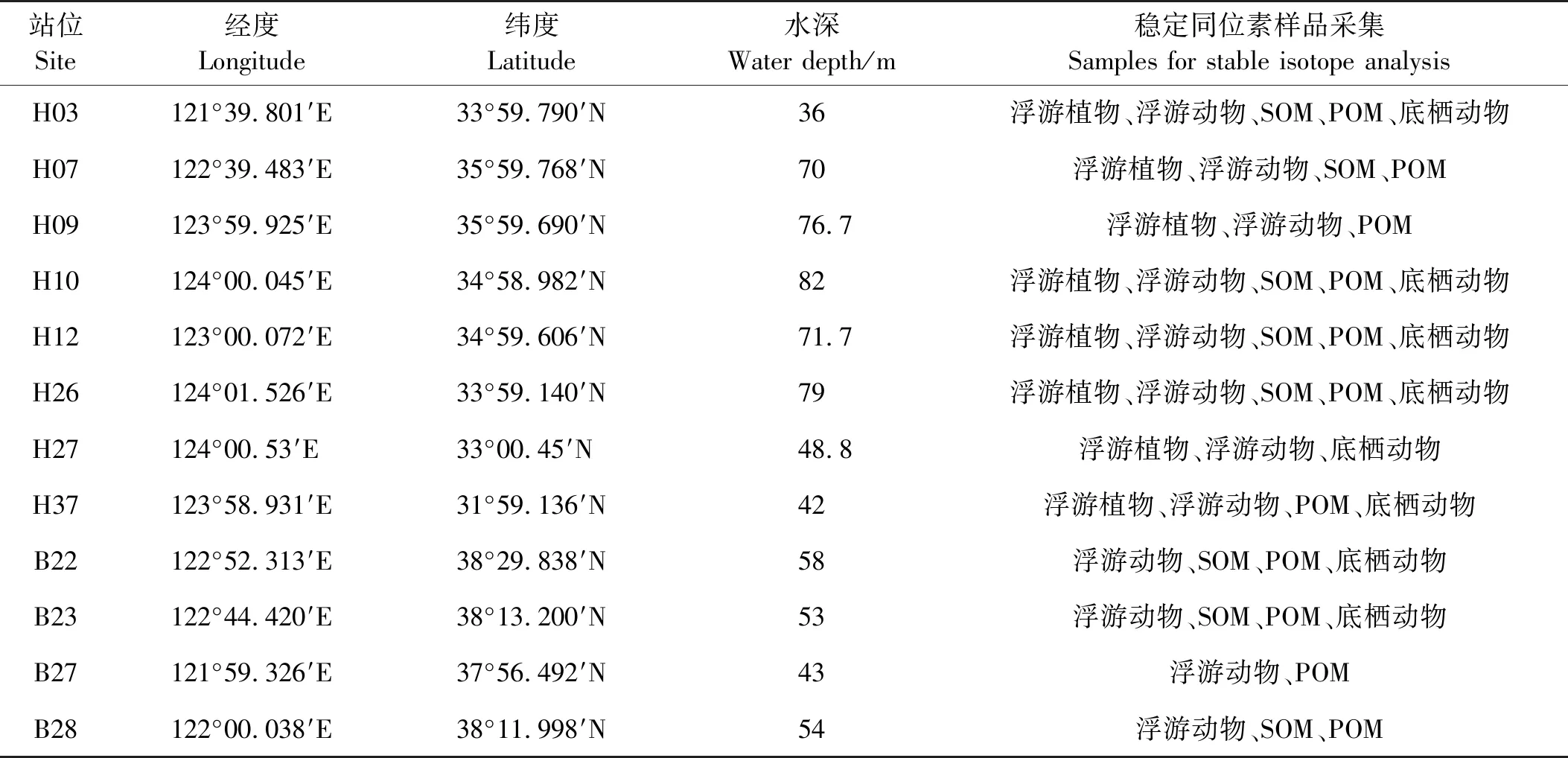
表1 黄海野外采样站位和样品采集信息
1.1.1 沉积物有机碎屑样品的采集与前处理 使用面积为0.1 m2的箱式采泥器采集沉积物有机物,将样品装入样品瓶中置于-20 ℃的冰箱中保存。在实验室内将SOM样品置于60 ℃中烘干24 h后,研磨成粉末,取25~35 mg放入锡囊中,做好标记用于测定δ15N的稳定同位素含量。将剩下的样品粉末放置在干燥器中,使用浓盐酸进行酸熏1~2 d,放置在通风橱中以除去残留的浓盐酸,再次烘干研磨成粉末,取25~35 mg放入锡囊中,用于测定δ13C的稳定同位素含量。
1.1.2 浮游植物样品的采集与前处理 使用小型浮游生物网从底层至表层垂直拖网,采集浮游植物样品,放入-20 ℃的冰箱中冷冻保存。返回实验室后使用80目筛绢过滤掉样品中的浮游动物和悬浮碎屑,然后将浮游植物样品过滤到0.45 μm孔径的GF/F膜上(GF/F膜需提前450 ℃预燃6 h以除去无机碳)。将滤膜使用浓盐酸进行酸熏1~2 d,烘干后刮取滤膜上的浮游植物样品装入锡囊,用于碳氮稳定同位素含量的测定。
1.1.3 悬浮颗粒有机物样品的采集与前处理 使用船载CTD采集底层水用于在实验室内收集悬浮颗粒有机物样品,POM收集和前处理方法与上文中浮游植物相同。
1.1.4 浮游动物样品的采集与前处理 使用大型浮游生物网从底层至表层垂直拖网,采集浮游动物样品,静养2 h排除消化道内含物后,在台式解剖镜下分选并分类,挑选较大个体的浮游动物样品合并为一个样品,使用去离子水清洗后进行烘干,装入锡囊用于碳氮稳定同位素含量的测定。
1.1.5 大型底栖动物样品的采集与前处理 使用阿氏拖网采集大型底栖动物样品,鉴定到种后用于同位素样品前处理。多毛类以及较小个体的类群选取整体;双壳类选取闭壳肌;腹足类选取腹足部分;鱼类和甲壳类等选取肌肉组织。将动物组织用去离子水清洗后,放入冷冻干燥机冷冻干燥48 h,研磨成粉末装入锡囊,用于碳氮稳定同位素含量的测定。
1.2 碳氮稳定同位素的测定
本研究中所有样品的碳氮稳定同位素比值均在自然资源部第三海洋研究所使用Integra 2同位素质谱仪(英国SerCon公司)进行测定。碳氮稳定同位素比值通过下列公式进行计算:
δX=[(R样品-R标准)/R标准]×103。
式中:X为所测定的稳定同位素种类(15N或者13C);R为样品该种元素的重同位素与轻同位素的比值(15N/14N或者13C/12C)。以空气中的氮气作为氮稳定同位素分析的标准物质,精度为0.2‰。以Vienna PDB作为碳稳定同位素分析的标准物质,精度为0.1‰。
1.3 消费者的食物来源和营养级的计算
当某种生物的食物来源为两种或者两种以上时,该生物的食物的相对贡献率可以通过稳定同位素混合食物模型来估算。通过下列公式进行计算(以碳同位素为例):
Kcarbon=1-(δ13Ca-δ13Cconsumer+Δδ13C)/(δ13Ca-δ13Cb)。
式中:Kcarbon表示食物a对消费者的食物贡献率;δ13Ca代表食物a的碳同位素比值;δ13Cb代表食物b的同位素比值;Δδ13C代表该捕食者的碳同位素分馏值(通常为1‰);δ13Cconsumer代表该捕食者的碳同位素比值。
由于随着消费者排泄物排出的尿素和氨的稳定同位素较低,导致氮稳定同位素越高的消费者营养级越高(δ15N分馏值通常为3‰~4‰),所以常使用δ15N来确定消费者在食物网中的营养级[23-26],通过下列公式计算:
TL=λ+(δ15Nconsumer-δ15Nbaseline)/Δδ15N。
式中:TL代表消费者的营养级;δ15Nconsumer代表消费者的氮稳定同位素比值;δ15Nbaseline代表所选取的初级生产者或初级消费者氮稳定性同位素基础值;λ代表所选取基准生物的营养级,基准生物为初级生产者时,λ=1;基准生物为初级消费者时,λ=2[27]。Δδ15N代表消费者的氮稳定同位素分馏值,约为3.4‰[25]。
当消费者同时摄食两种δ15N值不同的食物时,消费者的营养级可以通过下列公式计算:
TL=λ+{δ15Nconsumer-[δ15Nbaseline1×α+δ15Nbaseline2×(1-α)]}/Δδ15N,
α=(δ13Cconsumer-δ13Cbaseline2)/(δ13Cbaseline1-δ13Cbaseline2)。
式中α为其中一种食物对该消费者的贡献率。
对于食物来源种类较多的营养关系系统来说,需要通过多源线性混合模型(Multiple source linear mixing model)来估算出消费者所摄食各种食物的相对贡献率。Phillips和Gregg[28]提供了该模型的应用软件IsoSource(网址:http://www.epa.gov/eco-research/stable-isotope-mixing-models-estimating-estimating-source-proportions)。
2 结果
2.1 POM、SOM、浮游植物和浮游动物δ13C、δ15N值的特征
POM、SOM、浮游植物和浮游动物的δ13C、δ15N值见表2及图2。
POM的δ15N值的变化范围为0.6‰~2.49‰,所有站位中南黄海H37站位的POM的δ15N值最高,为2.49‰;北黄海B22站位的δ15N值最低,为0.6‰,两者相差1.89‰。POM的δ13C值的变化范围为-25.32‰~-22.24‰,所有站位中南黄海的H37站位的POM的δ13C值最高,为-22.24‰;南黄海的H03站位的δ13C值最低,为-25.32‰,两者相差3.08‰。
SOM的δ15N值的变化范围为4.93‰~5.92‰,所有站位中北黄海的B28站位的SOM的δ15N值最高,为5.92‰;北黄海B22站位的δ15N值最低,为4.93‰,两者相差0.99‰。SOM的δ13C值的变化范围为-22.9‰~-21.84‰,所有站位中南黄海的H07站位的SOM的δ13C值最高,为-21.84‰;北黄海的B23站位的δ13C值最低,为-22.9‰,两者相差1.06‰。
浮游植物的δ15N值的变化范围为4.46‰~7.21‰,所有站位中南黄海的H27站位的浮游植物的δ15N值最高,为7.21‰;南黄海H7站位的δ15N值最低,为4.46‰,两者相差2.74‰。浮游植物的δ13C值的变化范围为-24.98‰~-21.57‰,所有站位中南黄海的H27站位的浮游植物的δ13C值最高,为-21.57‰;南黄海的H26站位的δ13C值最低,为-24.98‰,两者相差3.41‰。
浮游动物的δ15N值的变化范围为6.21‰~9.76‰,所有站位中北黄海的B27站位的浮游动物的δ15N值最高,为9.76‰;北黄海B28站位的δ15N值最低,为6.21‰,两者相差3.55‰。浮游动物的δ13C值的变化范围为-23.62‰~-20.95‰,所有站位中南黄海的H37站位的浮游动物的δ13C值最高,为-20.95‰;南黄海的H12站位的δ13C值最低,为-23.62‰,两者相差2.67‰。
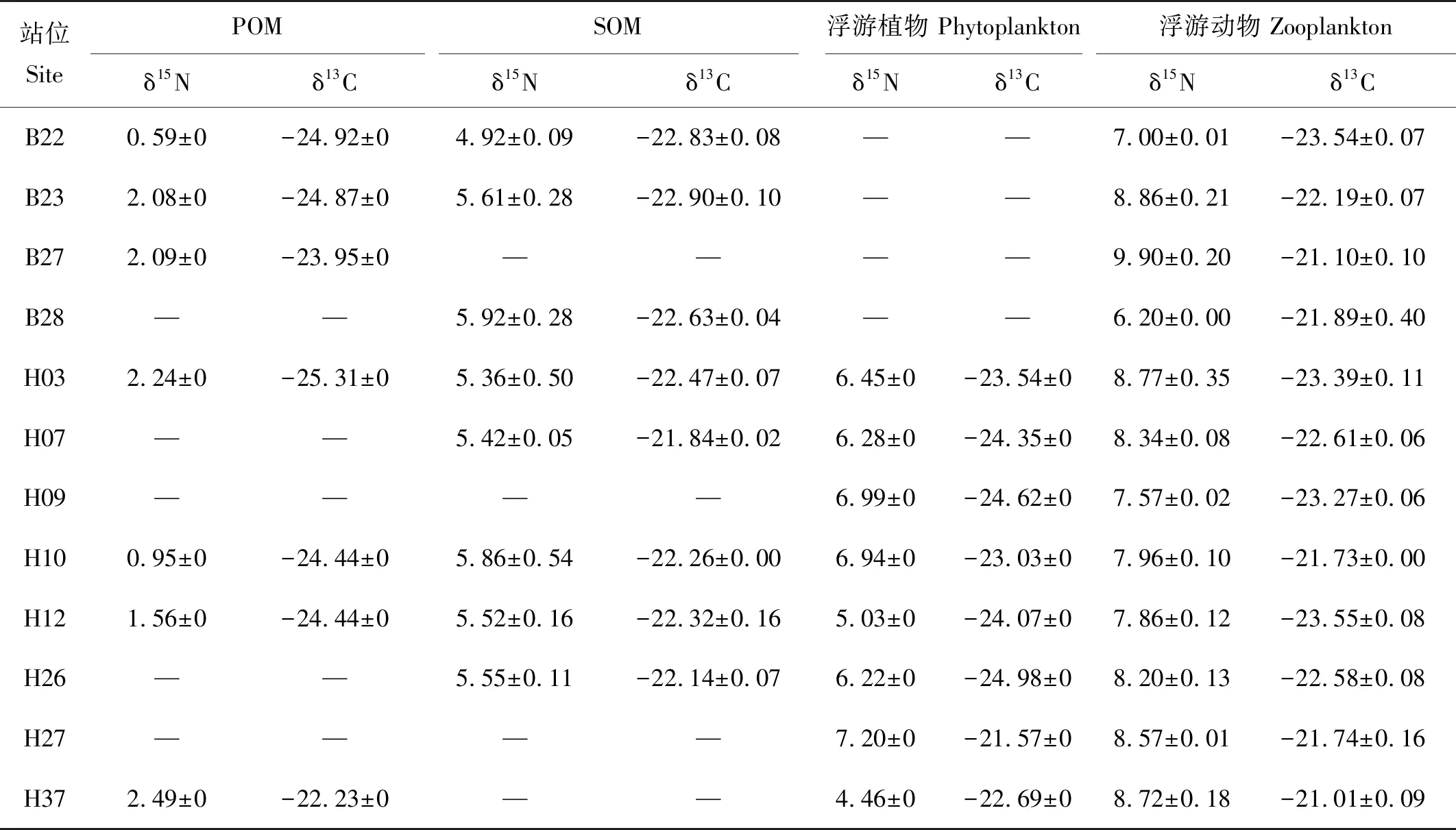
表2 黄海POM、SOM、浮游植物和浮游动物的δ15N、δ13C值
2.2 大型底栖动物的碳氮同位素比值特征
对54种大型底栖动物(种名录见表3)进行了δ15N、δ13C值的测定,其中节肢动物甲壳类(包括蟹、虾、钩虾、水虱)18种,鱼类12种,软体动物双壳类7种,腹足类6种,头足类1种,环节动物多毛类3种,棘皮动物蛇尾类2种,海星类1种,海参类1种,刺胞动物海葵类2种,海鳃类1种。经测定,大型底栖动物的δ15N值变化范围为5.81‰~14.6‰,其中最高值为B23站位黄鲫(14.6‰),最低值为H26站位美原双眼钩虾(5.81‰)。大型底栖动物的δ13C值变化范围为-21.51‰~-8.38‰,其中最高值为H26站位司氏盖蛇尾(-8.38‰),最低值为H12站位日本胡桃蛤(-21.51‰)。将54种大型底栖动物分成不同的类群,包括:多毛类、双壳类、棘皮动物类、小型甲壳类、珊瑚类、虾类、蟹类、腹足类、海葵类、头足类和鱼类。
各类群大型底栖动物的δ15N、δ13C值的结果见表4。多毛类的δ15N值变化范围为8.16‰(H03不倒翁虫)~12.06‰(H12黄海埃刺梳鳞虫),δ13C值变化范围为-18.53‰(H12黄海埃刺梳鳞虫)~-14.97‰(H03日本臭海蛹)。双壳类的δ15N值变化范围为7.87‰(H026砂海螂)~9.51‰(H10奇异指纹蛤),δ13C值变化范围为-21.51‰(H12日本胡桃蛤)~-17.46‰(H10醒目云母蛤)。棘皮动物的δ15N值变化范围为6.52‰(H26司氏盖蛇尾)~11.08‰(H26海地瓜),δ13C值变化范围为-19.01‰(H26海地瓜)~-8.38‰(H26司氏盖蛇尾)。小型甲壳类有2种,H26美原双眼钩虾的δ15N值变化范围为5.85‰,δ13C值变化范围为-20.52‰;H37日本游泳水虱的δ15N值变化范围为11.72‰,δ13C值变化范围为-15.31‰。珊瑚类只有强壮仙人掌海鳃一种,δ15N值为9.09‰,δ13C值为-15.17‰。虾类的δ15N值变化范围为10.34‰(H07细螯虾)~12.18‰(H27周氏新对虾),δ13C值变化范围为-19.15‰(H23日本鼓虾)~-15.25‰(H37细巧仿对虾)。蟹类的δ15N值变化范围为9.26‰(H27泥脚隆背蟹)~11.47‰(B22大寄居蟹),δ13C值变化范围为-19.5‰(B22枯瘦突眼蟹)~-14.84‰(H37艾氏活额寄居蟹)。腹足类的δ15N值变化范围为9.7‰(B23经氏壳蛞蝓)~12.63‰(H27褐管蛾螺),δ13C值变化范围为-18.7‰(B23侧平肩螺)~-16.54‰(H27褐管蛾螺)。海葵类有2种,须毛高领细指海葵的δ15N值为12.98‰,δ13C值为-19.87‰;格氏丽花海葵δ15N值为11.39‰,δ13C值为-20.44‰。头足类只有火枪鱿一种,δ15N值为12.34‰,δ13C值为-15.52‰。鱼类的δ15N值变化范围为10.49‰(H03蓝氏棘鲬)~14.6‰(B23黄鲫),δ13C值变化范围为-20.1‰(H37龙头鱼)~-15.98‰(B23黄鲫)。

表3 用于稳定同位素分析的黄海大型底栖动物种名录Table 3 Species list of macrofauna for stable isotope analysis in the Yellow Sea
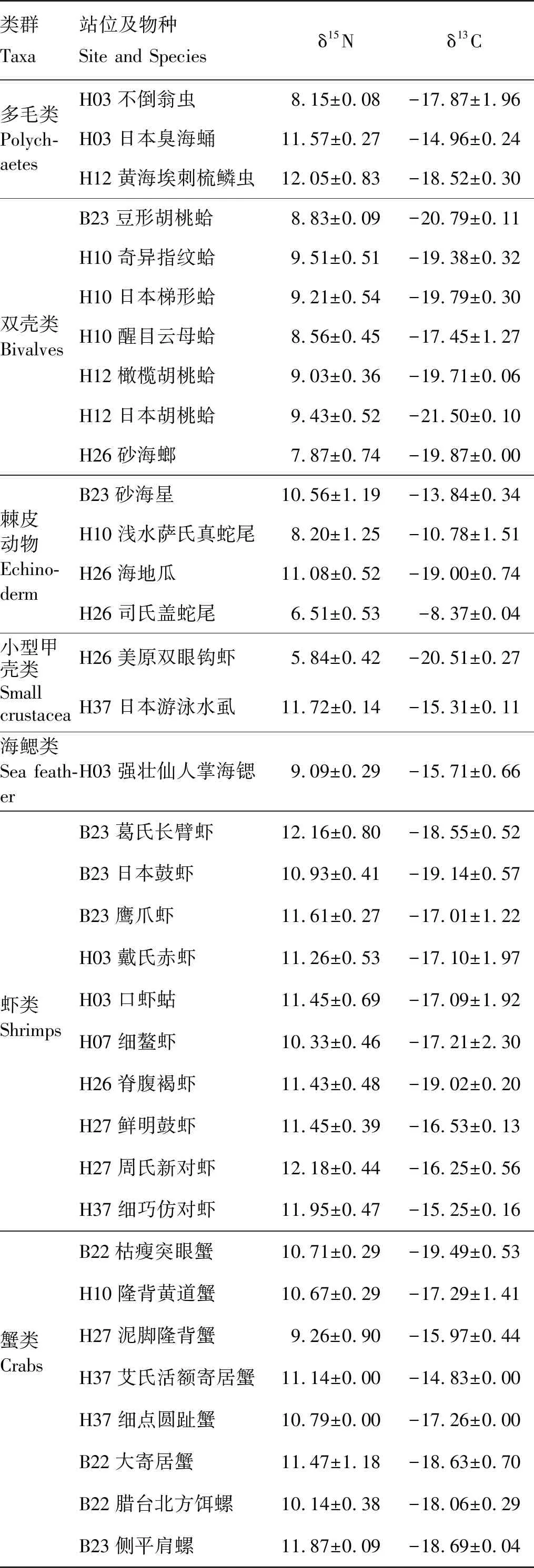
表4 黄海大型底栖动物的δ15N、δ13C值
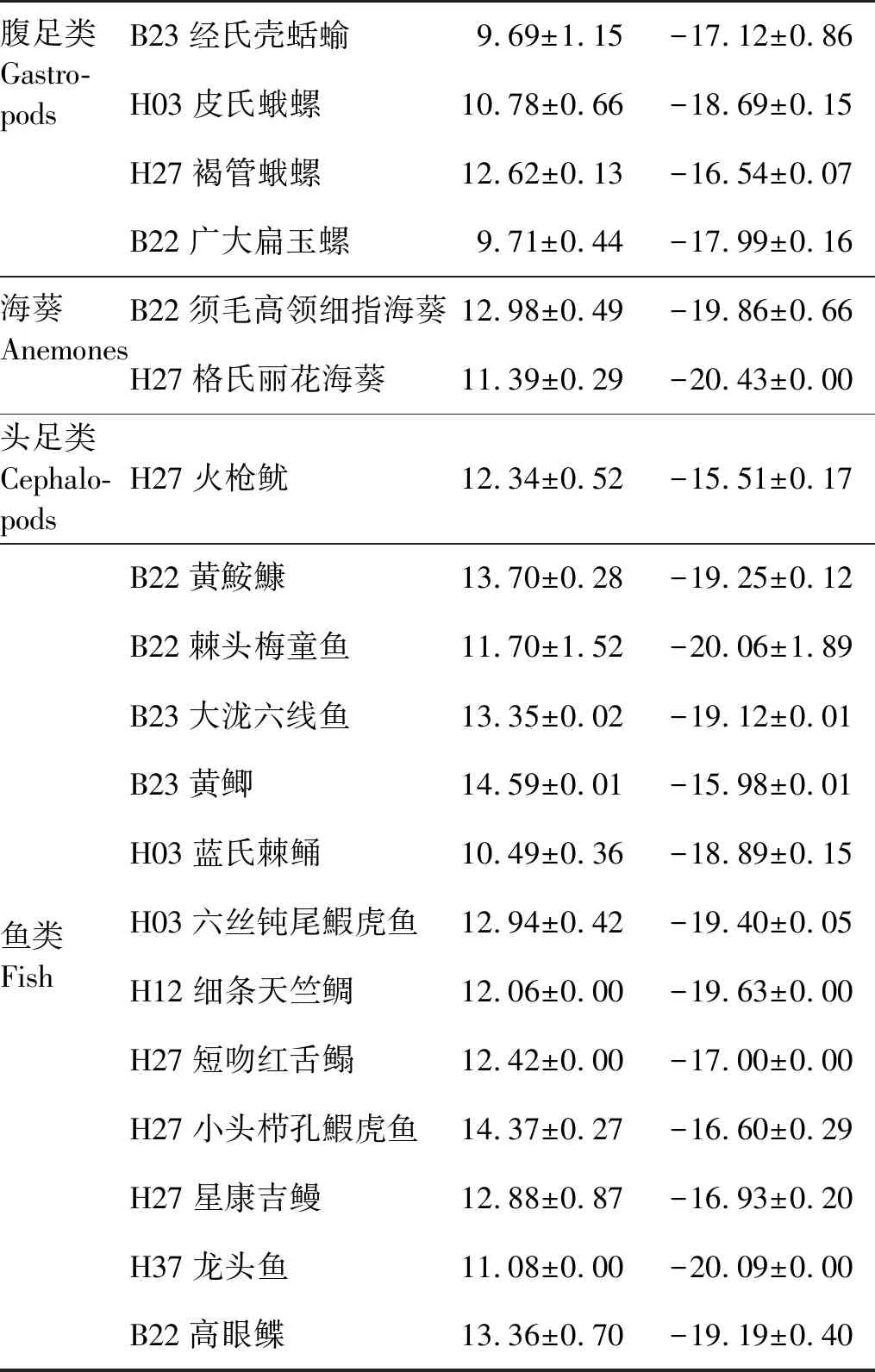
腹足类Gastro-podsB23经氏壳蛞蝓9.69±1.15-17.12±0.86H03皮氏蛾螺10.78±0.66-18.69±0.15H27褐管蛾螺12.62±0.13-16.54±0.07B22广大扁玉螺9.71±0.44-17.99±0.16海葵AnemonesB22须毛高领细指海葵12.98±0.49-19.86±0.66H27格氏丽花海葵11.39±0.29-20.43±0.00头足类Cephalo-podsH27火枪鱿12.34±0.52-15.51±0.17B22黄鮟鱇13.70±0.28-19.25±0.12B22棘头梅童鱼11.70±1.52-20.06±1.89B23大泷六线鱼13.35±0.02-19.12±0.01B23黄鲫14.59±0.01-15.98±0.01H03蓝氏棘鲬10.49±0.36-18.89±0.15鱼类FishH03六丝钝尾鰕虎鱼12.94±0.42-19.40±0.05H12细条天竺鲷12.06±0.00-19.63±0.00H27短吻红舌鳎12.42±0.00-17.00±0.00H27小头栉孔鰕虎鱼14.37±0.27-16.60±0.29H27星康吉鳗12.88±0.87-16.93±0.20H37龙头鱼11.08±0.00-20.09±0.00B22高眼鲽13.36±0.70-19.19±0.40
2.3 黄海底栖动物的食物源
使用IsoSource软件,将POM、SOM和浮游动植物作为低级消费者的食物源,将浮游动植物和低级消费者作为高级消费者的食物源,在进行计算底栖动物的食物贡献率时(δ15N减去3.4‰,δ13C减去1‰),使用δ13C来计算各种食物源贡献率时均无解,使用δ15N来计算各种食物源贡献率时仅有H03日本臭海蛹一种无解,因此本研究使用δ15N值对54种底栖动物不同食物源的贡献率进行计算。由于54种底栖动物的食物源不同,因此在计算时参考文献资料[29]将54种底栖动物分为几个不同的类群,包括:(1)以沉积物、悬浮颗粒物、浮游动植物为食的双壳类、小虾以及海鳃的类群;(2)以SOM、POM、浮游动植物、小型双壳类和多毛类为食的各种蟹、寄居蟹以及腹足类;(3)以浮游动物、小型软体动物、小型软甲类和多毛类为食的各种虾;(4)以浮游动物、多毛类、小型软体动物、小型软甲类以及小型鱼类为食的各种鱼类。
2.3.1 以SOM、POM和浮游动植物为食的底栖动物的食物贡献率 此类群包括各种双壳类、蛇尾、美原双眼钩虾、不倒翁虫、强壮仙人掌海鳃和细螯虾,使用δ15N值对他们的食物来源SOM、POM和浮游动植物的贡献率进行计算,其中日本臭海蛹计算结果无解。各食物源的贡献率见表5。
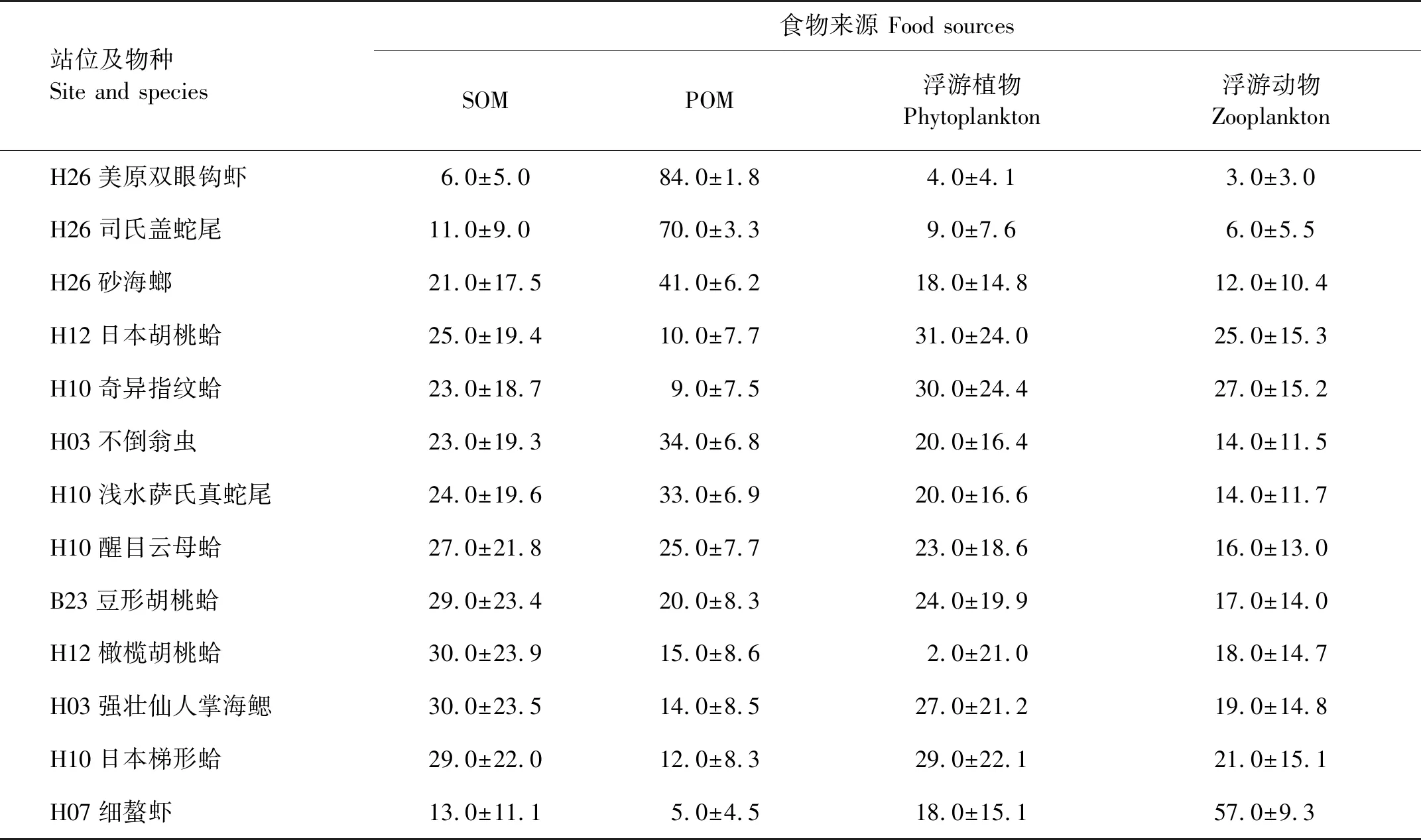
表5 黄海悬浮颗粒有机物(POM)、沉积物有机物(SOM)和浮游动植物对大型底栖动物的食物贡献率
2.3.2 以SOM、POM、浮游动植物、小型双壳类和多毛类为食的底栖动物的食物贡献率 此类群包括各种蟹、寄居蟹和腹足类,使用δ15N值对它们的食物源SOM、POM、浮游动植物、小型双壳类和多毛类贡献率进行计算,各种食物源的贡献率见表6。
2.3.3 以浮游动物、小型软体动物、小型软甲类和多毛类为食的底栖动物的食物源贡献率 此类群包括各种虾、鼓虾和口虾蛄,使用δ15N值对它们的食物来源浮游动物、小型软体动物、小型软甲类和多毛类的贡献率进行计算,各种食物源的贡献率见表7。
2.3.4 以浮游动物、多毛类、小型软体动物、小型软甲类以及小型鱼类为食的底栖动物的食物源贡献率 此类群包括各种小型鱼类和大型食肉鱼类,使用δ15N值对它们的食物源浮游动物、多毛类、小型软体动物、小型软甲类以及小型鱼类的贡献率进行计算,各种食物源的贡献率见表8。
2.3.5 其他大型底栖动物的食物源贡献率此类群包括砂海星、海地瓜、黄海埃刺梳鳞虫、格氏丽花海葵和须毛高领细指海葵,使用δ15N值对它们的食物源的贡献率进行计算,各种食物源的贡献率见表9。
2.4 黄海大型底栖动物的营养级
使用同位素营养级计算公式对54种底栖动物的营养级进行计算,理论上应选择紫贻贝等滤食性初级消费者作为基准生物,但由于本研究中没有获取到此类较低营养级的双壳类,因此将本研究中δ15N值最低的悬浮物食性美原双眼钩虾(δ15N值为5.85‰)作为营养级计算时的基准生物,以3.4‰作为δ15N的分馏值。
结果显示,本研究中黄海底栖动物的营养级处于1.20~3.57,大多物种处于2~3营养级,54种底栖动物的营养级见图3。其中,有10种动物的营养级处于1~2之间,占总种数的18.5%,以浅水萨氏真蛇尾、醒目云母蛤、强壮仙人掌海鳃等初级消费者为主。有36种动物营养级处于2~3之间,占总种数的66.7%,以广大扁玉螺、砂海星、隆背黄道蟹、日本鼓虾、棘头梅童鱼等杂食性类群为主。营养级大于3的种类仅有8种,占总种数的14.8%,以黄鮟鱇、六丝钝尾鰕虎鱼等肉食性类群为主。
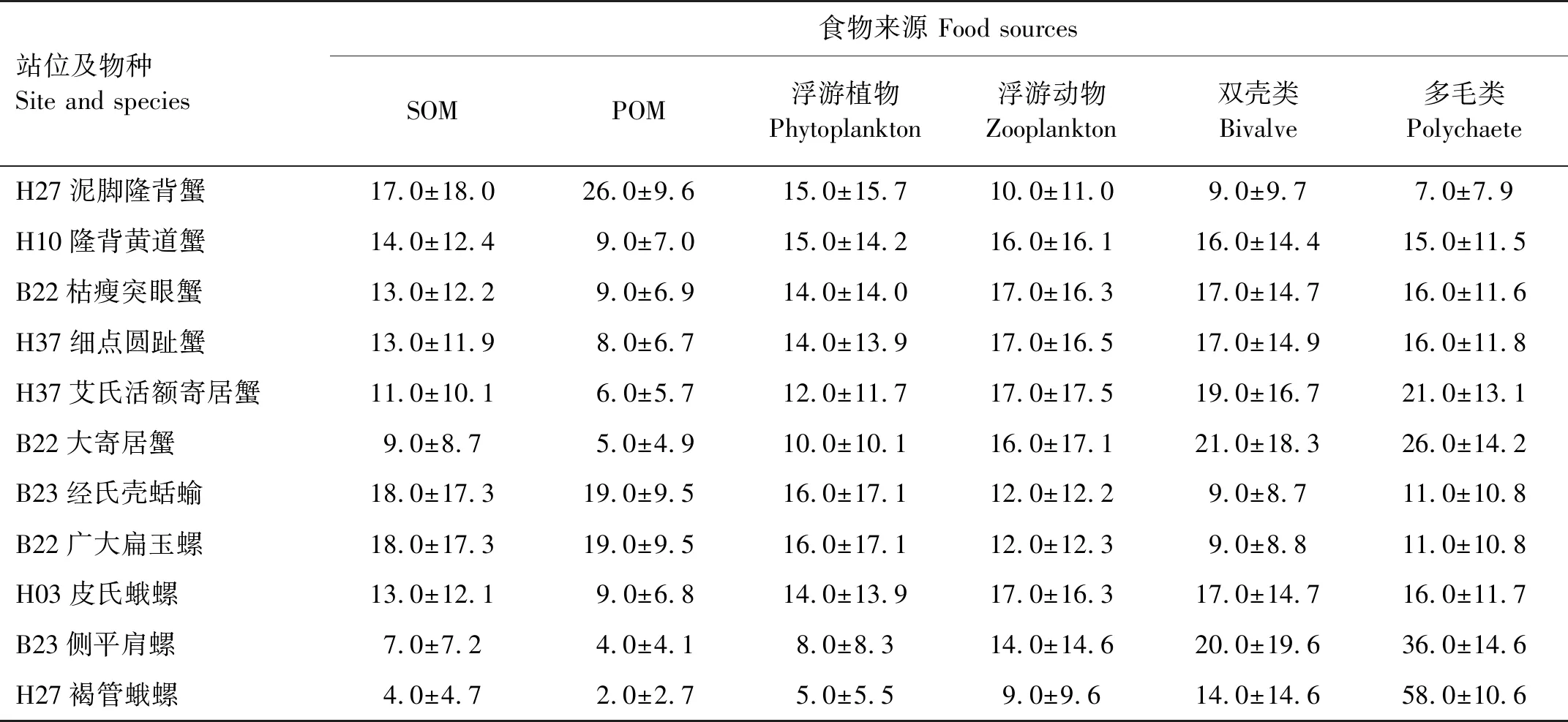
表6 黄海悬浮颗粒有机物(POM)、沉积物有机物(SOM)、浮游动植物、小型双壳类和多毛类对底栖动物的食物贡献率Table 6 The food contribution rates of SOM, POM, phytoplankton, zooplankton, small bivalves and polychaetes to macrofauna in the Yellow Sea /%
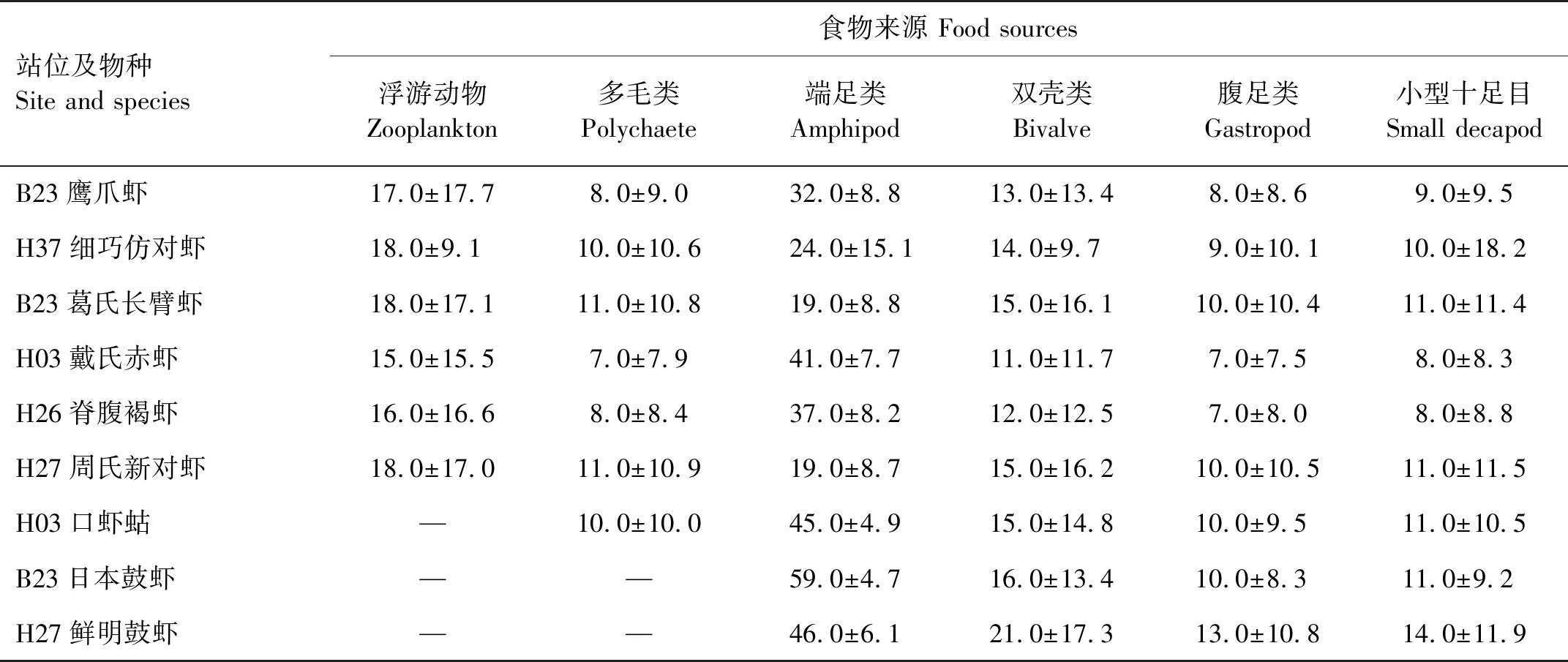
表7 黄海浮游动物、小型软体动物、软甲类和多毛类对底栖动物的食物贡献率Table 7 The food contribution rates of zooplankton, small bivalves, malacostraca and polychaetes to macrofauna in the Yellow Sea /%
2.5 黄海底栖食物网结构
根据黄海底栖动物不同类群的食物源贡献率以及它们所处的的营养级不同,初步构建了黄海底栖食物网结构(见图4)。处于营养级I和营养级II之间的包括端足类(美原双眼钩虾)、蛇尾类(浅水萨氏真蛇尾、司氏盖蛇尾)、海星类(砂海星)、双壳类(豆形胡桃蛤、奇异指纹蛤、日本梯形蛤、醒目云母蛤、橄榄胡桃蛤、日本胡桃蛤、砂海螂)、海鳃类(强壮仙人掌海鳃)、小型虾类(细螯虾)和多毛类(不倒翁虫、日本臭海蛹、黄海埃刺梳鳞虫)。处于营养级营养级II和III之间的包括蟹类(枯瘦突眼蟹、隆背黄道蟹、泥脚隆背蟹、细点圆趾蟹、大寄居蟹、艾氏活额寄居蟹)、腹足类(腊台北方饵螺、侧平肩螺、经氏壳蛞蝓、皮氏蛾螺、褐管蛾螺、广大扁玉螺)、海参类(海地瓜)、中型虾类(葛氏长臂虾、鹰爪虾、戴氏赤虾、脊腹褐虾、周氏新对虾、细巧仿对虾、日本鼓虾、鲜明鼓虾、口虾蛄)和小型鱼类(棘头梅童鱼、蓝氏棘鲬、细条天竺鲷、短吻红舌鳎和龙头鱼)。处于营养级III以上的包括海葵类(须毛高领细指海葵、格氏丽花海葵)、头足类(火枪鱿)和大中型鱼类(星康吉鳗、六丝钝尾鰕虎鱼、大泷六线鱼、高眼鲽、黄鮟鱇、小头栉孔鰕虎鱼、黄鲫)。
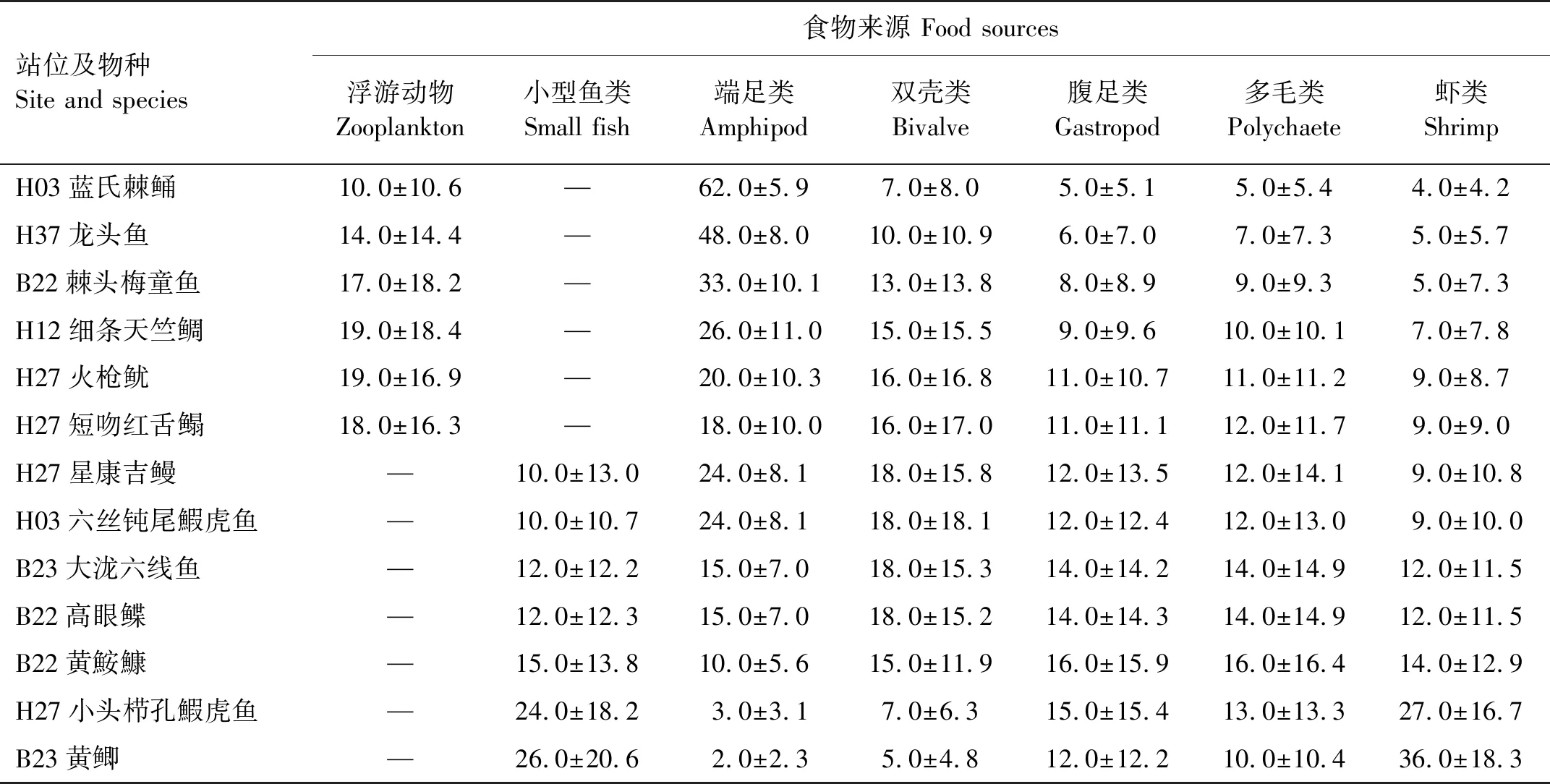
表8 黄海不同鱼类和头足类食物源的贡献率Table 8 The contribution rates of food sources to fish and cephalopod in the Yellow Sea /%
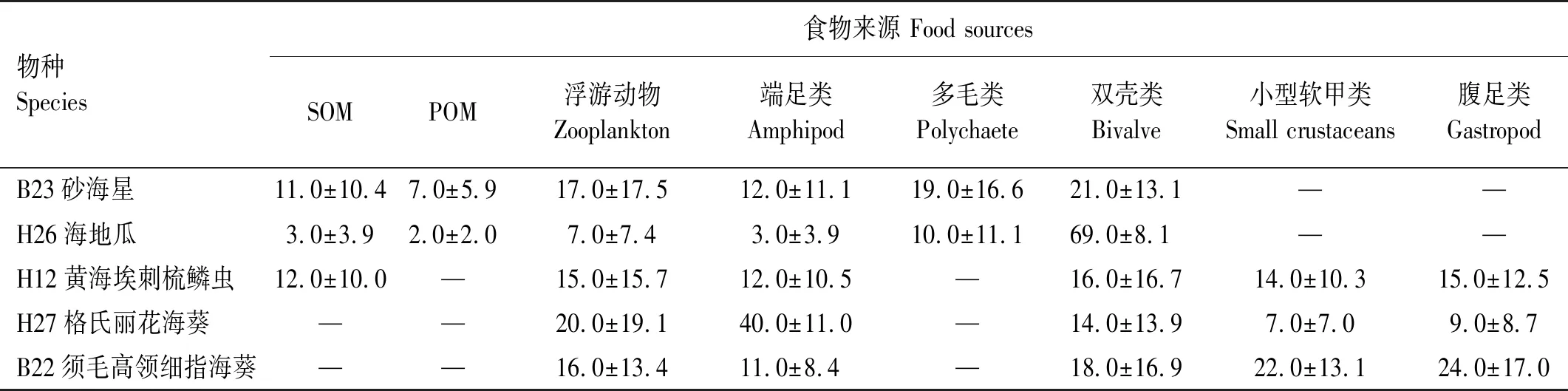
表9 黄海其他大型底栖动物食物源的贡献率Table 9 The contribution rates of food sources to other macrofauna in the Yellow Sea /%
3 讨论
在不同生态系统中,初级生产者的碳、氮稳定同位素值可能会有所不同[30]。海洋中的初级生产者既有C3植物,也有C4植物,它们不同的光合作用途径会导致C3植物的δ13C值在一定程度上低于C4植物,而且不同海域的生态系统中相同类群的稳定同位素比值也有可能会因为赤潮、水华等特殊情况发生改变。
同一物种不同个体间存在大小差异,这也是影响稳定同位素比值的关键因素,底栖鱼类、虾类和蟹等海洋底栖动物在不同的生长时期会选择不同的食物来源,虾类的摄食类型从幼体时的滤食性演变为以小型海洋无脊椎动物为食的肉食性[31],鱼类的摄食类型会从小型浮游动物演变为以大中型虾类和鱼类为食,同时也伴随着营养级的升高[32]。很多研究者的研究结果显示,海洋无脊椎动物的稳定同位素比值与它们的个体大小具有相关性[33-34]。由于在样品采集时,无法对数量较少的底栖动物个体的大小进行限制,所以后期某些物种的碳氮稳定同位素测定结果会因为个体大小的差异存在一定的误差,这也会影响最终的食物来源贡献率和营养级计算结果。另一方面,在进行食物来源贡献率的计算时,由于不同营养级的物种食物来源不同,本研究参考文献资料[29]将54种底栖动物进行了大致的分类,这其中无法避免会存在主观误差,可能也会影响最终的贡献率计算结果。
本研究中不同类群的δ13C值具有较为显著的差异。由于碳稳定同位素通常被用来计算物种的食物来源,因此说明本研究中的底栖动物食物来源比较复杂。有研究指出,食物来源更广的物种在食物匮乏的生态系统中存活率更高[34],这也正好解释了本研究的δ13C值的结果。
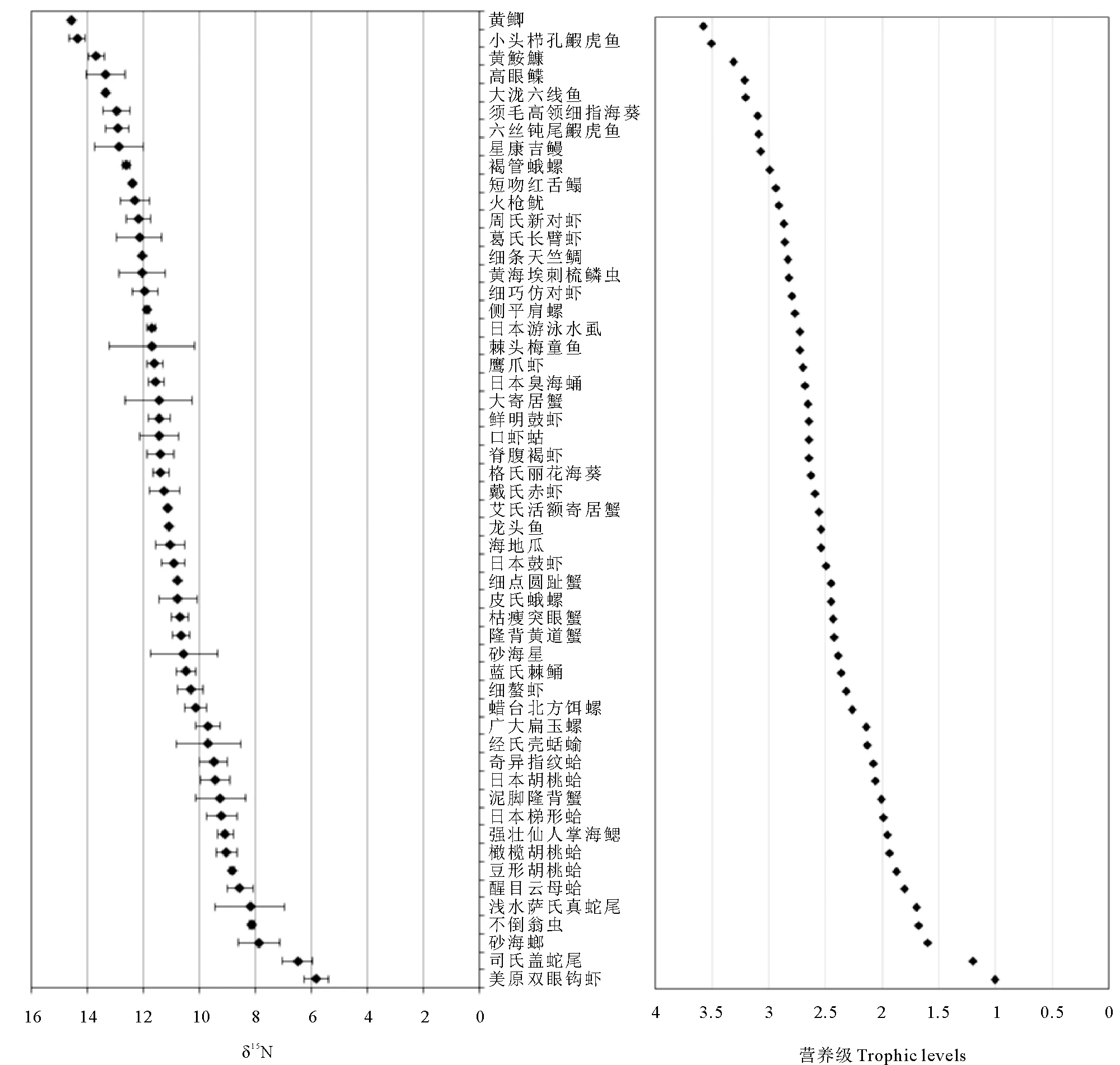
图3 黄海54种大型底栖动物的δ15N值和营养级(物种拉丁名见表3)Fig.3 The trophic levels and δ15N values of 54 species of macrofauna in the Yellow Sea(Species Latin names are in Table 3)
稳定同位素δ15N的值通常被用来鉴别动物的营养级[36],相邻营养级之间δ15N的值相差3.4‰[37],然而在计算营养级时需要选择适当的基准生物。由于底栖动物栖息水层的特殊性,导致它们的食物来源往往比较复杂,这就给基准生物的选择增加了难度。通常情况下选择在生态系统中稳定存在、并且食性简单的双壳类动物作为基准生物[38]。在本研究中,底栖动物的δ15N平均值依次为双壳类<腹足类<蟹类<虾类<小型鱼类<大中型鱼类,各个相邻类群之间的δ15N值相差均小于3.4‰,这说明在此次研究中各个类群的生态位有重叠现象[39]。由于很多高营养级也会以低营养级的饵料为食,这表明它们的食物来源中可能会有相同的部分[40]。
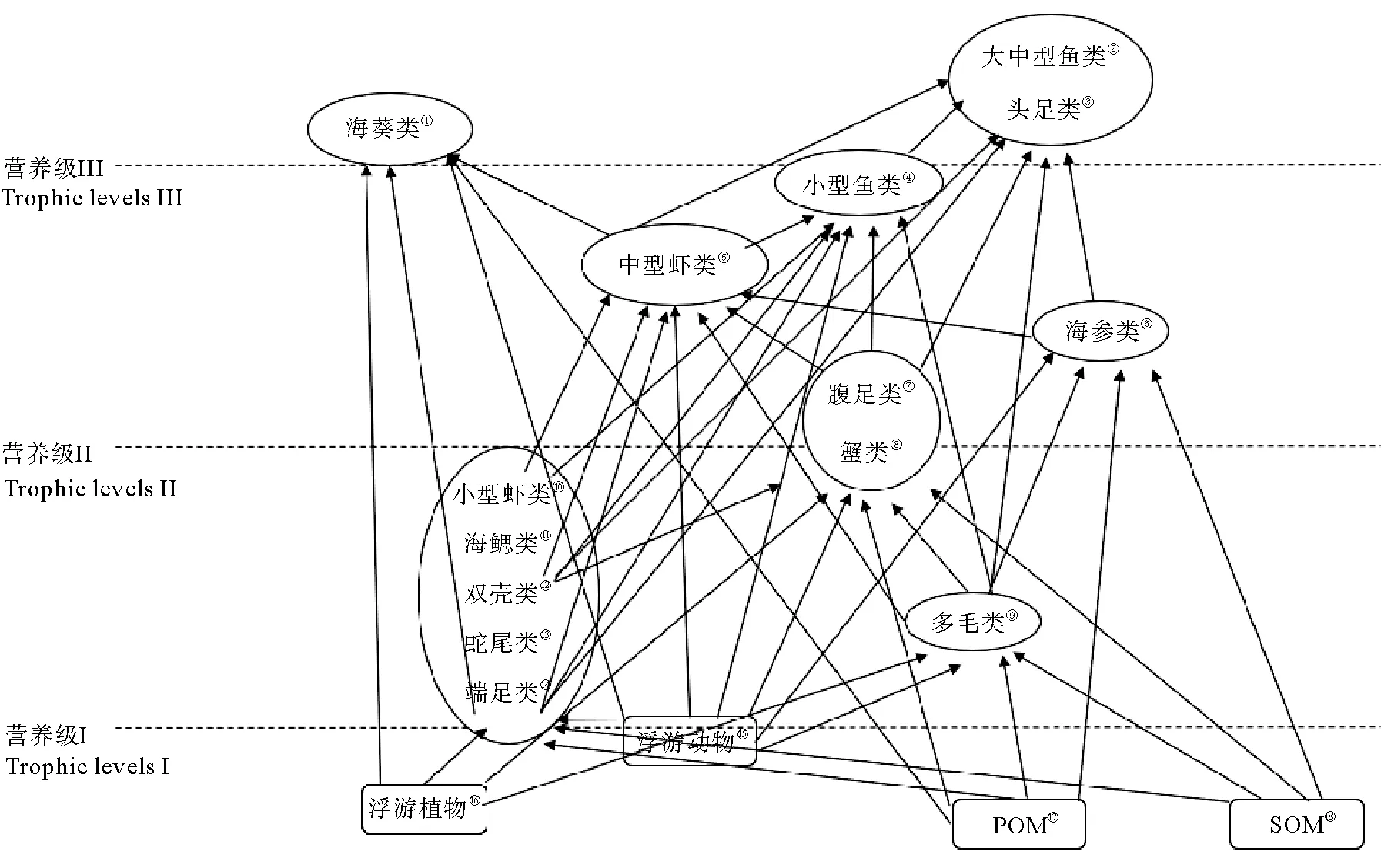
(①Anemones;②Large and medium fish;③Cephalopods;④Small fish;⑤Medium shrimps;⑥Sea cucumber;⑦Gastropods;⑧Crabs;⑨Polychaete;⑩Small shrimps;Sea feather;Bivalve;Ophiura;Amphipod;Zooplankton;Phytoplankton;悬浮颗粒有机物;沉积物有机物。)
4 结论
(1)本研究中,POM、SOM、浮游植物和浮游动物的δ15N值依次为:浮游动物>浮游植物>SOM>POM,浮游动物、浮游植物、SOM的δ15N值相差不大,但是三者与POM相差较明显。δ13C值依次为:SOM>浮游动物>浮游植物>POM,四者的δ13C值相差不大。
(2)本研究中,共测定黄海底栖动物54种,其中节肢动物甲壳类(包括蟹、虾、钩虾、水虱)18种,鱼类12种,软体动物双壳类7种,腹足类6种,头足类1种,环节动物多毛类3种,棘皮动物蛇尾类2种,海星类1种,海参类1种,刺胞动物海葵类2种,海鳃类1种。δ15N值变化范围为5.81‰(美原双眼钩虾)~14.6‰(黄鲫),δ13C值变化范围为-21.51‰(日本胡桃蛤)~-8.38‰(司氏盖蛇尾)。
(3)研究结果表明,软体动物双壳类大多数以SOM和浮游植物作为主要食物来源,同时POM也是它们的食物来源;软体动物腹足类大多数为以小型软体动物和多毛类为食的肉食性动物,SOM也是它们的食物来源;节肢动物蟹类大多数是杂食性动物,POM、SOM、浮游动植物、小型软体动物和多毛类都是它们的食物来源;节肢动物虾类大多数以浮游动物和端足类等小型甲壳动物为食;小型鱼类大多数以浮游动物和小型软甲类为食,大中型鱼类则是以小型鱼类、小型软甲类和小型软体动物为食。
(4)研究结果显示54种黄海底栖动物的营养级处于1.20~3.57,其中36种处于2~3营养级,包括腹足类、蟹类、虾类和小型鱼类等;10种处于1~2营养级,包括双壳类等;8种处于3以上营养级,主要包括大中型鱼类。
致谢:本研究的数据及样品采集得到了国家自然科学基金委员会共享航次计划(航次编号:NORC2018-01)的资助,该航次由中国海洋大学“东方红2”科考船实施,在此一并致谢。
