颈项透明层增厚在产前诊断中的应用
2020-08-26黄婷婷周萍黎俏邹永毅刘艳秋
黄婷婷 周萍 黎俏 邹永毅 刘艳秋
江西省妇幼保健院产前诊断中心(南昌330006)
胎儿颈项透明层(nuchal translucency,NT),是 指胎儿正中矢状切面颈椎水平皮肤软组织和皮下软组织间液体积聚的最大厚度[1],随着超声影像设备灵敏度、清晰度不断提高,医务人员操作诊断技术的不断提升,妊娠早期(孕11~13+6周)超声测量胎儿NT 厚度已经成为胎儿染色体异常诊断中灵敏度和特异度均较高的超声指标[2],在NT 增厚而染色体核型正常的胎儿中,可能存在具有临床意义的染色体拷贝数变异(copy number variations,CNVs),有研究[3]报道染色体微阵列分析(chromosomal microarray analysis,CMA)可将具有临床意义的染色体微缺失和(或)微重复综合征检出率增加0%~8%,但临床上CMA在NT增厚胎儿中具体的应用价值报道较少。本文对NT增厚(NT ≥2.5 mm)胎儿进行介入性产前诊断,在染色体核型分析基础上增加CMA,在全基因组水平检测染色体不平衡的CNVs。旨在探讨NT增厚与胎儿染色体异常相关性及CMA 在NT 增厚胎儿产前诊断中的应用价值,为进一步开展孕早期超声筛查工作提供数据支撑。
1 资料与方法
1.1 一般资料
1.1.1 研究对象取2017年1月至2019年10月因早孕期超声筛查提示胎儿NT 增厚(即NT ≥2.5 mm)在江西省妇幼保健院产前诊断中心就诊的208例孕妇,均行介入性产前诊断(绒毛取材术或羊膜腔穿刺术或脐静脉穿刺术)。获取胎儿标本行染色体核型分析及CMA,所有孕妇均进行遗传咨询并签署知情同意书。
1.1.2 分组按照不同胎儿NT厚度分为分为5组,2.5~2.9 mm 组,3.0~3.9 mm 组,4.0~4.9 mm 组,5.0~5.9 mm 组,≥6.0 mm 组。根据年龄分成2 组,单纯NT ≥2.5 mm 组(年龄<35 岁)及高龄(年龄≥35 岁)合并NT ≥2.5 mm 组。均在11~13+6周进行孕早期超声筛查。
1.2 方法
1.2.1 NT 测量参照文献[4]提出对孕11~13+6周胎儿超声筛查的要求进行规范化操作及储存图像。测量胎儿头臀长(crown rump length,CRL)和NT。测量≥3次,记录NT最大值。胎儿头臀长45~84 mm,NT异常判断标准:NT ≥2.5 mm 定义例为增厚。
1.2.2 介入性产前诊断孕11~13+6周孕妇行经腹绒毛膜取材术,孕18~24 周孕妇行羊膜腔穿刺术,孕24 周及以上孕妇行脐静脉穿刺术。所有孕妇均行遗传咨询并签署知情同意书。
1.2.3 染色体核型检查穿刺所得胎儿样本,送遗传实验室,经细胞接种、培养,常规方法制片,G 显带后,分析20 个中期分裂相,再结合计算机分析存储系统作进一步分析处理。
1.2.4 CMA将胎儿样本及父母血严格按照德国Qiagen 全血基因组DNA 提取试剂盒的标准操作流程提取胎儿样本及其父母外周血中的全基因组DNA。再根据Affymetrix 公司提供的Cytoscan 750k芯片标准实验操作流程对所提取的全基因组DNA进行分析处理。CMA 结果分别与本实验室内部数据库以及国际公共数据库中已记录的CNVs 片段进行比对分析,判断所检出CNVs 的性质,对结果进行解读。
1.3 统计学方法本组数据资料采用SPSS 20.0统计软件进行数据统计分析,计数资料分析采用χ2检验,用百分比表示。以P<0.05 为差异有统计学意义。
2 结果
2.1 孕妇产前诊断状况208例孕妇中,检出67例染色体异常,其中49例为致病性染色体异常,共包括染色体非整倍体44例,致病性CNVs 5例(3例染色体核型分析可见),3例为意义不明确CNVs(variant of uncertain significance,VUS),2例多态性CNVs,13例为染色体多态性及相互易位。见表1。

表1 胎儿NT 增厚染色体异常类型及比例Tab.1 Type and proportion of abnormal chromosome in NT thickened fetus(n=208)
2.2 按照NT 值分组对染色体结果进行分析见表2。NT 2.5~2.9 mm 者共29例,共检出致病染色体异常5例(17.24%)。4例21-三体综合征;1例18-三体综合征,1例16p11.2 微重复(多态性),1例46,XN,del(5p13.3p13.2),1例46,XN,t(1;16)(p32q12),还有1例46,XN,inv(Y)(p11q11)。
NT 3.0~3.9 mm 者共113例,共检出致病染色体异常17例(15.04%),11例21-三体综合征,1例18-三体综合征,1例13 三体综合征,1例46,XN,del(10)微缺失(致病性),1例17q12重复(致病性),1例Xp22.31微重复(意义不明确),1例16p11.2微重复(多态性),1例46,XN,del(5p15.33p15.2)(致病性),1例1q21.1q21.2(致病性),1例15q13.3 重复(意义不明确),7例染色体多态性,3例染色体平衡易位及罗伯逊易位。
NT 4.0~4.9 mm 者共35例,共检出致病染色体异常14例(40%),10例21-三体综合征,2例18-三体综合征,1例45,X[31]/47,XXX[7],1例46,XN,del(3q11.2q13.13),1例染色体多态性。NT 5.0~5.9 mm 者共17例,共检出致病染色体异常7例(41.18%),4例21-三体综合征,2例18-三体综合征,1例47,XXY。NT 6.0 mm 及以上者共14例,共检出致病染色体异常6例(42.86%),2例21-三体综合征,2例18-三体综合征,2例45,X。
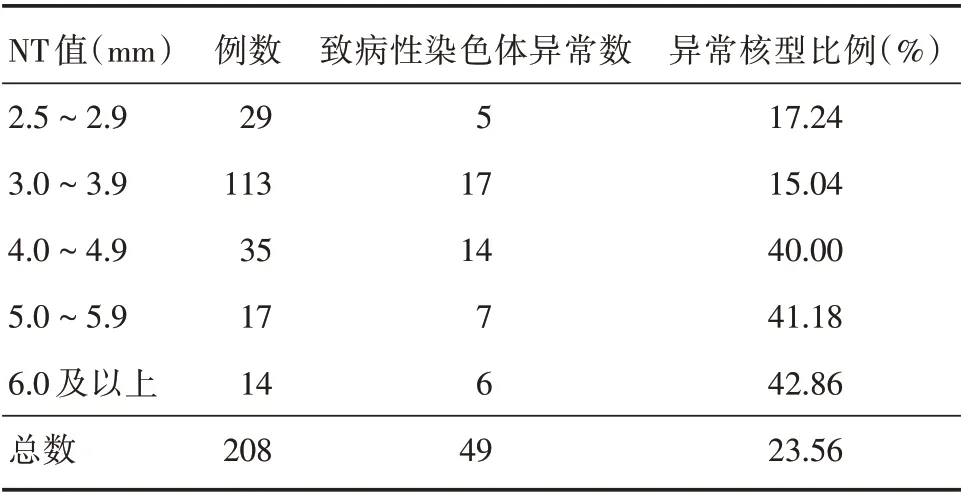
表2 不同NT 值与染色体异常的关系Tab.2 The relationship between different NT values and chromosomal abnormalities
2.3 单纯组与高龄并NT 增厚组间比较单纯性NT ≥2.5 mm 组158例孕妇胎儿致病性染色体异常数为24例,高龄(年龄≥35 岁)合并NT ≥2.5 mm组50例孕妇胎儿致病性染色体异常数为25例,两组比较差异有统计学意义(P<0.05)。见表3。

表3 NT 增厚是否合并高龄的染色体异常分布Tab.3 Chromosome abnormal distribution between NT thickening and combined with advanced age
2.4 单纯NT增厚中NT 2.5~2.9 mm组与NT 3.0~3.9 mm 组比较单纯NT 增厚(年龄<35 岁)中,NT 2.5~2.9 mm 组21例,共检出致病染色体异常1例(4.76%),NT 3.0~3.9 mm 组89例,共检出致病染色体异常10例(11.24%),两组比较差异有统计学意义(P<0.05)。见表4。

表4 单纯NT 2.5~2.9 mm 组与NT 3.0~3.9 mm 组染色体异常的比较Tab.4 Comparison of chromosome abnormalities between NT 2.5~2.9 mm group and NT 3.0~3.9 mm group
2.5 CMA 异常结果应用CMA 共检出10例CNVs,染色体核型分析正常而CMA 检出CNVs 7例,2例为致病CNVs,3例为VUS,2例CNVs 考虑多态性。见表5。

表5 NT 增厚CMA 异常结果分析Tab.5 Analysis of abnormal CMA results of NT thickened fetus
3 讨论
染色体异常是导致胎儿出生缺陷的主要原因,包括染色体数目和结构的异常[5]。染色体疾病致残率、致死率均高,除常伴发多系统畸形外,易合并智力障碍,大多数无有效的治疗方法,给家庭和社会带来了极大的精神和经济负担。NT 是指胎儿颈后部皮下组织内液体的积聚。研究[2,6]发现NT增厚不仅与胎儿染色体非整倍体异常有关,且增加胎儿发生一些遗传性综合征、结构异常、严重的心脏发育异常以及神经发育迟缓等的风险。
目前NT 增厚已经成为胎儿染色体异常诊断中灵敏度和特异度均较高的超声指标[7-8]。但对于NT 增厚的具体生理机制目前尚无明确的理论解释[9]。有研究[10]指出,在21-三体综合征中,心衰被认为是NT 增厚的主要因素,而在特纳综合征中,NT 增厚是由于胎儿淋巴系统发育延迟或异常所致。在18-三体综合征中,胎儿膈疝可能损害静脉回流而导致NT 增厚等等。
本研究对208例NT ≥2.5 mm 单胎孕妇进行了介入性产前诊断,49例检出致病性染色体异常,异常检出率为23.56%。其中44例为染色体非整倍体,主要为21-三体综合征。李载红等[9]对122例NT ≥2.5 mm 胎儿行染色体核型分析,检出染色体异常21例,检出率为17.2%,三体征检出15例(71.4%),其中21-三体12例(57.1%)。CHRISTIANSEN 等[11]发现,NT 增厚且染色体核型异常的胎儿中,21-三体者占43.3%,18-三体者占12.1%、13-三体者占5.2%、Turner 综合征者占8.0%、三倍体者占3.5%。结果均证实胎儿NT 增厚与非整倍体,尤其是21-三体综合征相关,本研究基本一致。随着胎儿NT 值增加,胎儿合并染色体异常的发生率逐渐升高。MAYA 等[12]应用染色体核型分析联合CMA 对NT ≤2.9 mm、3.0~3.4 mm和≥3.5 mm 3 组单纯NT 增厚孕妇行产前诊断,致病性染色体异常分别为1.7%、6.5%和13.8%,故建议胎儿NT >3.0 mm 时孕妇应行介入性产前诊断。TAHMASEBPOUR 等[13]研究中当胎儿NT 值为第95 百分位数至~3.4 mm、3.5~4.4 mm、4.5~5.4 mm、5.5~6.4 mm 及≥6.5 mm 时,染色体核型异常的发生率分别为10%、12%、33%、46%和58%。在本研究中,NT 增厚中2.5~2.9 mm、3.0~3.9 mm、4.0~4.9 mm、5.0~5.9 mm、6.0 mm及以上5组孕妇中胎儿致病性染色体异常检出率分别为17.24%、15.04%、40%、41.18%、42.86%。当NT ≥3.0 mm 时,染色体异常风险随着NT 增厚而增加,与之前研究一致。但在2.5~2.9 mm 组中染色体异常检出率比3.0~3.9 mm 更高,分析原因,在前组中5例染色体异常有4例手术指征为高龄合并NT 增厚且年龄≥38岁,排除年龄因素后,NT 2.5~2.9 mm组致病染色体异常检出率4.76%显著低于NT 3.0~3.9 mm致病染色体异常检出率11.24%(P<0.05)。目前研究[14-16]表明胎儿染色体异常风险随年龄越大,呈递增趋势。本研究中,高龄(年龄≥35岁)合并NT ≥2.5 mm组致病性染色体异常比例(50%)显著高于单纯性NT ≥2.5 mm 组致病性染色体异常比例(15.19%)(P<0.05)。其主要是考虑由于高龄孕妇受内外环境影响,卵子老化程度增加,生殖细胞或受精卵在细胞分裂时易发生染色体不分离获畸变所致[17]。
目前,CMA 是最常用的遗传学诊断方法之一[18-19],特别是针对产前超声检查发现胎儿结构异常的情况[20]。CMA 能检测出传统染色体核型分析无法检测的CNVs,同时还能检出单亲二倍体等[21]。关于CMA 在染色体核型正常的NT 增厚胎儿中的应用价值存在分歧且国内相关报道较少。SCOTT,研究[22-23]认为NT 增厚可能与致病性CNVs无关。GRANDE 等[3]则发现CMA 在染色体核型正常且NT 增厚(NT ≥3.5 mm)的胎儿中,可进一步检出5.0%(2.0%~8.0%)具有临床意义的染色体微缺失和(或)微重复综合征及1.0%的VUS。LEUNG 等[24]研究在NT ≥3.5 mm 但染色体核型正常的300例胎儿中,共检出11例胎儿携带致病性的CNVs,额外诊断率为3.7%(11/300),及14例VUS。在本研究中,在161例染色体核型正常且NT ≥2.5 mm 胎儿中,应用CMA 增加检出7例CNVs,检出率4.35%(7/161),其中2例为致病CNVs,3例VUS,2例CNVs 考虑多态性,与其他研究基本一致。
综上所述,通过孕早期超声检查胎儿NT 厚度来筛查胎儿染色体异常具有重要的临床意义,可以作为介入性产前诊断的重要超声筛查指标,且推荐2.5 mm 作为高龄孕妇胎儿NT 截断值。采用染色体核型+染色体微阵列检测模式,能增加NT增厚胎儿染色体异常的检出率,但同时还可检出VUS,会造成产前咨询的困惑[25],故临床应用需要更多数据支撑。
