Fe3O4@SiO2@TiO2-AC 光催化降解水源水中腐殖酸
2020-08-25冯宝瑞刘海成江晓西江晓西
冯宝瑞,刘海成,李 阳,成 长,曾 睿,江晓西,江晓西,陈 卫
(1.苏州科技大学天平学院,江苏苏州215009;2.苏州科技大学环境科学与工程学院,江苏苏州215009;3.河海大学浅水湖泊综合治理与资源开发教育部重点实验室,江苏南京210098)
腐殖酸(HA)是天然水体中的一种大分子有机物,约占水体中天然有机物的50%~90%。 水源水中的HA 易在水厂加氯过程中形成具有“三致”作用的消毒副产物〔1〕;可与水体中的重金属离子发生螯合反应,增大重金属离子的去除难度〔2〕;此外,HA 还会引起原水色度及浊度的升高〔3〕,降低水处理工艺的运行效能〔4〕。
光催化氧化法近年来被广泛用于去除水体中的HA〔5〕。 作为一种常用的半导体光催化剂,TiO2具有催化效率高、价格便宜、无毒、化学稳定性好等优点〔6〕。但TiO2颗粒以悬浮状态独自使用时存在吸附性差、回收困难等问题〔7〕。 研究人员以Fe3O4颗粒作为磁核,设计核壳结构的磁性光催化材料,使其能在外加磁场的条件下快速回收。 但TiO2直接沉积在Fe3O4表面时,Fe3O4磁核与TiO2包覆层之间会产生不利异质结,使电子空穴复合的能力变强,光催化活性降低〔8〕。在Fe3O4和TiO2层间引入性质稳定的SiO2隔离层可降低磁核对TiO2活性的影响〔9〕。 有研究将TiO2负载在活性炭(AC)表面制备出负载型光催化剂用于降解污染物,AC 的加入可提高催化剂的吸附性能,从而提高材料的光催化性能〔10〕。
本文以纳米Fe3O4颗粒为磁核, 硅酸四乙酯和钛酸丁酯分别作为SiO2和TiO2的原材料,采用共沉淀法耦合溶胶-凝胶法制备了核壳结构的磁性颗粒Fe3O4@SiO2@TiO2,将其负载在载体AC 表面,制备出新型光催化材料Fe3O4@SiO2@TiO2-AC,考察其对天然有机物HA 的光催化降解效能, 以期为有效去除水源水中的有机污染物探求新的技术途径。
1 材料与方法
1.1 主要仪器与试剂
材料:钛酸丁酯(TBOT),化学纯;腐殖酸、硫酸亚铁、氢氧化钠、硅酸四乙酯(TEOS)、月桂酸、氨水、活性炭粉、无水乙醇、盐酸、硝酸、十二烷基磺酸钠、氯化铁、氯化锌,均为分析纯。 试验用水为超纯水。
仪器:Quanta FEG 250 扫描电子显微镜, 美国FEI 公司;7400 振动样品磁强计, 美国Lakeshore 公司;TU-1900 紫外可见分光光度计,北京普析通用仪器有限责任公司;D8 advance X 射线衍射仪,德国布鲁克公司;Sartorious PB-10 pH 计,德国Sartorious 公司;Nicolet 460 傅氏转换红外线光谱分析仪,美国赛默飞世尔科技公司;F48010-33CN 马弗炉, 上海寰熙医疗器械有限公司;GDZ400 高压汞灯,上海季光特种照明厂。
1.2 Fe3O4@SiO2@TiO2-AC 的制备
1.2.1 Fe3O4纳米微粒的制备
将适量Fe3+、Fe2+(物质的量比2∶1)溶于稀盐酸中,在80 ℃、 恒温搅拌条件下滴加3 mol/L 的NaOH 溶液,调节溶液pH 至9~10,出现黑色沉淀即为Fe3O4,充分反应后用水和无水乙醇各洗涤3 次至中性,得到纳米Fe3O4微粒。
1.2.2 Fe3O4@SiO2纳米微粒的制备
将制得的Fe3O4纳米微粒加入到无水乙醇和水的混合液中, 超声10 min 后加入氨水并充分搅拌。搅拌完成后在25 ℃下逐滴加入硅酸四乙酯溶液,搅拌反应4 h, 用水和无水乙醇将沉淀物各洗涤3 次,105 ℃烘干,得到Fe3O4@SiO2纳米微粒。
1.2.3 Fe3O4@SiO2@TiO2纳米微粒的制备
在无水乙醇中加入适量钛酸丁酯和Fe3O4@SiO2,超声10 min 后搅拌20 min,加入冰乙酸后继续搅拌30 min。 将一定比例的水、无水乙醇、硝酸构成的混合液,滴加到上述溶液中,继续搅拌60 min,70 ℃下水浴3 h 得到湿凝胶,105 ℃干燥, 于马弗炉中450 ℃煅烧3 h, 冷却后将煅烧后的产物研磨、过0.074 mm(200 目)筛,得到Fe3O4@SiO2@TiO2微粒,储存备用。
1.2.4 Fe3O4@SiO2@TiO2-AC 催化剂的制备
取适量月桂酸及氢氧化钠溶于超纯水中, 加入一定质量的Fe3O4@SiO2@TiO2, 在90 ℃水浴锅中反应30 min,调节pH 至4~5,水洗至中性,加入适量十二烷基磺酸钠,60 ℃下反应1 h 后升温至80 ℃,加入一定量经过ZnCl2活化的AC 反应3 h,水洗,干燥,得到Fe3O4@SiO2@TiO2-AC 光催化剂。
1.3 HA 模拟水样配制与标准曲线绘制
准确称取25 mg HA 粉末于一定量稀NaOH(0.1 mol/L)热溶液中,充分溶解后用稀盐酸(0.1 mol/L)调节pH 至中性,转移至500 mL 容量瓶中,用超纯水定容得到质量浓度为50 mg/L 的HA 溶液,储存于4 ℃冰箱备用,试验时根据所需浓度进行稀释。
HA 对波长254 nm 的紫外光有较好的吸收,因此常用254 nm 处的吸光度UV254衡量水样中HA 的含量。将HA 储备液稀释成不同浓度的溶液,以超纯水为参比测定吸光度UV254。 以质量浓度为横坐标,吸光度为纵坐标拟合标准曲线, 得到曲线方程UV254=0.027C-0.001 2(R2=0.999 7)。
1.4 试验装置与方法
光催化反应在400 W 高压汞灯作光源、有循环冷却水的自制反应器中进行。 将光催化剂加入到200 mL HA 水样中进行光催化试验,每次取样5 mL进行磁分离,对上清液过0.45 μm 滤膜后测定其UV254数值,按1.3 中标准曲线方程计算HA 质量浓度,并计算HA 去除率。 考察试验条件对光降解HA的影响时, 在试验开始60 min 时取样测定并计算相关参数;进行光催化动力学及比较不同体系下HA 降解情况时每隔10 min 取样测定并计算相关参数。
2 结果与讨论
2.1 Fe3O4@SiO2@TiO2-AC 表征
2.1.1 扫描电镜(SEM)
图1 为Fe3O4@SiO2@TiO2与Fe3O4@SiO2@TiO2-AC 颗粒的SEM 照片。

图1 Fe3O4@SiO2@TiO2(a)和Fe3O4@SiO2@TiO2-AC(b)的SEM 照片
由图1(a)可知,Fe3O4@SiO2@TiO2呈固体颗粒,粒径较小且均一,但因其具有较强的磁性,颗粒间存在轻微的团聚现象。 由图1(b)观察到,Fe3O4@SiO2@TiO2已成功负载于AC。
2.1.2 X 射线衍射(XRD)
Fe3O4@SiO2、Fe3O4@SiO2@TiO2、Fe3O4@SiO2@TiO2-AC 的XRD 谱图如图2 所示。
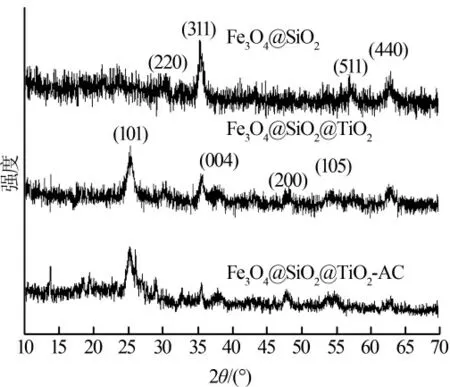
图2 Fe3O4@SiO2、Fe3O4@SiO2@TiO2和Fe3O4@SiO2@TiO2-AC 的XRD 图谱
由图2 可见,30.1°、35.4°、57.1°、62.7°处的衍射峰分别对应尖晶石型Fe3O4结构的(220)、(311)、(511)及(440)晶面,23.5°左右出现1 个宽峰,为不定形SiO2的特征衍射峰,说明磁性粒子Fe3O4与SiO2结合成功〔9〕;在Fe3O4@SiO2@TiO2谱线上,25.3°、37.9°、48.0°、54.1°的衍射峰对应于锐钛矿型TiO2结构的(101)、(004)、(200)、(105)晶面,表明TiO2纳米颗粒 已 经 成 功 包 覆Fe3O4@SiO2颗 粒〔11〕;Fe3O4@SiO2@TiO2-AC 的XRD 谱线上,Fe3O4、SiO2、TiO2的特征峰均有出现,虽然峰强变小,但结构未发生明显改变,可以判断AC 表面成功负载了Fe3O4@SiO2@TiO2。
2.1.3 傅里叶转换红外光谱(FTIR)
对比了Fe3O4@SiO2、Fe3O4@SiO2@TiO2及Fe3O4@SiO2@TiO2-AC 颗粒的FTIR 谱图。
1 627、3 409 cm-1处出现的是—OH 的特征吸收峰,956、1 091 cm-1处分别对应Si—OH 伸缩振动吸收峰和Si—O—Si 反对称吸收振动峰,469、799 cm-1处的吸收峰分别对应Si—O—Si 键的弯曲振动和Si—O 键的对称伸缩振动峰;583 cm-1为Fe—O 键的特征吸收峰,表明SiO2已成功包覆在Fe3O4表面〔12〕。 Fe3O4@SiO2@TiO2的红外光谱中,SiO2在400~600 cm-1的特征吸收峰基本被TiO2中Ti—O 的伸缩振动峰掩盖〔12〕,表明TiO2成功覆盖在SiO2表面。Fe3O4@SiO2@TiO2-AC 的 红 外 谱 图 中,1 080 cm-1处为TiO2与AC 接触界面生成的Ti—C 键吸收峰〔13〕,表明Fe3O4@SiO2@TiO2成功与AC 结合。
2.1.4 磁滞回线(VSM)
Fe3O4@SiO2、Fe3O4@SiO2@TiO2、Fe3O4@SiO2@TiO2-AC 的VSM 分析见图3。
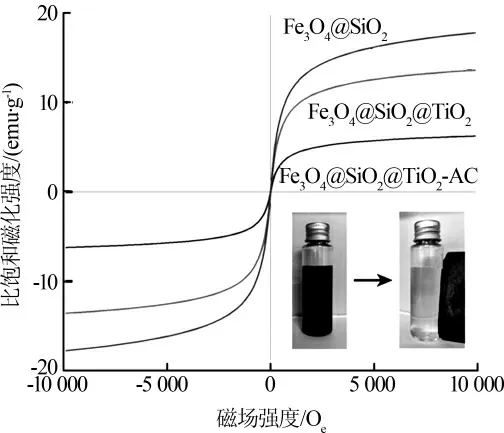
图3 Fe3O4@SiO2、Fe3O4@SiO2@TiO2和Fe3O4@SiO2@TiO2-AC 的磁滞回线
图3 中,Fe3O4@SiO2、Fe3O4@SiO2@TiO2、Fe3O4@SiO2@TiO2-AC 颗粒在室温下的比饱和磁化强度分别为17.8、13.61、6.25 emu/g。 可见包覆TiO2、复合AC 均会导致材料的比饱和磁化强度降低。 但由于材料均有极小的剩磁值和矫顽力,具备良好的超顺磁性,能够确保催化剂在外加磁场下有效快速地分离回收。 实际分离效果如图3 右下角所示,磁分离时间约为30 s。
2.2 试验条件对去除效果的影响
2.2.1 材料投加量对HA 降解的影响
对于初始质量浓度为5 mg/L、pH 为7 的HA 水样,考察了Fe3O4@SiO2@TiO2-AC 不同投加量下光降解60 min 的情况,如表1 所示。
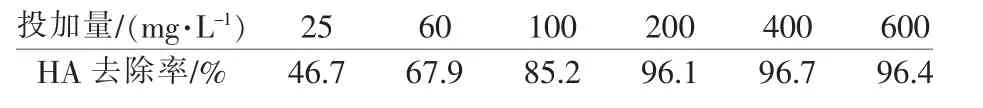
表1 催化剂投加量对光催化降解HA 的影响
试验发现, 一定范围内HA 的去除率与催化剂投加量呈正相关。分析认为,投加量增加可使光催化体系获得更多的电子-空穴对,提高光催化效率。 但当体系中的催化剂达到一定浓度后, 溶液中密度过高的催化剂颗粒对光源产生一定遮挡效应, 阻碍了光催化剂对光源的利用〔14〕。此外,数量较多的催化剂颗粒会形成聚集体, 不利于催化剂表面活性点位对污染物质的吸附及对光源的利用。兼顾使用成本,催化剂用量应存在一个最优值。在本研究中,催化剂投加量为200 mg/L 时,HA 降解率可达96.1%。
2.2.2 HA 初始浓度对HA 降解的影响
催化剂投加量为200 mg/L,HA 水样pH 为7,光降解60 min 时,HA 初始质量浓度对降解率的影响如表2 所示。

表2 HA 初始质量浓度对光催化降解HA 的影响
随着HA 初始质量浓度的增加,HA 去除率降低。一方面,单位时间内溶液中催化剂所产生的电子空穴对数量为定值,即氧化分解的污染物量一定,随着溶液中HA 质量浓度的增加, 所需完全降解的时间也就越长,即单位时间的去除率减少。 另一方面,HA 溶液自身有颜色, 且色度会随浓度的增加而增加,致使紫外光的穿透率越来越低,影响催化剂对光的利用,降低光催化反应速率。
2.2.3 溶液pH 对HA 降解的影响
催化剂投加量为200 mg/L,HA 水样初始质量浓度为5 mg/L,光降解60 min 时,溶液pH 对HA 降解率的影响如表3 所示。

表3 pH 对光催化降解HA 的影响
由表3 可见, 溶液pH 对HA 的降解效果影响显著,HA 降解率与溶液pH 呈负相关:当溶液pH>9时,HA 去除效果开始急剧降低。
一方面,有研究表明TiO2等电点约为6.0〔15〕,当溶液pH 高于等电点时,TiO2光催化剂表面为负电,且AC 因吸附水中OH-而带负电; 而HA 分子结构的—OH 和—COOH 使HA 也以负电离子状态存在。光催化剂与HA 之间因同为负电性而产生较大的静电斥力,不利于二者结合,导致HA 去除率较低。 当溶液pH 升高时,这种排斥作用愈加显著;相反,当溶液pH 小于TiO2等电点时,TiO2表面会带正电,有利于催化剂对HA 的吸附〔16〕。
另一方面,HA 在不同pH 条件下的水溶性不同:酸性条件下,HA 在水中的溶解度下降,部分HA会以胶体析出, 该部分HA 在测样前或被滤膜直接截留,使得水样UV254测量值偏低。 实际地表水体一般为中性,而Fe3O4@SiO2@TiO2-AC 在pH 为7 时对HA 有良好的去除效果,表明其具有实际应用价值。
2.3 光催化反应动力学
光催化属于非均相反应,一般来说,光催化动力学遵循Langmuir-Hinshelwood 模型(L-H 模型),模型的最终表达式如式(1)所示〔17〕。

式中:r——HA 在反应中的总反应速率,mg/(L·min);
C——t 时刻HA 质量浓度,mg/L;
K——光催化反应的表观一级降解速率常数,min-1。
对式(1)积分可得式(2)。

式中:C0—HA 的初始质量浓度,mg/L。
催化剂投加量为200 mg/L、pH=7 时, 不同HA初始质量浓度下,时间t 为横坐标,ln(C0/C)为纵坐标的拟合曲线如图4 所示,拟合数据如表4 所示。

图4 Fe3O4@SiO2@TiO2-AC 光催化降解HA 反应动力学

表4 不同HA 质量浓度下的一级反应常数
由表4 可见,R2在0.991 0~0.995 5 之间,说明t 和ln(C0/C)具有良好的线性关系,即Fe3O4@SiO2@TiO2-AC 对HA 的光催化降解反应动力学符合L-H模型。 由图4 可知,一级降解速率常数K 随HA 质量浓度的增加而降低,在低浓度下反应速率更高。
2.4 不同体系下HA 的降解情况
在催化剂投加量为200 mg/L、HA 初始质量浓度为5 mg/L、pH 为7 的条件下, 考察不同催化体系对HA 的降解效果,如图5 所示。
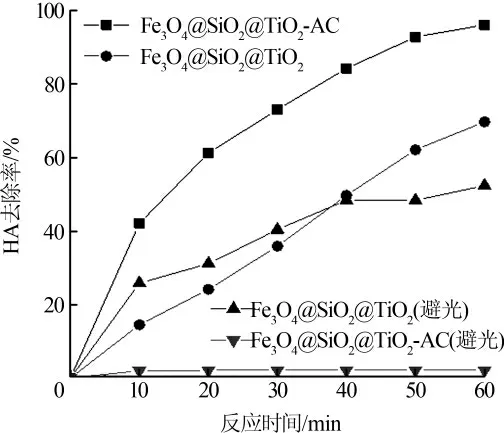
图5 不同体系下HA 的降解情况
由图5 可见, 避光条件下Fe3O4@SiO2@TiO2-AC与Fe3O4@SiO2@TiO2通过吸附作用去除HA,60 min时去除率分别为52.3%、2.1%,可见,AC 的复合可有效提高材料的吸附性能;在紫外光下,Fe3O4@SiO2@TiO2-AC 对HA 的去除效果明显优于Fe3O4@SiO2@TiO2,60 min 后去除率分别为96.1%、69.66%。
在紫外光照射下,TiO2价带的电子激发进入导带,具有还原能力的光生电子在导带上形成,具有氧化能力的光生载流子(空穴)在价带上形成。 在水溶液中,一般认为OH-和H2O 俘获载流子产生·OH,氧分子和光生电子产生具有强氧化性的·OH 和可氧化分解HA;HA 也可直接作为俘获剂俘获载流子进行氧化分解〔16〕。 AC 使复合材料的吸附性能得到提高, 从而使HA 分子在复合光催化剂表面更快速富集, 更高效地俘获游离·OH 进行降解,复合光催化剂表面的吸附点位也得到再生, 恢复强大的吸附性能, 以此循环,Fe3O4@SiO2@TiO2与AC 这种协同作用使得复合光催化剂具有更好的催化效能。 此外,AC 还可防止有机污染物分解的中间产物游离挥发,使降解更为彻底。
2.5 催化剂的循环使用性能
可重复利用性是衡量催化剂实际应用价值的重要因素。 将40 mg Fe3O4@SiO2@TiO2-AC 投加到200 mL 初始质量浓度为5 mg/L、pH 为7 的HA 水样中,光催化降解60 min 后磁分离,测定上清液UV254并计算HA 降解率。 催化剂分离后,用超纯水清洗、烘干,重复如上试验,5 次循环试验数据依次为96.1%、92.1%、89.9%、87.2%、84.7%。 以上数据表明,HA 降解率在5 次重复使用后仍可达到84.7%, 所制备光催化剂具有良好的可重复利用性。
3 结论
(1)采用共沉淀法耦合溶胶-凝胶法制备了Fe3O4@SiO2@TiO2颗粒,并将其负载在AC 表面,制备出新型光催化剂Fe3O4@SiO2@TiO2-AC。 制备的光催化剂呈结晶度良好的锐钛矿型结构, 比饱和磁化强度值6.25 emu/g,具备良好的超顺磁性,可在外加磁场作用下实现快速高效分离。
(2)光催化剂Fe3O4@SiO2@TiO2-AC 对pH 适应范围较宽,在酸性、中性和弱碱性条件下对水样中的HA 均有优良的光催化降解效能。 在400 W 高压汞灯照射下,光催化剂投加量为200 mg/L 时,对于初始质量浓度为5 mg/L、pH 为7 的HA 水样,经60 min的光催化降解,HA 去除率可达96.1%。
(3)Fe3O4@SiO2@TiO2-AC 对HA 的光催化降解反应符合Langmuir-Hinshelwood 动力学模型;Fe3O4@SiO2@TiO2与AC 的协同作用可有效提高光催化剂的活性。 Fe3O4@SiO2@TiO2-AC 具有良好的循环使用能力,在实际天然水体净化领域具有应用价值。