血栓性浅静脉炎新处方的成分-靶点网络药理作用研究
2020-08-25王玉涛张幼雯宋奎全
王玉涛,庞 雪,张幼雯,宋奎全,孙 庆
血栓性浅静脉炎(superficial thrombophlebitis,STP)是常见的外周血管疾病,好发于四肢及胸腹壁浅静脉。据统计,STP发病率约为0.6‰[1]。有证据显示,STP与下肢深静脉血栓形成(deep venous thrombosis, DVT)和肺栓塞(pulmonary embolism, PE)发病关系密切[2]。中医药治疗STP历史悠久,效果显著且并发症少,临床应用愈加广泛。笔者[3]前期运用中医传承辅助平台(V2.5)对近30年中国知网(CNKI)收录的中医药治疗STP的文献进行数据挖掘,并利用平台的熵层次聚类[4]等无监督数据挖掘方法,将中医药治疗STP的药物之间的关联性进行定量描述,并将核心组合进一步演化、提取,总结出治疗STP的候选新处方。目前中医药治疗STP的基础研究较少,为进一步明确中医药干预STP的机制,本文以网络药理学理论[5]为指导,将新处方中药物的主要化学成分、关键靶点及其干预STP的相关信号通路等进行挖掘筛选,构建“药物-成分-靶点-疾病”复杂网络,为中医药治疗STP的基础研究提供新的思路。
1 资料与方法
1.1 新处方药物入血活性成分筛选 前期笔者利用中医传承辅助平台(V2.5)挖掘总结获得治疗STP的新处方——当归、赤芍、丹参、牛膝[3]。通过检索西北农林科技大学设计开发的中药系统药理学数据库和分析平台(TCMSP),对新处方药物所有成分数据进行挖掘[6]。以药代动力学参数(ADME)为依据,将药物口服生物利用度(oral bioavailability, OB)≥30,药物相似度(drug-likeness,DL)≥0.18设为条筛选条件[7],过滤获得新处方药物入血活性成分,建立数据库。
1.2 新处方药物化学成分靶点的获取及收集 利用TCMSP数据库中的“靶点预测”功能,将新处方药物入血活性成分的作用靶点导出,建立数据库。UniProt(http://www.uniprot.org/) 是蛋白质序列和注释数据的综合数据库,包含1.2亿种蛋白质的序列和注释信息[8]。登陆UniProt Knowledgebase(UniProt KB),导出物种为“人”的数据,利用perl语言工具(http://www.perl.org/)校正预测的靶点名称。
1.3 STP靶点的获取及收集 DisGeNET(http://www.disgenet.org/)数据库是包含人类疾病及相关基因靶点的数据库之一,包含17549种基因、24166种疾病以及628685种疾病-基因互作关系[9]。GeneCards(https://www.genecards.org/) 数据库是一个可以分析人类基因数据的综合数据库,其主要功能包括分析基因的表达、功能途径、蛋白质与蛋白质的相互作用、基因与疾病的关系等[10]。人类在线孟德尔遗传平台(OMIM, http://www.ncbi.nlm.nih.gov/omim)是一个记录所有已知疾病的遗传成分,并预测它们与人类基因组中相关基因的关系的数据库[11]。使用上述3个数据库,分别检索并获取STP相关靶点,将上述检索结果去重后取交集,获得与STP相关的靶点。运用生物信息学与进化基因组学网站的韦恩图绘制功能(http://bioinformatics.psb.ugent.be/webtools/Venn/),将新处方药物作用靶点和STP相关靶点取交集,并绘制韦恩图。
1.4 药物-成分-靶点-疾病网络的构建 使用Cytoscape 3.7.2软 件(http://www.cytoscape.org)构建“药物-成分-靶点-疾病”关系网络。网络中的节点(Node)代表新处方药物组成药物、药物有效成分、STP及其相关靶点;边(Edge)代表药物-成分、成分-靶点、靶点-疾病之间的连接。整个网络构建并展示了“药物-成分-靶点-疾病”之间的联系,通过这一网络可以深入分析新处方药物干预STP的作用机制。以网络节点度值(Degree)和中介中心度(Betweenness centrality)为筛选条件,挖掘网络核心节点。
1.5 关键靶点蛋白相关作用(protein-protein interaction, PPI)网络的构建 使用STRING数据库(https://string-db.org)预测蛋白质之间的相互作用。STRING数据库系统可对通过不同方式获得的预测结果进行评分,分值越高,表示PPI结果的置信度越高。本研究利用STRING数据库的“Multiple Proteins”功能,设定“物种”为人类(Homo Sapiens),将新处方药物干预STP的关键靶点导入系统检索,设定评分分值>0.9,即可构建PPI网络,并获得节点度值等反映靶标蛋白相互关系的信息。
1.6 关键靶点的通路分析 Bioconductor是目前最常用的,以R语言为平台的高通量基因组数据分析工具之一,可提供包含人类在内的19个物种的GO注释信息[12]。ClusterProfiler是常用的基因数据分析的R语言工具之一,可利用Bioconductor提供的KEGG pathway数据库(http://rest.kegg.jp/link/hsa/pathway)进行信号通路富集分析[13]。本研究利用perl语言工具将新处方药物干预STP的关键靶点名称转换为entrez ID,运用上述工具,以P<0.05为条件进行信号通路富集分析,并将富集结果可视化。
2 结果
2.1 新处方药物入血活性成分筛选 通过TCMSP数据库检索新处方药物有效成分,以OB≥30%和DL≥0.18为条件进一步筛选,得到新处方药物入血活性成分,见表1。
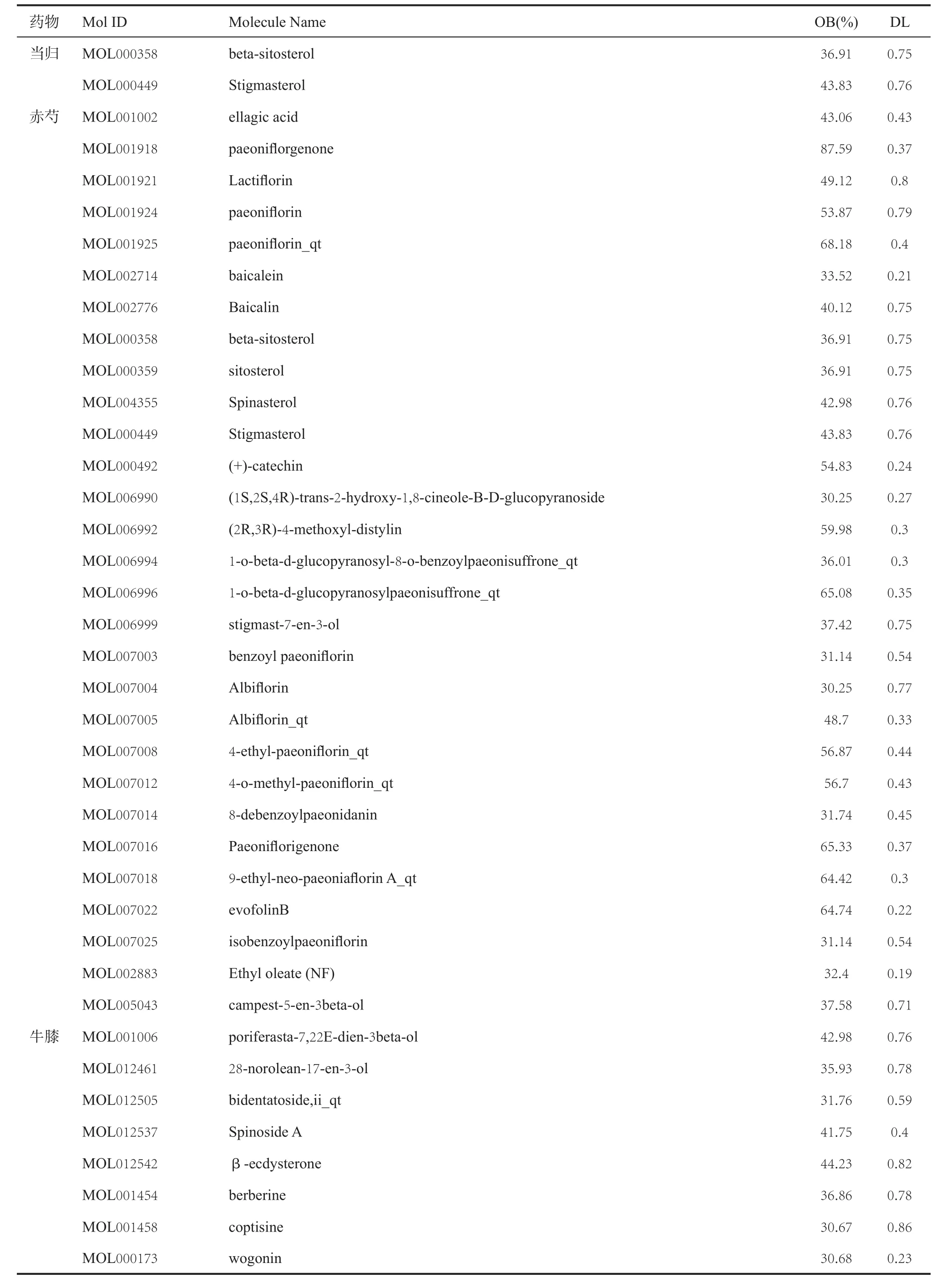
表1 新处方药物入血活性成分

药物 Mol ID Molecule Name OB(%) DL牛膝 MOL002643 delta 7-stigmastenol 37.42 0.75 MOL002714 baicalein 33.52 0.21 MOL002776 Baicalin 40.12 0.75 MOL002897 epiberberine 43.09 0.78 MOL000358 beta-sitosterol 36.91 0.75 MOL003847 Inophyllum E 38.81 0.85 MOL000422 kaempferol 41.88 0.24 MOL004355 Spinasterol 42.98 0.76 MOL000449 Stigmasterol 43.83 0.76 MOL000785 palmatine 64.6 0.65 MOL000085 beta-daucosterol_qt 36.91 0.75 MOL000098 quercetin 46.43 0.28丹参 MOL001601 1,2,5,6-tetrahydrotanshinone 38.75 0.36 MOL001659 Poriferasterol 43.83 0.76 MOL001771 poriferast-5-en-3beta-ol 36.91 0.75 MOL001942 isoimperatorin 45.46 0.23 MOL002222 sugiol 36.11 0.28 MOL002651 Dehydrotanshinone II A 43.76 0.4 MOL002776 Baicalin 40.12 0.75 MOL000569 digallate 61.85 0.26 MOL000006 luteolin 36.16 0.25 MOL006824 α-amyrin 39.51 0.76 MOL007036 5,6-dihydroxy-7-isopropyl-1,1-dimethyl-2,3-dihydrophenanthren-4-one 33.77 0.29 MOL007041 2-isopropyl-8-methylphenanthrene-3,4-dione 40.86 0.23 MOL007045 3α-hydroxytanshinoneⅡa 44.93 0.44 MOL007048 (E)-3-[2-(3,4-dihydroxyphenyl)-7-hydroxy-benzofuran-4-yl]acrylic acid 48.24 0.31 MOL007049 4-methylenemiltirone 34.35 0.23 MOL007050 2-(4-hydroxy-3-methoxyphenyl)-5-(3-hydroxypropyl)-7-methoxy-3-benzofurancarboxaldehyde 62.78 0.4 MOL007051 6-o-syringyl-8-o-acetyl shanzhiside methyl ester 46.69 0.71 MOL007058 formyltanshinone 73.44 0.42 MOL007059 3-beta-Hydroxymethyllenetanshiquinone 32.16 0.41 MOL007061 Methylenetanshinquinone 37.07 0.36 MOL007063 przewalskin a 37.11 0.65 MOL007064 przewalskin b 110.32 0.44 MOL007068 Przewaquinone B 62.24 0.41 MOL007069 przewaquinone c 55.74 0.4 MOL007070 (6S,7R)-6,7-dihydroxy-1,6-dimethyl-8,9-dihydro-7H-naphtho[8,7-g]benzofuran-10,11-dione 41.31 0.45 MOL007071 przewaquinone f 40.31 0.46 MOL007077 sclareol 43.67 0.21
2.2 新处方药物干预STP的作用靶点预测 通过检索TCMSP数据库及靶点模型预测,汇总并去重后,得到新处方药物的作用靶点,其中当归相关靶点29个,赤芍相关靶点74个,丹参相关靶点60个,牛膝相关靶点96个。通过DisGeNET数据库、GeneCards平台和OMIM平台收集STP相关靶点11984个。运用生物信息学与进化基因组学网站的韦恩图绘制功能,将新处方药物作用靶点和STP相关靶点取交集,获得新处方药物干预STP的靶点101个,绘制韦恩图(图1)。
2.3 药物-成分-靶点-疾病网络构建 利用网络图形化工具Cytoscape 3.7.2对新处方药物干预STP的作用靶点进行关系网络绘制和统计,得到网络关系图,见图2。
2.4 新处方药物干预STP靶点PPI网络分析结果 登陆STRING数据库,上传新处方药物干预STP的靶点,设定 置信度评分分值>0.9,将独立于网络之外的蛋白予以排除,得到PPI网络(图3)。该网络共包含节点100个,边209条,平均度值为4.18。网络中的“节点”代表靶点,“边”表示靶点间的相互作用关系。Degree和BC反映了节点在网络中核心度的高低,度值越高,表 明该节点在网络中就越重要。本研究运用Cytoscape软件中的cytoNCA插件[14],按Degree值和BC值大小排序筛选新处方药物干预STP的核心成分和靶点,并构建网络图(图4)。结果表明,槲皮素(MOL000098)、山奈酚(MOL000422)、豆甾醇(MOL000449)等有效成分以及PTGS1、NCOA2、NCOA1等靶点度值较高,说明这些有 效成分和靶点在网络中的作用显著,是和其他靶点互通的纽带。

图1 新处方药物作用靶点及STP相关靶点韦恩图

图2 新处方药物干预STP的药物-成分-靶点-疾病网络关系

图4 核心成分及靶点网络图
2.5 关键靶点基因生物功 能及通路分析以Bioconductor和ClusterProfiler为平台分析新处方药物干预STP靶点的KEGG pathway信号通路富集分析。结果表明,KEGG通路富集得出121条结果,有106条通路的P值<0.01。以P值和基因的数量为筛选条件,取前20位的通路进行分析并可视化,结果表明,基因显著富集在流体剪切应力与动脉粥样硬化、TNF、p53、AGE-RAGE等信号通路上(图5)。

图5 关键靶点KEGG通路富集分析
3 讨论
中医药干预STP效果显著,但基础研究较少,其具体作用机制尚不完全明确。本研究以网络药理学理论为指导分析发现,新处方中当归、赤芍、丹参、牛膝4味药物中的槲皮素、山奈酚、豆甾醇等有效成分可以通过介导PTGS1、NCOA2、NCOA1等靶点,调控流体剪切应力与动脉粥样硬化、TNF、p53、AGE-RAGE等信号通路发挥干预STP的作用。
槲皮素是黄酮类化合物,在植物中广泛存在。国外学者通过实验发现[15-16],槲皮素可以抑制血小板的凝血功能,有效增加小鼠的血液灌注量。孙军等[17]发现,槲皮素可通过激活PI3K/Akt信号通路,对过氧化氢(H2O2)诱导的血管内皮祖细胞(endothelial progenitor cells, EPCs)氧化应激损伤起到修复作用。豆甾醇是植物甾醇的一种,化学结构是C29H48O,双键结构使其易于被氧化,可有效降低氧化应激[18]。黄建春等[19]发现,玉郎伞中的豆甾醇对连苯三酚氧自由化产生氧自由基和邻二氮菲-Fe2+/H2O2产生羟自由基(OH)有显著的清除和抑制作用,证实豆甾醇具有体外抗氧化活性。山奈酚是黄酮类化合物,多见于洋葱、白菜、茶叶等植物中。康桂兰等[20]研究发现,山奈酚可以介导AMPK-Nrf2-HO-1信号通路,发挥抑制氧化型低密度脂蛋白(oxidized low-density lipopro-tein, ox-LDL)诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)活力降低作用,抑制细胞凋亡和炎性因子、黏附分子的表达,缓解氧化应激反应。
前列腺素内过氧化物合酶(prostaglandin endoperoxide synthase, PTGS)也称环氧合酶(cyclooxygenase, COX),有两个亚型,即PTGS1(COX-1)和PTGS2(COX-2)。研究发现,在特定的病理状态下,COX-2表达抑制,COX-1表达增多,可导诱导血栓素A2(thromboxane A2, TXA2)合成增多,进而诱发血管收缩,导致管腔狭窄、血液不正常凝集,形成血栓[21]。类固醇激素受体的辅助激活因子(steroid receptor coactivator,SRC)包含SRC-1(NCOA1)、SRC-2(NCOA2/Tif2)和 SRC-3(NCOA3/RAC3/TRAM-1)3个家族成员。Yu等[22]研究发现,NCOA2基因的表达可以调控Wnt/β-catenin信号通路激活表达。研究证实Wnt信号参与多种血管疾病的病理生理过程,包括脂质浸润、炎症、纤维化、钙化和血管生成等[23]。上述研究从侧面反映了NCOA2可能通过上调Wnt/β-catenin信号通路的表达参与静脉管壁病理性改变,但NCOA2和循环系统疾病关系的研究较少,二者的关系还需进一步研究发掘。
研究证实,病理性剪切力会激活内皮细胞活性,使之由抗栓向促栓转变,诱导促血小板黏附等病理性改变,诱发内皮细胞炎性改变[24-26]。糖基化终末产物(advanced glycation end products,AGE)及其受体(receptor for AGE,RAGE)被证实可以引起氧化应激和炎症反应[27]。Wang等[28]证实,脂多糖(lipopolysaccharide, LPS)可激活NF-κB信号通路,增加血管内皮细胞通透性,而RAGE在这一过程中起到关键作用。Yokoyama等[29]研究发现,内皮p53可以负反馈条件内皮依赖性血管舒张和缺血诱导的血管生成,介导缺血性内皮损伤。Song等[30]研究证实,p53可介导长链非编码RNA Meg3的信号传导,调节VEGF、HIF-1α、CRP和ICAM等p53相关基因的表达,减轻血管紧张素II诱导的人脐静脉内皮细胞损伤。肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)是重要的炎症反应介质,可上调内皮细胞和白细胞中ICAM-1的表达,增强白细胞与血管内皮之间的黏附反应,介导炎症反应[31]。实验研究证实,静脉炎模型兔体内的TNF-α、IL-6、IL-1β等炎性指标显著高于空白组[32]。Poredoš等[33]通过检测急性血栓性浅静脉炎患者血液炎症指标,如TNF-α等水平发现,血液炎症标志物水平与血栓性浅静脉的再通率呈负相关,表明炎症可能通过促凝血和抗纤溶作用抑制血栓的溶解,影响静脉的再通。
综上所述,本研究在网络药理学理论指导下,对新处方药物干预STP的机制进行预测,结果表明,新处方药物的槲皮素、山奈酚、β-谷甾醇等核心成分可能通过调控PTGS1、NCOA1、NCOA2等靶点,介导流体剪切应力与动脉粥样硬化、AGE-RAGE、p53、TNF-α等信号通路发挥抑制炎性反应、保护内皮细胞等药理作用。目前,STP与上述核心成分、关键靶点和通路的相关性研究较少,本研究结果可为中医药干预STP的机制研究提供新的思路。本研究存在一定的局限性,一是各大数据库存储的资料不完整;二是中药有效成分复杂,且给药方式多样,在体内的代谢过程不能完全明确;三是药物有效成分及其靶点的筛选过程会受到研究者的主观态度影响。因此,中医药治疗STP的机制有待进一步实验验证。
