玉米须多糖对高糖诱导的肾小球系膜细胞增殖及炎症因子表达的影响
2020-08-25侯勤龙翁诗雅高润泽董志恒
曲 萌,侯勤龙,翁诗雅,高润泽,宋 宇,董志恒
(北华大学医学院,吉林 吉林 132013)
糖尿病肾病(diabetic nephropathy,DN)是导致终末期肾衰竭及糖尿病患者死亡的重要原因,其发病机制复杂,与氧化应激、细胞增殖、炎症反应、糖脂代谢紊乱、遗传易感性等多种因素密切相关[1-3].DN的主要病理改变为肾脏纤维化,临床表现为肾小球硬化和肾小管间质纤维化.有研究[4]表明,炎症因子单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)和白介素-6(interleukin-6,IL-6)在糖尿病的炎症反应及肾间质纤维化中具有关键作用.肾小球系膜细胞(glomerulus mesangial,GMC)作为DN的主要靶细胞,在高糖的刺激下,会由静息状态转为增殖活化状态,同时分泌大量细胞因子,合成大量的系膜基质,表现为肾小球肥大、肾小球基膜增厚和细胞外基质(ECM)积聚,导致肾小球硬化的发生[5].故探讨抑制系膜细胞增生及减轻炎症反应的药物,对延缓DN的发生、发展具有重要的临床意义.
玉米须多糖(Stigma maydis polysaccharide,SMP)是玉米须中主要的水溶性成分,由葡萄糖、半乳糖、阿拉伯糖、甘露糖、鼠李糖组成[6],具有降脂降糖、抗疲劳、抗氧化等多种药用活性[7-8],但其对高糖下大鼠GMC增殖及炎症因子表达的影响尚未见报道.本研究以大鼠GMC株HBZY-1为研究对象,观察SMP对高糖诱导下大鼠HBZY-1细胞增殖、炎症因子MCP-1、IL-6在基因及蛋白水平表达的影响,旨在探讨玉米须多糖对糖尿病肾病的防治作用及可能机制.
1 材料与方法
1.1 主要材料与试剂
正常大鼠GMC株(HBZY-1,中国医学科学院基础医学研究所细胞中心);兔抗MCP-1、IL-6多克隆抗体、鼠抗β-actin单克隆抗体、ECL增强发光试剂盒(Santa Cruz公司,美国);抗兔二抗、抗鼠二抗(北京中杉金桥生物技术有限公司);引物由上海生工生物工程股份有限公司合成;荧光实时定量PCR试剂盒(上海睿铂赛生物技术有限公司);玉米须多糖(吉林大学药学院提供);其他试剂均为国产分析纯.
1.2 方 法
1.2.1 HBZY-1细胞培养与分组
从液氮中取出HBZY-1细胞冻存管后,迅速复苏,接种于含15%胎牛血清(FBS)的DMEM低糖培养基中,5% CO2,37 ℃培养,24 h半量换液,以后每2~3 d完全更换培养液1次,换液过程中逐渐将FBS浓度降为10%,待细胞长满至平底后用0.25%胰酶消化,进行细胞传代.对对数生长期的细胞进行分组处理:正常对照组(NG组,DMEM低糖培养液培养),高糖组(HG组,25.0 mmol/L葡萄糖的DMEM高糖培液培养),高糖+玉米须多糖35 μg/mL组(低剂量组,SMP35组),高糖+玉米须多糖70 μg/mL组(高剂量组,SMP70组).
1.2.2 MTT法检测不同培养条件下HBZY-1细胞的增殖
取5代HBZY-1细胞,用含15%FBS的DMEM低糖培养液以1×104/mL接种于96孔板中,贴壁后同步化(含0.5%FBS的DMEM低糖培养液)24 h,按组别加入相应培养条件,每组设5个复孔,继续培养24、48、72 h.在预定时间点,每孔加入5 mg/mL的MTT溶液20 μL,37 ℃继续孵育4 h,弃去孔内上清,每孔加入150 μL DMSO,震荡溶解结晶物10 min,在酶标仪490 nm处检测各孔吸光度值,以吸光度值表示各组HBZY-1细胞的增殖.
1.2.3 RT-qPCR法检测HBZY-1细胞中MCP-1、IL-6 mRNA表达
Trizol提取总RNA,反转录合成cDNA后进行定量PCR扩增.反应体系:cDNA 1 μL,上下游引物各1 μL,总体积20 μL,反应条件:95 ℃预变性10 min,(95 ℃ 15 s,60 ℃ 30 s)× 40循环,每个样本设5个复孔.引物序列为:MCP-1上游引物5′-CCAGAAAC CAGCCAACTCTC-3′,下游引物5′-TGAGGTGGTTGT GGAAAAGA-3′;IL-6上游引物5′-AGTTGCCTTCTTG GGACTGA-3′,下游引物5′-GAGCATTGGAAGTTGG GGTA-3′;GAPDH上游引物5′-ACAGCAACAGGGTG GTGGAC-3′,下游引物5′-TTTGAGGGTGCAGCGAA CTT-3′.采用2-ΔΔCT法计算各实验组HBZY-1中目的基因mRNA含量,若2-ΔΔCT>1,则提示目的基因表达量升高,若2-ΔΔCT<1,则提示目的基因表达量下降.
1.2.4 Western Blot法检测HBZY-1细胞中MCP-1、IL-6蛋白表达
各实验组作用48 h后,收集细胞,每组样品各加50 μL蛋白裂解液,4 ℃ 2 h,10 000 r/min 离心5 min,留上清,测定浓度,定量后加入上样缓冲液,煮沸5 min,使其变性.各取50 μg蛋白样品上样,10% SDS-PAGE电泳后转移至PVDF膜,含5% 脱脂奶粉封闭1 h.按说明书所示比例将一抗加入封闭液中,4 ℃孵育过夜,TBST洗膜后加入相应二抗,37 ℃孵育2 h,TBST洗膜,ECL增强发光试剂盒A、B液1∶1显色处理,ECL发光仪进行图像采集及数据处理.蛋白表达水平=每个样本条带的吸光度值/β-actin的吸光度值.
1.3 统计学分析

2 结 果
2.1 SMP对高糖诱导下HBZY-1细胞增殖的影响
MTT检测结果显示:与NG组比较,细胞培养24 h后,HG组HBZY-1细胞增殖加快(P<0.01),48 h后,高糖促进HBZY-1细胞增殖的作用更为显著;SMP35组HBZY-1细胞增殖均显著加快(P<0.01或P<0.05),SMP70组24 h时增殖显著加快(P<0.05),48 h时与NG组无显著性差异.与HG组比较,SMP干预组HBZY-1细胞增殖均有显著性降低(P<0.01),且呈浓度依赖关系,同时,随着时间的延长,抑制效果越为显著.细胞培养72 h后,高糖对HBZY-1细胞的增殖开始呈现抑制作用,各组数据比较差异无统计学意义(P>0.05).见表1.
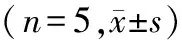
表1 不同浓度的SMP对HBZY-1细胞增殖的影响
2.2 SMP对高糖诱导下HBZY-1细胞中MCP-1表达的影响
研究[9-10]表明:高糖可促进DN患者MCP-1表达,而局部组织中MCP-1表达增加可使炎症状态延长,导致肾组织损伤.本实验结果显示:在mRNA水平上,各高糖组MCP-1 mRNA的基因表达丰度均高于NG组(P<0.01),其中HG组比NG组高3.04倍;两个SMP干预组与HG组比较均呈显著下降(P<0.01或P<0.05).见图1.在蛋白水平方面,MCP-1在NG组HBZY-1细胞中表达量较低(0.24±0.03),与NG组比较,高糖诱导48 h后MCP-1表达上调(P<0.01或P<0.05);与HG组(0.72±0.06)比较,两个SMP干预组MCP-1表达均显著下调(P<0.01),其中SMP70组下调更为显著,但两SMP干预组间比较差异无统计学意义(P>0.05).见图2.提示,质量浓度为35~70 μg/mL的SMP在基因及蛋白水平均可显著下调高糖诱导下HBZY-1细胞中MCP-1的表达.
2.3 SMP对高糖诱导下HBZY-1细胞中IL-6表达的影响
在高糖环境下,DN患者IL-6的表达水平较高,且血清IL-6含量与患者的尿蛋白排泄率呈正相关[10].本研究RT-qPCR检测结果显示:高糖刺激48 h后,HBZY-1细胞中IL-6 mRNA表达上调,与HG组比较,SMP35组和SMP70组IL-6 mRNA表达显著下调(P<0.01或P<0.05),且呈剂量依赖关系.见图3.我们进一步应用Western Blot法检测了IL-6蛋白表达,各实验组HBZY-1细胞中IL-6蛋白表达与mRNA表达趋势相似,具体表现:与NG组(0.20±0.04)比较,HG组显著增高(P<0.01);与HG组(0.85±0.07)比较,两个SMP干预组IL-6蛋白表达均显著下调(P<0.01或P<0.05).见图4.
3 讨 论
在糖尿病肾病(DN)中,肾小球系膜细胞(GMC)是多种致病因素作用的主要靶细胞.正常生理条件下,GMC几乎不增殖,但高糖可诱导其发生异常增殖[11],成为最活跃的肾固有细胞,这在本实验中亦得到了证实.增殖的GMC通过分泌大量的细胞外基质及伸入肾小球中使其发生狭窄甚至闭塞,进而导致肾小球硬化的发生.长期的慢性微炎症与GMC的过度增殖密切相关,加速DN的发生发展[12],其中被广泛认可的炎症因子有白介素(IL)、单核细胞趋化蛋白-1(MCP-1)、肿瘤坏死因子受体-α(TNF-α)等[13-14].
MCP-1又称趋化因子配体2(CCL2),是趋化因子家族中的小细胞因子,具有趋化和激活单核巨噬细胞的功能,后者浸润肾组织,产生氧自由基、一氧化氮合酶、IL-8、转化生长因子等[15],从而造成血管内皮细胞损伤,促进肾小球纤维化.有研究[16-17]表明:在DN患者及DN动物模型的肾组织中,MCP-1水平明显升高,同时,DN患者血清和尿液中MCP-1含量也增加,其水平与DN的临床阶段相关,即在DN微量蛋白尿期出现显著升高,随着病程进展,尿微量白蛋白也增加.通过对MCP-1缺乏的小鼠观察发现[18],STZ诱导的糖尿病(DM)小鼠肾组织中巨噬细胞浸润减少,糖尿病肾损伤的进展延缓.可见,MCP-1在DN进展中起关键作用,抑制MCP-1信号传导可能是治疗DN的重要靶标.在本实验中,与NG组比较,各高糖组MCP-1在mRNA和蛋白水平的表达均升高,这与WINTER L等[9]和SU H等[10]的研究的结果相一致.
有研究[17-19]证实:在DN大鼠模型中,肾皮质及尿液中IL-6水平均显著增加,与无肾病的DM患者比较,DN患者血清中IL-6水平增高,IL-6的增加程度与肾损伤程度呈正相关.在本实验中,与正常对照组比较,高糖模型组HBZY-1细胞中IL-6显著增加.作为炎性因子,IL-6导致肾小球滤过膜通透性异常、系膜细胞发生肿胀、纤维连接蛋白表达上调,可见,IL-6水平检测亦可作为DN进展的重要标志.
玉米须是禾本科植物玉米的干燥花柱和柱头,是传统中医常用药物之一.玉米须性甘味平,具有利水消肿、利湿退黄的功效,临床上主要用于消渴、水肿、眩晕等症状的治疗,对人体无急、慢性毒副作用.玉米须多糖(SMP)是玉米须水提产物,大部分是由戊糖和己糖聚合而成.有报道[20-22]显示:SMP不仅能显著降低STZ诱导的DM动物模型的血糖,还显著降低肾脏指数、24 h尿蛋白、血清中总胆固醇和甘油三酯等指标的水平,其降糖效果呈现量效关系,其中高剂量组与二甲双胍治疗效果相当.此外,玉米须的水提物可抑制肾组织中TGF-β1的表达,下调纤维连接蛋白的合成,减轻细胞外基质的过度聚积,从而延缓DN的进一步发展[23].
本实验采用了高、低两个剂量的SMP干预高糖下大鼠GMC株HBZY-1的培养,结果显示:35~70 μg/mL的SMP可在一定程度上抑制高糖诱导的HBZY-1细胞的过度增殖(P<0.01),且呈现浓度依赖关系.我们通过mRNA和蛋白水平进一步观察不同浓度的SMP对高糖下HBZY-1中炎症因子MCP-1、IL-6含量的影响,结果显示:与HG组比较,高、低剂量SMP干预组均可显著下调MCP-1、IL-6的表达(P<0.01或P<0.05).SMP对HBZY-1细胞增殖的抑制作用及对炎症因子MCP-1、IL-6的下调作用的结果提示,一定浓度的SMP可在一定程度下保护高糖下的HBZY-1细胞,并具有潜在的DN防治作用,但其具体作用机制有待进一步深入研究.
致谢:本文是国家级大学生创新创业训练计划项目研究成果的一部分,北华大学医学院15级学生张娜娜、郭萌颖,18级学生尹含钰、郑鸿、王思琪参加了本实验工作,在此表示感谢.
