D-对羟基苯甘氨酸生产新工艺研究
2020-08-24林韦康江晓明钱程良高奇
林韦康 江晓明 钱程良 高奇


摘 要: 为了开发一种成本更低、安全可控、环境友好的D-对羟基苯甘氨酸生产工艺,提出了一种以水为溶剂,质量分数为75%的磷酸为拆分剂,水杨醛为消旋催化剂的新方法对DL-对羟基苯甘氨酸进行拆分。考察发现当n(75%磷酸)∶n(DL-对羟基苯甘氨酸)= 1.1时拆分效果最好,当n(水杨醛)∶n(L-对羟基苯甘氨酸)= 0.20且消旋时间为5 h时最适宜,当反应液pH=6.0时产品收率及质量最佳。该工艺制备的产品质量分数为99.6%,比旋光度为-158.9°,酸吸光值为0.009,碱吸光值为0.010,符合工业化生产要求。
关 键 词:D-对羟基苯甘氨酸;拆分;消旋;生产工艺;工业化生产
中图分类号:TQ 03-39 文献标识码: A 文章编号: 1671-0460(2020)06-1135-04
Study on a Novel Production Process of D-p-Hydroxyphenylglycine
LIN Wei-kang1, JIANG Xiao-ming1, QIAN Cheng-liang1, GAO Qi2
(1. Zhejiang Yuntao Biotechnology Co., Ltd., Shaoxing Zhejiang 312369, China;
2. Aiyinuo Technology Co., Ltd., Zhuji Zhejiang 311800, China)
Abstract: In order to develop a cheap safe controllable environmentally friendly production process of D-p-Hydroxyphenyl-glycine,a new method with water as solvent,75% phosphoric acid as resolution agent, salicylaldehyde as racemic catalyst was used for resolution of DL-p-hydroxyphenylglycine. The results showed that,when n(75% phosphoric acid) : n(DL-p-Hydroxyphenylgly-cine) was 1.1,the resolution effect was the best; when n(salicylaldehyde) : n(L-p-Hydroxyphenylglycine-) was 0.20, suitable racemization time was 5 h ;when pH was 6.0, the product yield was the highest and the product quality was the best. The quality indexes of product prepared by this process were as follows: the content 99.6%, specific rotation -158.9°,absorbance(c=5,1N HCl) 0.009, absorbance(c=5,1 N NaOH)=0.010. The process can meet the industrial production requirements, providing quite good reference for related enterprises.
Key words: D-p-hydroxyphenylglycine; Resolution; Racemization; Production process; Industrial production
对羟基苯甘氨酸(D-p-Hydroxyphenylglycine),分子式C8H9NO3,分子量167.16,是以苯酚为起始原料,先经合成反应制得DL-对羟基苯海因或DL-对羟基苯甘氨酸,再经酶法(原料为DL-对羟基苯海因)或化学拆分(原料为DL-对羟基苯甘氨酸)制得。D-对羟基苯甘氨酸是合成β-内酰胺类半合成广谱抗生素(如青霉素类、头孢菌素类等)侧链的重要原料,也是合成抗菌和抗病毒药物、人工甜味剂的重要中间体[1-2]。2017年6月6日,世卫组织在《2017年基本药物标准清单》中将阿莫西林这种广泛用于治疗肺炎等感染的抗生素划归为“可用
类”[3]。另外,随着国家安全、环保整治力度的加大,国内很多安全或环保不达标的D-对羟基苯甘氨酸生产企业永久退出市场,在这样的背景下,开发一种更安全、更环保、成本更低的D-对羟基苯甘氨酸生产工艺是非常有意义的。
目前,国内DL-对羟基苯海因和DL-对羟基苯甘氨酸的生产工艺已经相对成熟,生产成本已基本没有下浮空间,但国内外D-对羟基苯甘氨酸生产企业的工艺水平参差不齐,这里对典型的几種D-对羟基苯甘氨酸生产工艺进行比较分析。
第一种,以D-3-溴樟脑-8-磺酸或1-苯基乙磺酸或萘酚磺酸或邻甲基苯磺酸为拆分剂,在催化剂水杨醛的存在下,边拆分DL-对羟基苯甘氨酸边消旋L-对羟基苯甘氨酸,得到D-对羟基苯甘氨酸拆分剂复盐,再经水解制得D-对羟基苯甘氨酸,水解母液用酸再生得到可以循环套用的拆分剂[4-9]。
该生产工艺是目前被D-对羟基苯甘氨酸生产企业广泛采用生产方法。随着近年来国家环保整治力度的加大,以1-苯基磺乙酸为首的生产企业逐渐减少,致使相关的拆分剂价格水涨船高。以D-对羟基苯甘氨酸拆分剂单耗50 kg计,每生产1 t D-对羟基苯甘氨酸,仅拆分剂原料费用就高达7 500元。
第二种,以DL-对羟基苯甘氨酸为原料,在甲醇溶剂中,用浓硫酸或氯化亚砜先进行酯化制得DL-对羟基苯甘氨酸甲酯,再与D-酒石酸成盐,最后经水解得到D -对羟基苯甘氨酸[10-12]。
该生产工艺目前基本还停留在实验室阶段,这种生产方法需对原料DL-对羟基苯甘氨酸进行除水处理,增加了原料干燥成本,另外甲醇溶剂套用过程中也需对甲醇进行精馏除水,需增加精馏塔等生产装置,安全风险较高,同时三废较多(使用浓硫酸产生大量废酸,使用氯化亚砜产生大量废气)。
第三种:将DL-对羟基苯甘氨酸转化为盐,再在合适的溶剂中加入其对映体的相应盐的少量晶体作为晶种,实施优先结晶法,对析出的D-对羟基苯甘氨酸盐晶体进行离心分离,D-对羟基苯甘氨酸盐晶体中和即得D-对羟基苯甘氨酸。据文献[13-15]报道,对羟基苯甘氨酸苯磺酸盐、对羟基苯甘氨酸对乙基苯磺酸盐、对羟基苯甘氨酸萘酚磺酸盐等均可采用优先结晶法拆分DL-对羟基苯甘氨酸盐。
该生产工艺因对温度和离心分离时间的把控要求较高,同时工序繁琐,一次收率低,不合格的D-对羟基苯甘氨酸盐还需要频繁精制,目前采用此生产工艺的厂家较少。
第四种:以DL-对羟基苯海因为起始原料,利用生物酶对其进行选择性水解制得D-对羟基苯甘氨酸[16-18]。
该种生产工艺所需的起始原料DL-对羟基苯海因制备过程产生大量废酸和含酚废水,另外生物酶工业固定化技术还不够完善,再者,通过该生产工艺制得的D-对羟基苯甘氨酸的水溶液中的目标产物质量分数在仅2.5%左右,需要蒸发大量水,能耗较高,目前较少厂家采用此生产工艺。
本文以水为溶剂,采用稍过量的质量分数为75%的磷酸为拆分剂与DL-对羟基苯甘氨酸成复盐,确保反应体系溶清的状态下,加入适量D-对羟基苯甘氨酸磷酸复盐晶种,常压蒸出适量的水,降温至合适的温度放料离心,得到的D-对羟基苯甘氨酸磷酸复盐去水解工序制备D-对羟基苯甘氨酸和副产磷酸铵,复盐离心母液加入水杨醛进行回流消旋,消旋机理[19]是L-对羟基本甘氨酸能和水杨醛形成席夫碱,席夫碱是一个光学和化学不稳定的中间体,由于苄叉基的吸电子作用,使α-碳上的H容易离去而生成只有平面结构的碳负离子,因此能够发生消旋化,如图1。
1 实验部分
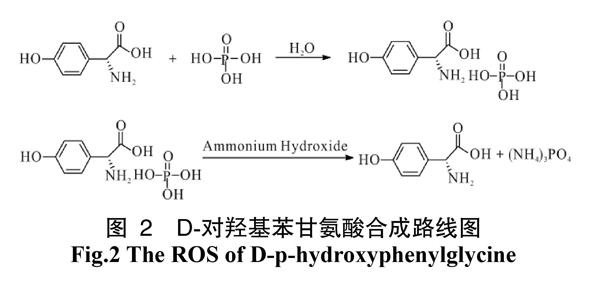
1.1 反应方程式
D-对羟基苯甘氨酸合成路线如图2。
1.2 原辅料及生产装置
原辅料:DL-对羟基苯甘氨酸(水分9.5%,质量分数99.2%,大丰云涛生物技术有限公司产);D-对羟基苯甘氨酸(比旋光度-158.8°,大丰云涛生物技术有限公司产);质量分数为75%的磷酸(川磷化工有限公司产);水杨醛(南京大唐化工有限责任公司产);质量分数为20%的氨水(绍兴市浙东化工厂产)。
生产装置:晶种釜、拆分釜、消旋釜、水解釜各一只(均为10 000 L搪玻璃,其中晶种釜配有真空系统,浙江云涛生物技术股份有限公司自有);下卸料全自动离心机两只(PAUT 1600,浙江云涛生物技术股份有限公司自有);闪蒸干燥机一组(SXG,浙江云涛生物技术股份有限公司自有);MVR蒸发结晶器一组(OSLO,浙江云涛生物技术股份有限公司自有)。
1.3 工艺流程图
D-对羟基苯甘氨酸工艺流程如图3。
1.4 D-对羟基苯甘氨酸磷酸复盐晶种的制备(晶种制备工序)
往10 000 L晶种釜中加入2 500 kg自来水、 2 500 kg D-对羟基苯甘氨酸,开启搅拌并往反应釜夹套通入蒸汽开始升温。待反应体系搅拌均匀后,往反应釜加入2 000 kg 质量分数为75%的磷酸,随即升温至反应体系溶清,溶清温度约为75 ℃,溶清后缓慢带真空负压蒸出约1 000 kg水。关闭蒸汽阀门,往反应釜夹套通入循环水降温,待温度降至约40 ℃时放料至离心机离心,得到1 500 kg滤饼,即为D-对羟基苯甘氨酸磷酸复盐晶种,离心母液循环套用,滤饼质量指标如下:
外观:白色结晶颗粒;干燥失重:5.2 %;比旋光度:-99.5°(精确称取0.4 g 溶于50 mL 1 mol·L-1盐酸溶液,20 ℃)。
1.5 DL-对羟基苯甘氨酸的拆分及复盐离心母液消旋(拆分消旋工序)
往10 000 L拆分釜中加入3 000 kg自来水、2 500 kg DL-对羟基苯甘氨酸(折干),开启搅拌并往反应釜夹套通入蒸汽开始升温。待反应体系搅拌均匀后,往反应釜加入2 150 kg 质量分数为75%的磷酸,随即升温至反应体系溶清,溶清温度约为60 ℃,往反应釜加入50 kg D-对羟基苯甘氨酸磷酸复盐晶种,开始往反应釜夹套缓慢通入冷冻盐水降温至10 ℃以下,放料至离心机离心,滤饼用少量冰水漂洗,得到900 kg D-对羟基苯甘氨酸磷酸复盐,復盐离心母液去消旋工序,滤饼质量指标如下。
外观:白色结晶粉末;干燥失重:3.9%;比旋光度:-99.7°(精确称取0.4 g 溶于50 mL 1 mol·L-1盐酸溶液,20 ℃)。
将复盐离心母液泵入消旋釜,加入180 kg水杨醛,升温至回流,回流温度约为104 ℃,保温回流5 h。保温回流毕,转回流为蒸馏,将水杨醛和水共沸蒸出,期间不断补加水套蒸至馏分无水杨醛为止,回收的水杨醛分去水层可循环套用,蒸除水杨醛的复盐离心母液去拆分工序套用。
1.6 D-对羟基苯甘氨酸的制备(水解工序)
往10 000 L水解釜中加入2 600 kg自来水、2 500 kg D-对羟基苯甘氨酸磷酸复盐(折干),开启搅拌,往反应釜夹套通入蒸汽升温至50 ℃,用2 400 kg 质量分数为20%的氨水中和至pH=6.0,中和过程反应体系温度控制在50~60 ℃,中和毕,往反应釜夹套通冷冻盐水降温至25 ℃以下,放料至离心机离心,滤饼用适量自来水漂洗,得到1 730 kg D-对羟基苯甘氨酸湿品,去闪蒸烘干工序(得成品1 495 kg),离心母液去MVR蒸发结晶器制备副产磷酸铵,产品质量指标如下:
外观:白色结晶性粉末;含量:99.6%;比旋光度:-158.9°(精确称取5.0 g 溶于100 mL 1 mol·L-1盐酸溶液,20 ℃);酸吸光值:0.009;碱吸光值:0.010。
2 结果与讨论
2.1 拆分工序质量分数为75%磷酸加入量对拆分效果的影响
质量分数为75%磷酸的用量是影响拆分效果的重要因素,特别对D-对羟基苯甘氨酸磷酸复盐的比旋光度影响较大。磷酸用量过少,未溶解的DL-对羟基苯甘氨酸会随复盐一同被离心分离出来;磷酸用量过多,反应体系黏度较大,影响离心速度,且无明显正面作用。本文考察了不同质量分数为75%磷酸用量对拆分效果的影响,结果如表1。
由表1可见,n(75%磷酸)∶n(DL-对羟基苯甘氨酸)=1.1时最适宜。
2.2 消旋工序水杨醛加入量对消旋效果的影响
消旋催化剂水杨醛加入量对于消旋的速度和效果影响较大。本文考察了不同水杨醛用量对消旋效果的影响,结果如表2。
由表2可见,水杨醛过少时,延长消旋时间也不能降低反应液比旋光度;当水杨醛用量足够时,延长消旋时间也不减少消旋时间,当n(水杨醛)∶n(L-对羟基苯甘氨酸)=0.20且消旋时间为5 h时效果最佳。
2.3 水解工序pH值对收率的影响
水解工序中,反应液pH值对D-对羟基苯甘氨酸的收率和质量都有影响,pH过低,水解不彻底,复盐仍溶解在反应体系中,导致产品收率低;pH过高,反应体系中微量的铁离子随产品析出,使得产品外观偏红,从而导致产品碱吸光值不合格。本文研究了水解工序中反应液不同pH值下,D-对羟基苯甘氨酸的收率和质量情况,结果如表3。
由表3可见,随着反应液pH的增高,D-对羟基苯甘氨酸的收率增高,当反应液pH增高到6.0时,继续增高不再有正面作用,故反应液pH控制在6.0最适宜。
3 结论
正本文所述的D-对羟基苯甘氨酸生产新工艺,采用价廉易得的质量分数为75%的磷酸为拆分剂,工序简单,安全可控,环境友好,产品质量好,特别是酸吸光值(0.009)和碱吸光值(0.010)较低,符合工业化生产要求。虽然拆分收率仅约41.2%,但工序周期短,且未造成原料損失,未分离出的D-对羟基苯甘氨酸磷酸复盐仍在母液中循环套用,次批拆分只需补加DL-对羟基苯甘氨酸和质量分数为75%的磷酸至工艺量即可。算上副产磷酸铵的销售收入,该工艺单位成本仅为4万元左右,按照一个企业正常5 000 t·a-1的产能计算,每年可产生利润17 500万元。
参考文献:
[1]FANA C H, LEE C K, CHAO Y P. Recombinant Escherichia coli cell for D-p-hydroxyphenylglycine production from D-N-carbamoyl-p- hydroxyphenylglycine[J]. Enzyme and Microbial Technology, 2000(26): 222-228.
[2] 苏文莉,刘长春. 乙醛酸的生产及其下游产品的开发应用[J]. 当代化工,2003,32(1):33-35.
[3] WHO Model List of Essential Medicines[R]. 20th List, March,2017.
[4] 杨帆, 张征林, 邹建忠. D-对羟基苯甘氨酸的不对称转化拆分[J]. 中国医药工志, 2005, 36(4): 199-120.
[5] BHATTACHARYA A, ARAULLO-MCADAMS C, MEIER M B. Crystallization induced asymmetric transformation: synthesis of D-p-Hydroxyphenylglycine[J]. Synthetic Communication, 1994, 24(17): 2449-2459.
[6]YOSHIOKA R,TOHOAMA M,YAMADA S. A Facile method for the production of D-p-hydroxyphenylglycine. asymmetric transformation of DL-p- Hydroxyphenylglycine using (+)-1-Phenylethenesulfonic acid[J]. Bull Chem Soc Jpn,1987, 60(12): 4321-4323.
[7]ICHIRO C, SHIGEKI Y. p-Hydroxyphenylglycine. alphaphenylethane- sulfonate, process for production thereof and utilization thereof in resolution of p-hydroxyphenylglycine: US, 4415504 [P].1983-11-15.
[8]ICHIRO C, SHIGEKI Y.Process for preparing an optically active p-hydroxyphenylglycine or a salt thereof : US, 4434107 [P]. 1984-02-28.
[9]HONGO C , TOHYAMA M , YOSHIOKA R , et al. Asymmetric transformation of DL-p-hydroxyphenylglycine by a combination of preferential crystallization and simultaneous racemization of the o-toluenesulfonate[J]. Bulletin of the Chemical Society of Japan, 2006, 58(2): 433-436.
[10]朱一恒,于广慧,薛守礼,等. D-(-)-对羟基苯甘氨酸的试制[J]. 沈阳药科大学学报, 1982, 26 (15): 95-100.
[11]李庆文, 蒋俊树. 化学拆分法制备左旋对羟基苯甘氨酸[J]. 安徽化工, 2000, 106(4): 11.
[12]张大帅, 穆帅, 牛端, 等. D-对羟基苯甘氨酸的制备[J]. 精细化工中间体,2013, 43(2): 33-36.
[13]ICHIRO C, SHIGEKI Y. Process for the optical resolution of DL-p-hydroxy-phenylglycine: US, 4309362 [P]. 1982- 01-05.
[14]TADASHI S, YASUHISA T. Method of manufacturing optically active p-hydroxyphenylglycine: US, 3994962[P]. 1976-11- 30.
[15]YAMADA S, HONGO C, CHIBATA I. Preparation of D-p-hydroxy- phenylglycine: optical resolution of DL-p-hydroxyphenyl-glycine by preferential crystallization procedure[J]. Agricultural and Biological Chemistry, 1978, 42(8): 1521-1526.
[16]齊延红,丁玉华, 连惠勇,等. D-对羟基苯甘氨酸的酶法生产工艺研究[J]. 中国医药工业杂志, 2001, 32(3):105-107.
[17]张铭俊,张衍坤,李京华,等. 固定化细胞膜生物反应器生产D-对羟基苯甘氨酸[C].第七届全国生物化工学术会议,1996-07-01.
[18]南晶.利用基因工程菌HC01固定化细胞制备D-对羟基苯甘氨酸[D]. 太原:山西大学, 2010.
[19]BHATTACHARYA A, ARAULLO-MCADAMS C, MEIER M B. Crystal-lization induced asymmetric transformation : synthesis of D-p-hydroxyphenylglycine[J]. Synthetic Communications, 1994, 24(17): 2449-2459.
