氮添加对盐胁迫条件下芦苇和盐地碱蓬种子萌发竞争的影响
2020-08-24李梅张琳路峰吴梦迪于君宝张晓龙管博
李梅, 张琳, 路峰, 吴梦迪, 于君宝, 张晓龙, 管博
氮添加对盐胁迫条件下芦苇和盐地碱蓬种子萌发竞争的影响
李梅1, 2, 张琳1, 2, 路峰3, 吴梦迪1, 2, 于君宝4, 张晓龙1,*, 管博2,*
1. 烟台大学, 环境材料与工程学院, 烟台 264005 2. 中国科学院海岸带环境过程与生态修复重点实验室(烟台海岸带研究所), 山东省海岸带环境过程重点实验室, 中国科学院烟台海岸带研究所, 烟台 264003 3. 山东黄河三角洲国家级自然保护区管理委员会, 东营 257091 4. 鲁东大学, 滨海生态高等研究院, 烟台 264025
为了探讨黄河三角洲盐地碱蓬和芦苇种子萌发阶段在不同盐胁迫条件的竞争关系, 以及氮添加对其竞争的影响, 本实验采用培养皿纸上发芽床法, 分析了不同浓度氮、盐及混合培养等条件下两种种子发芽率、发芽速度的响应。结果表明, 盐胁迫对盐地碱蓬和芦苇种子发芽率均有显著性影响, 盐浓度低于300 mmol·L-1时盐地碱蓬发芽率并未有显著降低, 而芦苇种子发芽率随着盐浓度增加而呈现显著降低趋势; 低盐条件下, 氮添加未对两物种发芽率产生显著影响, 但高盐胁迫条件下适度的氮添加显著增加了种子发芽率。混合培养显著增加了低盐环境中芦苇的发芽率, 当盐胁迫浓度升高时, 培养模式对两物种发芽率影响程度降低。对于发芽速度而言, 低盐处理下单独培养盐地碱蓬的发芽速度显著高于混合培养, 氮添加对盐地碱蓬发芽速度未产生显著影响; 而低盐条件(0、100 mmol·L-1)下芦苇的发芽速度则是在混合培养高于单独培养方式, 当盐浓度升高(400 mmol·L-1)时, 混合培养抑制了芦苇的发芽速度, 此时, 高氮(40 mmol·L-1)添加处理则能够显著缓解混合培养对芦苇发芽的抑制作用。研究结果可以为黄河三角洲滨海典型物种生态适应机制研究提供一定的理论依据。
盐地碱蓬; 芦苇; NaCl; 发芽; 发芽速度
0 前言
黄河三角洲湿地, 是世界上暖温带保存最广阔、最完善、最年轻的湿地生态系统, 是世界上淤积面积增长最快的河口湿地生态系统。黄河三角洲位于山东省北部的渤海之滨, 该地区属于暖温带季风气候区, 年平均气温12.1 ℃, 年均降雨量551.6 mm, 蒸发量达到1962 mm, 干旱指数高达 3.56[1]。由于其特殊的地理位置和较短的成陆时间, 其湿地生态系统具有明显的脆弱性, 加之土壤成土历程短, 熟化程度低, 土壤养分少, 地表水分蒸发快, 极易造成盐碱化。随着暖干化程度的加剧, 盐碱化湿地已经成为黄河三角洲湿地退化面积最大、最具代表性、同时亦是最难恢复的湿地类型, 并且正在不断加剧恶化。
盐地碱蓬()作为一种典型的盐碱地指示植物, 是黄河三角洲滨海湿地的优势种之一, 对盐碱化环境具有较好的适应性。盐地碱蓬是嗜盐而不耐水淹的盐生植物, 在盐分较高而水深较低的群落中生态位宽度达到最大, 对资源利用或占用的能力最高, 其高盐生境适应能力也最强[2]。芦苇()是滨海湿地环境中生长的主要植物之一, 也是黄河三角洲分布面积最广的典型湿地物种, 其对于水分和盐分均具有较广的耐受阈值[3]。在黄河三角洲滨海湿地芦苇和盐地碱蓬存在一定的生态位重叠区, 都具有较宽且接近的生态位宽度。已有研究表明, 盐分胁迫的增加更加适合盐地碱蓬的生长, 而芦苇生长会受到严重抑制[3–5], 但在两者的生态位重叠区, 盐分对两个物种的竞争影响趋势如何目前还不明确。
氮素是植物生长所必须的营养元素, 所有生物体都需要氮来维持生活, 也是盐碱地区限制植物生长的主要因素之一[6–8]。供氮不足会引起植株外部形态和内部代谢的变化, 根据这些变化可以判断植物的氮素营养状况。近几年, 关于氮素添加对植物的影响多集中于个体生长的响应[9–10]或作物产量[11]等方面, 针对盐地碱蓬和芦苇对不同氮添加在盐胁迫条件下种子萌发阶段竞争的影响未见报道。
本文以盐地碱蓬和芦苇为研究对象, 针对其在不同氮添加浓度、不同盐胁迫浓度、以及物种单独或混合培养条件下的萌发情况做了研究, 其相关研究对于我们更好的理解其物种生态适应机制以及探讨生态修复技术将具有一定的意义。
1 材料与方法
1.1 实验处理
实验选取不同浓度NaCl溶液模拟野外原生盐渍环境, 浓度梯度为0、100、200、300、400 mmol·L-1, 氮添加处理为: 0、20、40 mmol·L-1NH4NO3溶液)。实验物种处理为: 单独芦苇、单独盐地碱蓬以及芦苇、盐地碱蓬混合实验。实验共分成: 3个物种处理×5个盐分处理×3个氮添加×5个重复=225个培养皿。
采用培养皿种子萌发实验技术, 选取饱满的种子50粒放置于铺有两层滤纸的培养皿(直径10 cm)中, 混合培养实验是在同一培养皿中放置芦苇、盐地碱蓬种子各25粒。之后加入10 ml相应浓度的处理溶液, 用封口膜密封, 以防止水分蒸发。每处理重复5次。以种子胚根突破种皮1 mm视为发芽, 每天同一时间观察种子发芽情况并记录发芽数。实验在培养箱(BSG—800, 上海)中进行, 光照均采用12 h光照(200 μmol·m–2·s–1, 400—700 nm), 12 h黑暗。温度设置为: 黑暗/光照: 15/25 ℃。实验待连续3 d没有新萌发幼苗截止(约15 d)。
测定指标:
种子发芽率()=实际发芽数/种子总数×100%
发芽速度()=∑/×100%[12](式中为每天的发芽率,为发芽总时间)
1.2 统计分析
所有发芽数据均经过标准化处理并进行统计分析, 用 SPSS 11.5 进行数据处理。实验数据均采用单因素方差分析, 差异显著性均在<0.05水平下进行。
2 结果与分析
2.1 单独培养下, 氮添加与盐胁迫对种子萌发率的影响
由图1、图2可看出, 两种植物种子的发芽率均随NaCl盐溶液浓度的升高呈下降趋势。对于盐地碱蓬而言, 低于300 mmol·L-1NaCl浓度并未对盐地碱蓬的发芽率产生显著影响, 且发芽率均超过60%(图2); 当NaCl浓度达到400 mmol·L-1时, 盐地碱蓬的发芽率显著降低(<0.05), 低盐条件下, 氮添加并未对盐地碱蓬发芽率产生显著影响, 但400 mmol·L-1浓度条件下, 20 mmol·L-1的硝酸铵处理显著增加了盐地碱蓬种子发芽率(<0.05); 对于芦苇而言, 低于200 mmol·L-1的盐处理并未对种子发芽率产生显著影响, 而当芦苇处于较高盐胁迫条件时(>=300 mmol·L-1), 与对照相比, 无氮添加处理下, 芦苇种子发芽率显著下降, 而20 mmol·L-1硝酸铵处理却抑制了芦苇种子发芽率的降低(<0.05)。
2.2 混合培养下, 氮添加与盐胁迫对种子萌发率的影响
不同氮添加及盐胁迫条件下, 混合培养对盐地碱蓬和芦苇种子发芽率影响不同(图1、2)。对盐地碱蓬而言, 与单独培养条件相比, 混合培养显著促进了盐地碱蓬在高盐(400 mmol·L-1NaCl)的发芽率(<0.05); 当盐浓度为300 mmol·L-1时, 虽然混合培养下盐地碱蓬的发芽率显著低于单独培养(<0.05), 但其最终发芽率均高于80%。当盐浓度低于300 mmol·L-1时, 与单独培养相比, 混合培养一定程度的降低了盐地碱蓬的发芽率, 但差异均不显著(图1)。对芦苇而言, 氮添加为0 mmol·L-1时, 低盐条件下混合培养促进了芦苇的发芽率, 其中盐浓度为0和300 mmol·L-1下差异显著(<0.05); 氮添加为20 mmol·L-1, 除了盐浓度为0 mmol·L-1下单独培养芦苇发芽率较高, 其余浓度均未有显著差异; 与无氮添加趋势相似, 当氮添加为40 mmol·L-1时, 混合培养促进了芦苇的发芽率, 其中盐浓度为100 mmol·L-1时促进作用达到显著差异(<0.05)。
2.3 不同盐浓度条件下, 单独/混合培养及氮添加对种子发芽速度的影响
由图3、表1可看出, 氮添加并未对盐地碱蓬种子发芽速度产生显著影响, 然而低盐条件下(0、100 mmol·L-1NaCl浓度), 培养方式及氮添加交互作用对盐地碱蓬种子发芽速度产生了显著影响(< 0.05), 盐浓度为0 mmol·L-1NaCl时, 0和20 mmol·L-1氮添加浓度下单独培养盐地碱蓬的发芽速度显著高于混合培养方式; 当盐浓度为100 mmol·L-1NaCl时, 仅在无氮添加时单独培养促进了盐地碱蓬的发芽速度; 高盐胁迫条件下, 培养方式及氮添加未对盐地碱蓬发芽速度产生显著影响(图3)。

图1 氮添加0(A)、20(B)、40 mmol·L-1(C)时, 单独/混合培养条件下不同浓度盐胁迫下盐地碱蓬种子发芽率
Figure 1 The germination percentage ofseeds in single / mixed culture under different salt concentrations with 0 (A), 20 (B) and 40 mmol·L-1(C) nitrogen addition
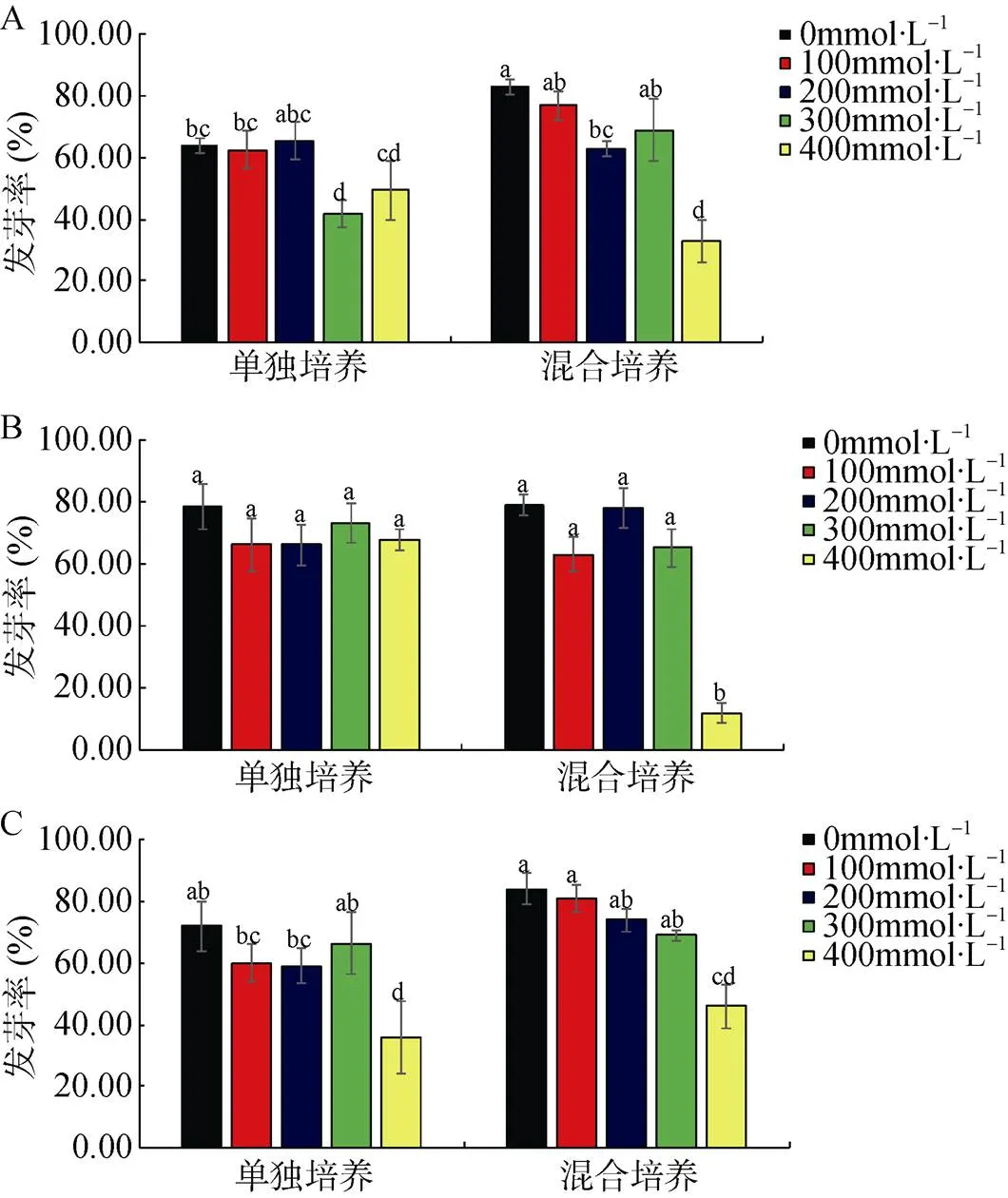
图2 氮添加0(A)、20(B)、40 mmol·L-1(C)时, 单独/混合培养条件下不同浓度盐胁迫下芦苇种子发芽率
Figure 2 The germination percentage ofseeds in single / mixed culture under different salt concentrations with 0 (A), 20 (B) and 40 mmol·L-1(C) nitrogen addition
与盐地碱蓬发芽速度的响应不同, 混合培养促进了低盐条件下芦苇发芽速度(图4, 表1)。其中当盐浓度为0和100 mmol·L-1时, 0和40 mmol·L-1氮添加浓度下混合培养均显著增加了芦苇的发芽速度(<0.05); 但当盐浓度升高到400 mmol·L-1时, 混合培养抑制了芦苇的发芽速度, 与单独培养相比, 0和20 mmol·L-1氮添加浓度下混合培养显著降低了芦苇的发芽速度(<0.05), 40 mmol·L-1氮添加浓度下两者差异不显著。
3 讨论
在黄河三角洲滨海湿地, 盐地碱蓬和芦苇群落分布面积较广, 从潮间带到内陆盐渍化区域均有分布, 且有大面积混合群落分布, 群落的演替方向取决于物种生境适宜性变化趋势[13–14]。本研究结果表明, 在400 mmol·L-1NaCl浓度下两种种子均有不同程度的萌发, 盐地碱蓬表现出较高的耐盐性, 发芽率显著高于芦苇。盐地碱蓬耐盐性高于芦苇已被众多研究结果证实, 另外, 本研究中在清水下, 芦苇种子萌发率也没有超过80%, 而盐地碱蓬种子萌发率均高于95%。因此, 芦苇种子萌发率偏低也可能与种子质量有关。在黄河三角洲盐渍环境下, 盐地碱蓬作为一种吸盐型盐生植物, 能够通过吸收大量盐离子到体内来调节离子平衡[4], 而芦苇则采取拒盐的适应机制来耐受盐渍生境[5], 不同的适应机制均是其适应盐碱环境的生存策略。
氮素通常是盐碱地区限制植物生长的主要因素[6–8], 在黄河三角洲区域, 氮素含量也被证实显著低于其他典型河口湿地(如长江三角洲)[15], 而氮素的补充会显著影响植物的耐盐和抗盐能力[16]。本研究中, 不同浓度的氮添加对盐地碱蓬的发芽率和发芽速度没有产生显著性影响, 但20 mmol·L-1的氮素添加增加了芦苇种子的发芽率和发芽速度, 在300 mmol·L-1NaCl浓度下达到显著水平, 而氮素浓度过高(如40 mmol·L-1)反而抑制了芦苇种子的萌发。在不利于盐生植物生长的重盐渍化地区, 可以通过适量氮添加来缓解盐胁迫, 促进植物定居和生长[17]。
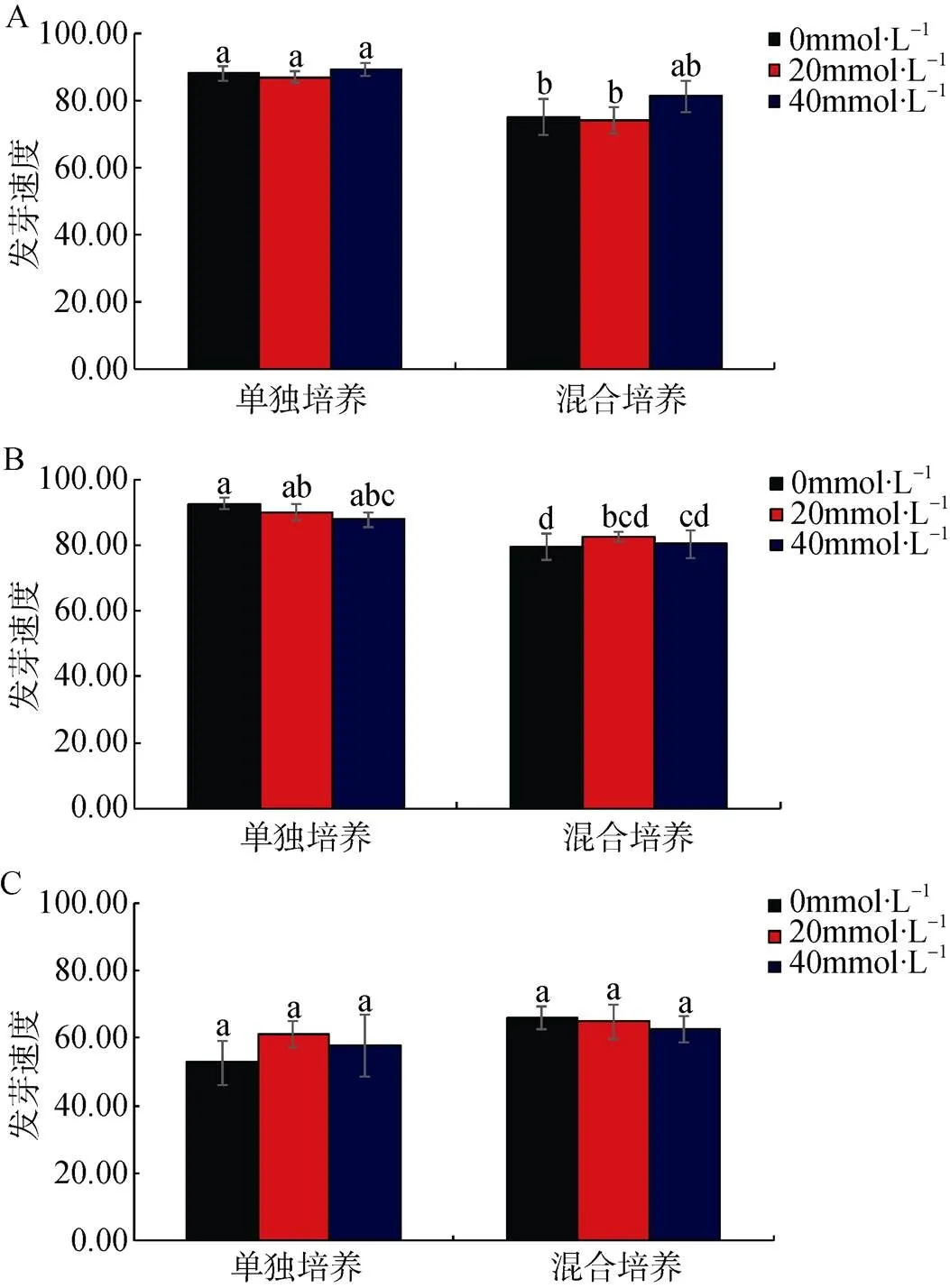
图3 盐浓度0(A)、100(B)、400 mmol·L-1(C)时, 单独/混合培养条件下不同浓度氮添加对盐地碱蓬种子发芽速度的影响
Figure 3 Effect of different concentrations of nitrogen on the germination rate ofseeds in single / mixed culture at 0 (A), 100 (B) and 400 mmol·L-1(C) salt concentration
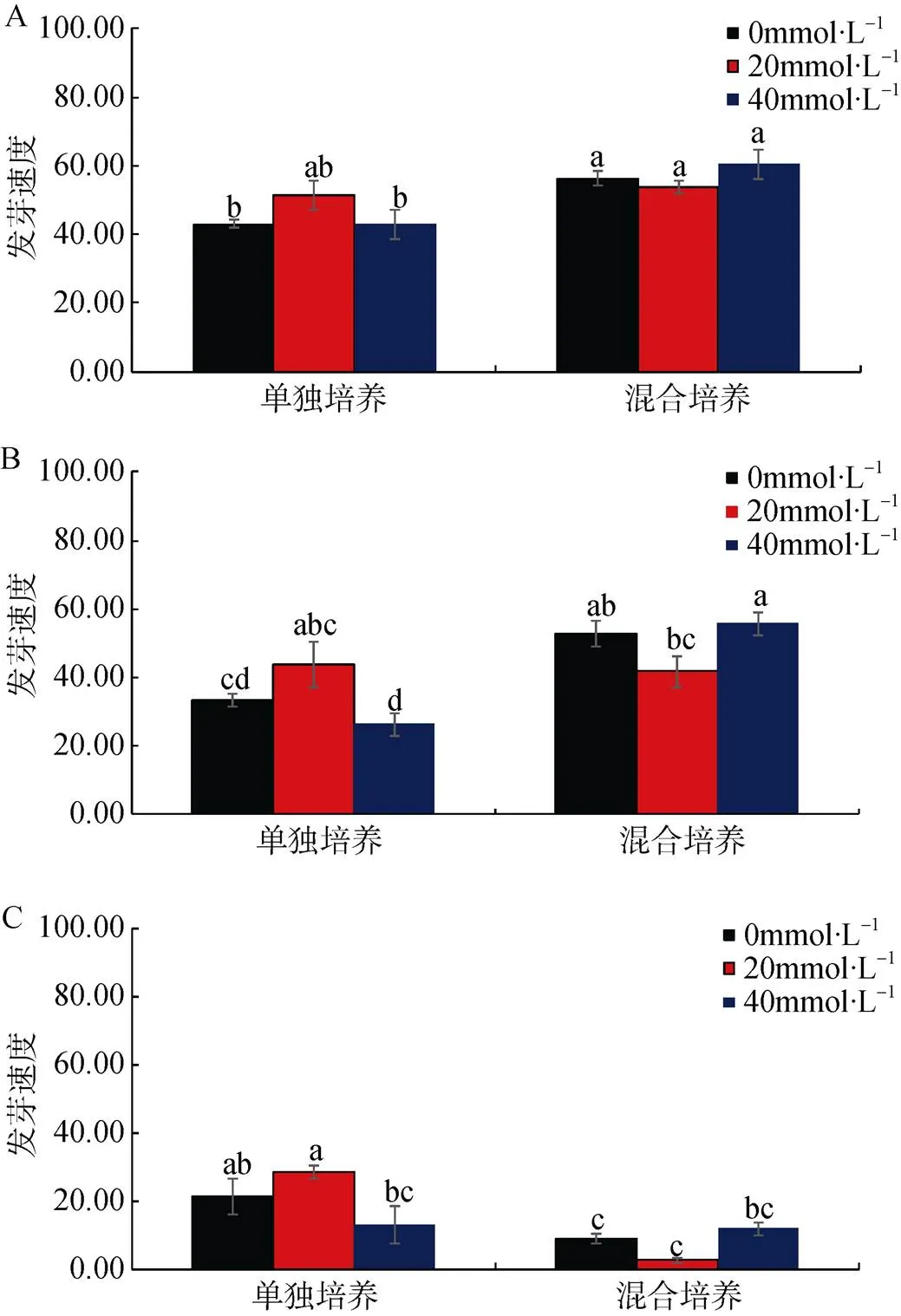
图4 盐浓度0(A)、100(B)、400 mmol·L-1(C)时, 单独/混合培养条件下不同浓度氮添加对芦苇种子发芽速度的影响
Figure 4 Effect of different concentrations of nitrogen on the germination rate ofseeds in single / mixed culture at 0 (A), 100 (B) and 400 mmol·L-1(C) salt concentration
盐生植物的生长不仅受盐分和养分的影响[18], 同时, 植物间的相互作用也会促进或抑制植物生存和定居[19–20]。在美国滨海湿地区域, 芦苇被认为是入侵植物, 能够通过有性繁殖和无性繁殖两种方式定居并扩散, 另外, 其本身具有较广的水盐耐受阈值, 这也是其成为世界广布种的重要原因[21–22]。本研究中, 单独和混合培养模式对盐地碱蓬和芦苇种子萌发产生了不同的影响, 在低盐环境中(0、100 mmol·L-1NaCl溶液), 混合培养显著抑制了盐地碱蓬种子发芽率及发芽速度, 但促进了芦苇种子的发芽率和发芽速度(表2, 图3、4)。然而, 氮添加处理打破了这种竞争模式, 当氮添加浓度为20 mmol·L-1时, 培养方式对盐地碱蓬和芦苇种子萌发产生的差异趋于减小。也就是说, 当盐渍环境均适于两者生存时, 适当的氮添加能够促进盐地碱蓬和芦苇的共生。在高盐条件下, 低氮添加(0—20 mmol·L-1)对混合培养下芦苇的发芽速度存在显著抑制作用(<0.05), 而高氮添加(40 mmol·L-1)减小了混合培养对芦苇发芽速度的抑制作用。本实验结果不仅为盐地碱蓬和芦苇种子萌发阶段的竞争/共生特征提供了一定的理论依据, 对利用盐生植物进行退化盐碱湿地的修复也具有一定的指导作用。

表1 不同胁迫因子对盐地碱蓬、芦苇种子发芽率和发芽速度影响的一般线性模型分析
[1] 宋德彬, 于君宝, 王光美, 等. 1961~2010年黄河三角洲湿地区年平均气温和年降水量变化特征[J]. 湿地科学, 2016, 14(02): 248–253.
[2] CUI B, HE Q, ZHAO X. Ecological thresholds ofto the environmental gradients of water table depth and soil salinity[J]. Acta Ecologica Sinica, 2008, 28(4): 1408–1418.
[3] WANG X, YU J, ZHOU D, et al. Vegetative Ecological Characteristics of Restored Reed () Wetlands in the Yellow River Delta, China[J]. Environmental Management, 2012, 49(2): 325–333.
[4] GUAN B, YU J, WANG X, et al. Physiological responses of halophyteto water table and salt stresses in coastal wetland of Yellow River Delta[J].CLEAN - Soil, Air, Water, 2011, 39(12): 1029–1035.
[5] GUAN B, YU J, HOU A, et al. The ecological adaptability ofto interactive effects of water level and salt stress in the Yellow River Delta[J]. Aquatic Ecology, 2017, 51(1): 107–116.
[6] 龙楠. 不同施氮水平对盐碱地植物种子萌发及幼苗生长的影响[D]. 呼和浩特: 内蒙古农业大学, 2011.
[7] ROZEMA J, DUECK T, WESSELMAN H, et al. Nitrogen dependent growth stimulation by salt in strand-line species[J]. Acta Oecologica Plantarum, 1983, 4(1): 41–52.
[8] 段德玉, 刘小京, 李存桢, 等. N素营养对NaCl胁迫下盐地碱蓬幼苗生长及渗透调节物质变化的影响[J]. 草业学报, 2005(01): 63–68.
[9] 潘艳文, 古勇波, 唐占辉, 等. 盐度和氮添加对盐碱湿地芦苇幼苗生长及生物量分配的影响[J]. 土壤与作物, 2018, 7(02): 257–265.
[10] 起德花, 刘晓玲, 王光美, 等. 施加不同量外源氮和互为伴生种下碱蓬和盐地碱蓬生物量变化的野外模拟实验[J]. 湿地科学, 2019, 17(01): 119–122.
[11] 毛祥敏, 钟雯雯, 王兴亚, 等. 种植方式与施氮量对小麦光合特性及产量的影响[J]. 江苏农业科学, 2018, 46(03): 56–60.
[12] KHAN, M. A., UNGAR, et al. The effect of salinity and temperature on the germination of polymorphic seeds and growth ofwilld. American Journal of Botany, 1984, 71, 481–489.
[13] 宗敏. 黄河三角洲滨海湿地优势植被群落潜在分布模拟及空间优化配置[D]. 烟台: 鲁东大学, 2017.
[14] 张高生. 基于RS、GIS技术的现代黄河三角洲植物群落演替数量分析及近30年植被动态研究[D]. 济南: 山东大学, 2008.
[15] YU J, ZHAN C, LI Y, et al. Distribution of carbon, nitrogen and phosphorus in coastal wetland soil related land use in the Modern Yellow River Delta[J]. Scientific reports, 2016, 6: 37940.
[16] 原俊凤. 氮素营养对盐生植物的根系生长和耐盐性的影响[C]∥李保国.中国土壤学会第十一届全国会员代表大会暨第七届海峡两岸土壤肥料学术交流研讨会论文集(中). 北京: 中国土壤学会, 2008: 229–236.
[17] 段德玉, 刘小京, 李存桢, 等. N素营养对NaCl胁迫下盐地碱蓬幼苗生长及渗透调节物质变化的影响[J]. 草业学报, 2005(01): 63–68.
[18] 王茜, 校亮, 唐翔宇, 等. 盐碱胁迫和氮素供给对盐地碱蓬种子发芽与幼苗生长的影响[J]. 草业学报, 2015, 24(09): 216–222.
[19] 孔祥龙. 黄河三角洲植物群落种间相互作用研究[D]. 济南: 山东大学, 2016.
[20] 张炜平, 潘莎, 贾昕, 等. 植物间正相互作用对种群动态和群落结构的影响:基于个体模型的研究进展[J]. 植物生态学报, 2013, 37(06): 571–582.
[21] MORRIS, K., BOON, et al. Floristic shifts in wetlands: the effects of environmental variables on the interaction between(Common Reed) and(Swamp Paperbark). Marine and Freshwater Research, 2008, 59: 187–204.
[22] UDDIN, M., CARIDI, et al. Phytotoxic evaluation of: an investigation of aqueous extracts of different organs. Marine and Freshwater Research, 2012, 63: 777–787.
Effect of nitrogen addition on seed germination competition ofandunder salt stress
LI Mei1, 2, ZHANG Lin1, 2, LU Feng3, WU Mengdi1, 2, YU Junbao4, ZHANG Xiaolong1, *, GUAN Bo2, *
1. Environment and Material Engineering College, Yantai University, Yantai 264005, China 2. CAS Key Laboratory of Coastal Environmental Processes and Ecological Remediation, Yantai Institute of Coastal Zone Research (YIC), Chinese Academy of Sciences(CAS); Shandong Key Laboratory of Coastal Environmental Processes, YICCAS, Yantai Shandong 264003, China 3. Management Committee of Shandong Yellow River Delta National Nature Reserve, Dongying 257091, Shandong, China 4. The Institute for Advanced Study of Coastal Ecology, Ludong University, Yantai Shandong 264025, China
To investigate the competitive relationship betweenandin the Yellow River Delta under different salt stress conditions during the period of the seed germination, the seed germination percentage and germination rate under different concentrations of nitrogen and salt, were measured for the two species germinated alone and mixed. The influence of nitrogen addition on their competitive relationship was also detected. The results showed that salt stress had significant effects on the germination percentage ofand. When the salt concentration was lower than 300 mmol·L-1, the germination rate ofchanged insignificantly, but the germination rate ofdecreased significantly with the increasing salt concentration. Under the low level of salt concentration, nitrogen addition did not significantly affect the germination percentage of the two species. However, the moderate nitrogen addition (20 mmol·L-1) significantly increased the germination rate under high salt stress. When the seeds of two species mixed, the germination rate ofincreased significantly at a low salt level, but the differences of the germination rate between species alone and mixed treatments became less when the concentration of salt increased. Under low salt treatment, the germination rate ofgerminated alone was significantly higher than that of seeds in mixed treatment, and nitrogen addition had no significant effect on the germination rate of. Under the low salt condition (0, 100 mmol·L-1), the germination rate ofin mixed treatment was higher than that in alone treatment. When the salt concentration increased (400 mmol·L-1), the germination rate ofwas inhibited in mixed treatment. And high nitrogen (40 mmol·L-1) could significantly alleviate the inhibitory effect of mixed treatment ongermination. Our results could provide a theoretical basis for the study on the ecological adaptation mechanism of typical coastal species in the Yellow River Delta.
;; NaCl; germination; germination rate
10.14108/j.cnki.1008-8873.2020.04.015
李梅, 张琳, 路峰, 等. 氮添加对盐胁迫条件下芦苇和盐地碱蓬种子萌发竞争的影响[J]. 生态科学, 2020, 39(4): 113–118.
LI Mei, ZHANG Lin, LU Feng, et al. Effect of nitrogen addition on seed germination competition ofandunder salt stress[J]. Ecological Science, 2020, 39(4): 113–118.
Q948.1
A
1008-8873(2020)04-113-06
2019-12-16;
2020-01-15
国家自然科学基金项目(41871091); 国家自然科学基金山东联合基金重点支持项目(U1806218)
李梅(1998—), 女, 河南人, 本科, 主要研究方向: 滨海湿地生态, E-mail: zdzsdr@163.com
张晓龙, 男, 博士, 副教授, 主要从事滨海湿地环境演化及资源利用方面研究, E-mail: Vxl173@sohu.com
管博, 男, 博士, 副研究员, 主要从事滨海湿地植被生态学与生态修复研究, E-mail: bguan@yic.ac.cn
