臭氧降解农残后对花蛤营养价值的影响
2020-08-24田亚亚刘敏轩亢春雨王向红
田亚亚,刘敏轩,亢春雨,王向红
(河北农业大学食品科技学院,河北保定071000)
已有很多学者证明采用臭氧去降解食品中的农药残留是可行的,如De Souza等[1]证明了用气态臭氧或臭氧水,都可有效去除胡萝卜中的苯醚甲环唑和利谷隆。在其他农产品中也已经证明了臭氧在农药去除中的应用,如莴苣、葡萄、苹果、柠檬、橙子、葡萄柚、玉米、小麦和荔枝[2-6]。而近些年来贝类的净化及去除兽药残留也涉及到采用臭氧去处理,效果良好,得到各界的认可[7]。同时臭氧处理还可以降低贝类中的大肠杆菌群和细菌总数的数量[8]。臭氧技术正被广泛应用于食品行业,而且2001年食品药品监督管理局(Food and Drug Administration,FDA)将臭氧列入可直接和食品接触的添加剂,为臭氧的应用带来了广阔的前景[9]。
臭氧是一种强的氧化剂[10],可以有效去除农残,同时O3是一种不稳定的分子,可快速衰变为双原子氧,因此不会在食物中留下任何残留物,故近年来被广泛应用于去除食品中农药残留。O3对有机化合物的氧化可以通过O3分子与有机化合物的反应或O3分解形成的自由基与有机化合物的反应来发生。那么在臭氧发挥作用降解农药残留的同时,它的强氧化性是否也会对被降解的食品自身的营养价值产生影响,是否会使食品的营养成分被破坏,甚至造成营养流失,或者使食品的口感不好,变差,失去其原有的独有性,本试验选择水产品中的花蛤来探究这一系列问题。
花蛤是我国近海四大养殖贝类之一,在我国南北沿海均有分布。其肉质鲜美,营养丰富,具有很高的食用价值和保健作用[11]。近几年来,在我国辽宁、山东、福建等沿海省市的滩涂海域捕捞和养殖产量增长迅速,目前山东省养殖面积达到5万多hm2,产量达100多万吨,辽宁丹东东港市每年出口日本100 t~200 t[12]。花蛤由于其肉质鲜美等特点,深受广大消费者欢迎,在夏季的大排档餐桌上随处可见花蛤的身影,而花蛤可被加工成多种产品。
很多学者已有研究证实臭氧确实可以有效去除食品中的农药残留,同时不会在食品中留下任何残留物,但是臭氧的强氧化性是否对被降解的食品自身的营养价值产生不利影响,却少有人研究。故本试验的目的是要探究采用臭氧处理是否会对食品的营养价值产生影响——以花蛤为例,从水分、灰分、粗蛋白、粗脂肪、总糖、氨基酸组成、脂肪酸组成、矿物质、维生素九大方面对比花蛤的营养价值在臭氧处理前后是否发生变化。
1 材料与方法
1.1 材料与试剂
新鲜花蛤:河北农大科技市场;石油醚、葡萄糖、蒽酮、硫酸、硫酸铜、硫酸钾、硼酸、氢氧化钠、甲基红、溴甲酚绿、盐酸、硫酸铵、硝酸、无水乙醇、抗坏血酸、氢氧化钾、2,6-二叔丁基-4-甲基苯酚、正己烷、丙酮、庚烷磺酸钠、甲酸(以上均为分析纯):国药集团化学试剂有限公司;甲醇(色谱级):迈瑞达公司;24种元素标准溶液:国家有色金属及电子材料分析测试中心;维生素A、维生素E、维生素B2、维生素PP标准品:万科有限公司;16种氨基酸标准品:上海安谱实验科技股份有限公司;35种脂肪酸混合标准品:美国Sigma公司。
1.2 仪器与设备
1.3 方法
1.3.1 花蛤样品的前处理
水分、灰分、粗脂肪、粗蛋白、总糖测定的样品前处理方法为:向300 mL的蒸馏水中通入不同时间(0、3、5、10、20、30、60 min)的臭氧,制备成不同浓度(0、0.6、1.2、1.8、3.0、4.2、5.4 mg/L)的臭氧水。取适量花蛤放入不同浓度梯度的臭氧水中浸泡10 min后,去壳取肉备用。
氨基酸、脂肪酸、矿物质、维生素测定的样品前处理方法为:向300 mL的蒸馏水中通入不同时间(0、30 min)的臭氧,制备成不同浓度(0、4.2 mg/L)的臭氧水。取适量花蛤放入不同浓度梯度的臭氧水中浸泡10 min后,去壳取肉备用。
1.3.2 水分、灰分、粗脂肪、粗蛋白、总糖的测定方法
水分的测定[13]:常压直接干燥法;灰分的测定[14]:550℃灼烧质量法;粗脂肪的测定[15]:索氏抽提法;粗蛋白的测定[16-17]:微量凯氏定氮法;总糖的测定[18]:蒽酮比色法。
1.3.3 氨基酸组成的测定方法
氨基酸组成的测定,参照黄瑞等[19]的氨基酸自动分析法。
称取混合均匀的适量样品,在水解管中加入10mL~15 mL 6 mol/L盐酸溶液,将水解管放入冷冻剂中,冷冻3 min~5 min,充氮保护,拧紧瓶盖,将水解管放在(110±1)℃的电热鼓风恒温箱中水解22 h后,取出,冷却至室温(20±5)℃。打开水解管,将水解液过滤至50 mL容量瓶中,用少量水多次冲洗水解管,水洗液移入同一50 mL容量瓶内,最后用水定容至刻度,摇匀。准确吸取1.0 mL滤液移入至15 mL试管内,40℃减压至干,用1.0 mL pH 2.2的柠檬酸钠缓冲溶液附溶,振荡混匀后,过0.22 μm滤膜后,上机测定。
仪器条件:色谱柱:磺酸型阳离子树脂;波长:570 nm 和 440 nm;进样量:500 μL,流速:3 mL/min;反应温度:(135±5)℃。
1.3.4 脂肪酸组成的测定方法
1)脂肪酸组成的测定:参照刘哲、庄柯瑾等[20-21]的气相色谱方法。
2)试样水解:称取均匀试样适量,加入约100 mg焦性没食子酸,加入几粒沸石,再加入2 mL 95%乙醇,混匀。加入盐酸溶液10 mL,混匀。将烧瓶放入70℃~80℃水浴中水解40 min。每隔10 min振荡一下烧瓶,使黏附在烧瓶壁上的颗粒物混入溶液中。水解完成后,取出烧瓶冷却至室温(20±5)℃。
3)脂肪的提取:水解后的试样,加入10 mL 95%乙醇,混匀。将烧瓶中的水解液转移到分液漏斗中,用50 mL乙醚石油醚混合液冲洗烧瓶和塞子,冲洗液并入分液漏斗中,加盖。振摇5 min,静置10 min。将醚层提取液收集到250 mL烧瓶中。按照以上步骤重复提取水解液3次,最后用乙醚石油醚混合液冲洗分液漏斗,并收集到已恒重的烧瓶中,将烧瓶置水浴上蒸干,置(100±5)℃烘箱中干燥2 h。脂肪的皂化和脂肪酸甲酯化:在脂肪提取物中,继续加入2 mL 2%氢氧化钠甲醇溶液,85℃水浴锅中水浴30 min,加入3 mL 14%三氟化硼甲醇溶液,于85℃水浴锅中水浴30min。水浴完成后,等温度降到室温(20±5)℃,在离心管中加入1 mL正己烷,震荡萃取2 min之后,静置1 h,等待分层。取上层清液100 μL,用正己烷定容到1 mL。用0.45 μm滤膜过膜后上机测试。
4)气相色谱条件:色谱柱:CD-2560(100 m×0.25 mm,0.20 μm);升温程序:130℃保持 5 min,以 4℃/min的速率升温至240℃,保持30 min。进样口温度:250℃;载气流速:0.5 mL/min;分流进样,分流:10 ∶1;检测器:火焰离子化检测仪(flame ionization detector,FID);检测器温度:250℃。
1.3.5 矿物质的测定方法
矿物质的测定,参照任红等[22]的电感耦合等离子体发射光谱法/电感耦合等离子体质谱法。
称取适量花蛤肉样品至聚四氟乙烯消解罐中,加入5 mL硝酸。静置,反应结束后,盖盖密封,放入微波消解仪。消解程序:(1)100℃保持 3 min,(2)1 040℃保持3 min,(3)160 ℃保持 3 min,(4)180 ℃保持 3 min,(5)190℃保持15 min。
待温度冷却至50℃以下后,取出消解罐放入通风橱中,打开消解罐,用超纯水润洗,转移至50 mL容量瓶中,至少润洗3次~4次,用超纯水稀释定容至刻度,待测。空白对照同法处理。
电感耦合等离子体发射光谱仪(测定的元素:钾、钙、钠、镁、磷、铁)参数:射频功率:1 150 W;辅助气流速:0.5 L/min;泵速:45 rpm;冷却器流速:12 L/min;采样深度:5 mm。
电感耦合等离子体质谱仪(测定的元素:锰、锌、铜、硒)参数:射频功率:1 550 W;泵速:40 r/min;雾化室温度:2.7℃;采样深度:5 mm;冷却气流速:14 L/min;辅助气流速:0.8 L/min;雾化气流速:1.122 L/min。
1.3.6 维生素的测定方法
1)维生素A、维生素E的测定:参考黄旭等[23]的高效液相色谱法。
2)标准储备液的配制:准确称取适量标准品维生素A、维生素E用无水乙醇溶解使其浓度为1.0 mg/mL。混合标准系列工作溶液的配制:分别准确吸取维生素A和维生素E标准储备液,配制成维生素A和维生素E的混合标准系列工作溶液,使其浓度为维生素A:0.5、2.0、3.0、4.0、5.0 mg/L;维生素 E:5.0、20.0、30.0、40.0、50.0 mg/L。
3)样品前处理:准确称取均质后的样品10 g(精确至0.01 g)于250 mL棕色碘量瓶中,依次加入20 mL、1 g抗坏血酸、50 mL无水乙醇、5 g氢氧化钾,充分摇匀,慢慢向瓶底部冲入氮气,将瓶口盖紧密封,放置于恒温水浴锅中,85℃水浴边振荡边进行皂化反应30 min。反应完全后,将溶液放置至室温(20±5)℃,用水将全部皂化液转移到100 mL容量瓶中,用水定容至刻度,摇匀。然后准确移取20.0 mL皂化液至固相萃取柱,洗脱液收集于100 mL棕色容量瓶中,重复5次。最后使用正己烷定容至刻度,摇匀备用。准确移取上述洗脱液10.0 mL,放入离心管中,于40℃下氮吹近干,使用乙醇复溶并定容至2.0 mL,将此溶液过0.45 μm后,上机测定。
4)色谱条件:色谱柱:SunFireTMC18柱(4.6 mm×150 mm,5 μm),流动相:纯甲醇,流速:1.0 mL/min,进样量:10 μL,柱温:38 ℃,检测波长为维生素 A:325 nm,维生素E:294 nm。
5)维生素B2、维生素PP的测定:参考黄荣荣等[24]的高效液相色谱法。
6)标准溶液的配制:准确称取0.100 0 g烟酸标准品,加水溶解后,转移至棕色容量瓶中,并定容至100mL,配制成浓度为1 mg/mL的贮备液。准确称取0.025 0 g维生素B2标准品,置于100 mL棕色容量瓶中,加入2 mL(1∶1,体积比)盐酸溶液,溶解后,用水定容至刻度。混合标准系列工作溶液的配制:分别准确吸取维生素 PP 标准溶液 5、10、50、100、250 uL,维生素 B2标准溶液 20、40、200、400、1 000 uL 于 10 mL 棕色容量瓶中,用无水乙醇定容至刻度,配制成维生素PP和维生素B2的混合标准系列工作溶液,浓度为维生素PP/B2:0.5、1.0、5.0、10、25 mg/L。
7)样品前处理:准确称取1.00 g试样,加入15 mL水,混匀后,超声10 min,移入25 mL棕色容量瓶中,加入2.5 mL丙酮,用水定容,摇匀。取出2 mL溶液,离心,上清液过0.45 μm膜后,待测定。
8)色谱条件:色谱柱:SunFireTMC18柱(4.6 mm×150 mm,5 μm);流动相:A:纯甲醇,B:0.1%庚烷磺酸钠(甲酸调节pH 2.5),梯度洗脱参数见表1;流速:1.0 mL/min;柱温:30 ℃;进样量:10 μL;波长:261 nm。梯度洗脱参数见表1。

表1 梯度洗脱参数Table 1 Gradient elution parameter
2 结果与分析
2.1 臭氧降解对花蛤中水分的影响
通入不同时间臭氧时对花蛤中水分的影响见表2。
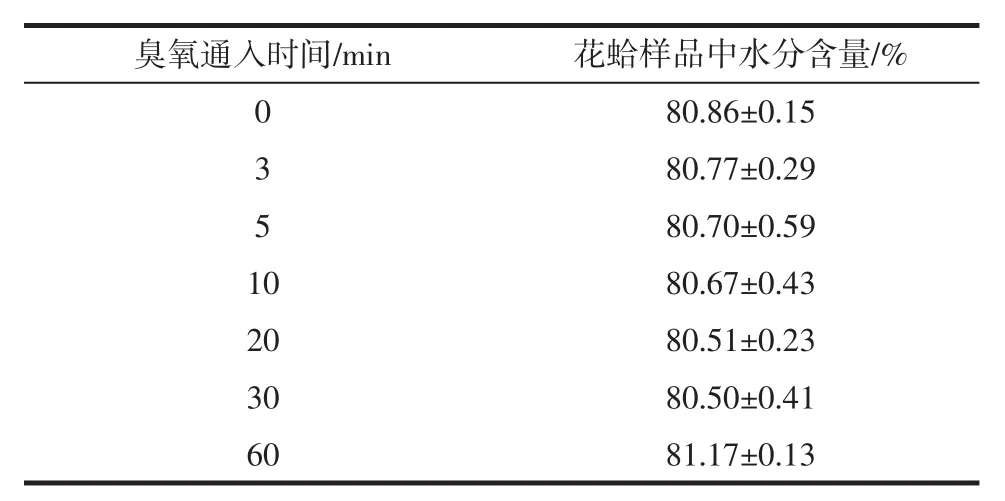
表2 通入不同时间臭氧时花蛤样品中分水含量Table 2 Water content in color clams when ozone is introduced at different times
臭氧通入蒸馏水中的时间不同,制得不同浓度的臭氧水。由不同浓度的臭氧水去处理花蛤样品后,通过显著性差异分析得,Sig=0.329>0.05,故臭氧通入时间对花蛤样品中的水分含量无显著影响,所以花蛤样品中的水分含量在臭氧降解前后没有显著的差异。
2.2 臭氧降解对花蛤中灰分的影响
通入不同时间臭氧时对花蛤中灰分的影响见表3。
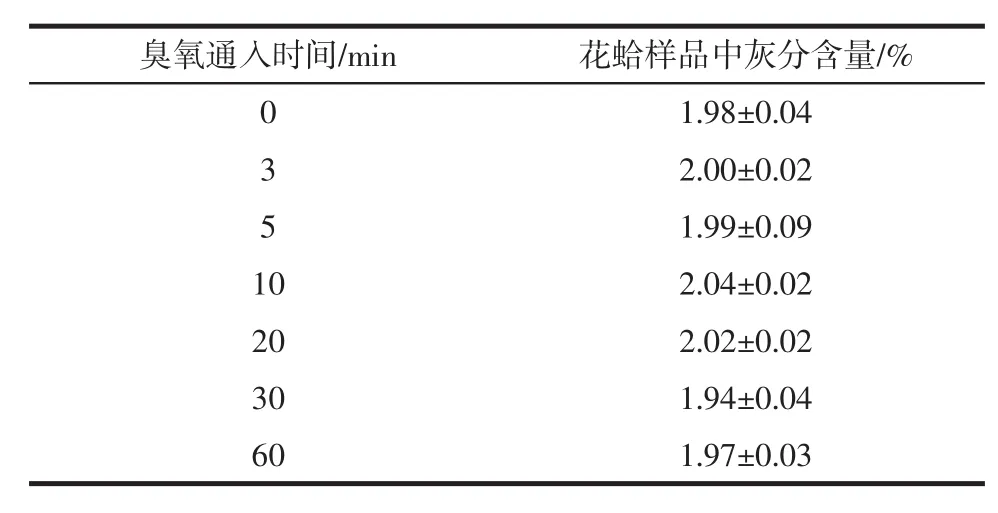
表3 通入不同时间臭氧时花蛤样品中灰分含量Table 3 Ash content in color clams when ozone is introduced at different times
同样制得不同浓度的臭氧水去处理花蛤样品,比较表3中的数据,臭氧通入时间为0 min,即用蒸馏水去浸泡花蛤样品10 min后,再去测定样品的灰分含量,为1.98%。而用不同浓度的臭氧水降解后测得的样品灰分含量,与0 min测得的数据在数值上相差不大,通过显著性差异分析得Sig=0.267>0.05,故臭氧通入时间对花蛤样品中的灰分含量没有显著影响。所以臭氧降解农残的过程中对花蛤样品的灰分含量没有较大影响。
2.3 臭氧降解对花蛤中粗脂肪的影响
通入不同时间臭氧时对花蛤中粗脂肪的影响见表4。
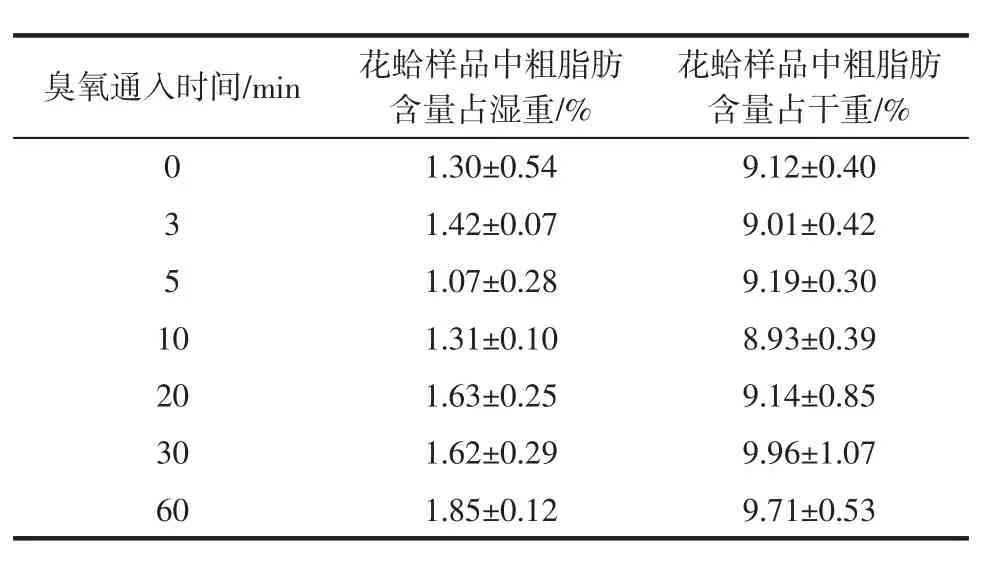
表4 通入不同时间臭氧时花蛤样品中粗脂肪含量Table 4 Crude fat content in color clams when ozone is introduced at different times
没有用臭氧降解的花蛤样品的粗脂肪含量占湿重的1.30%,占干重的9.12%。而用不同浓度的臭氧降解后的花蛤样品的粗脂肪含量略用增加。但通过显著性差异分析,发现Sig=0.066>0.05,臭氧通入时间对花蛤样品中的粗脂肪含量(湿重)没有显著影响,Sig=0.233>0.05,臭氧通入时间对花蛤样品中的粗脂肪含量(干重)没有显著影响。故臭氧降解农残的过程中对花蛤样品的粗脂肪含量没有较大影响。
2.4 臭氧降解对花蛤中粗蛋白的影响
通入不同时间臭氧时对花蛤中粗蛋白的影响见表5。
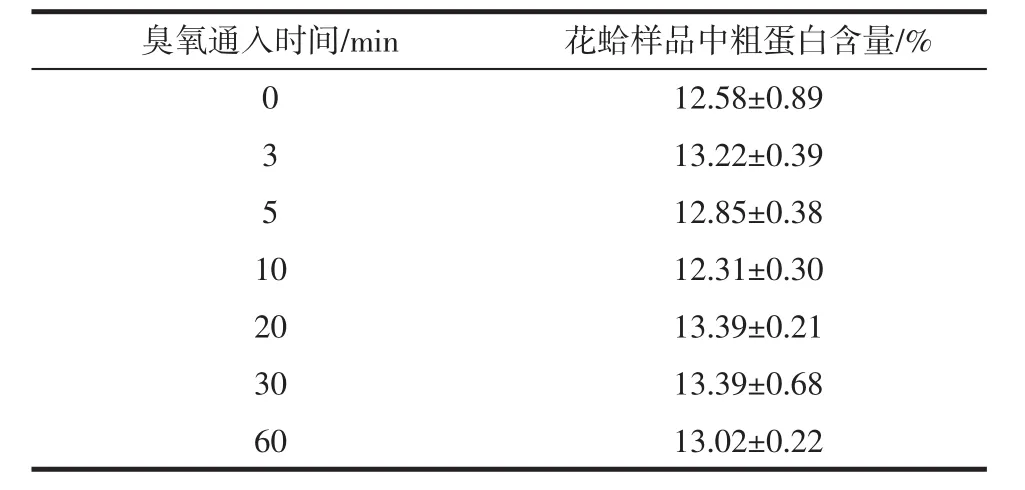
表5 通入不同时间臭氧时花蛤样品中粗蛋白含量Table 5 Crude protein content in color clams when ozone is introduced at different times
从表5可以得出,未用臭氧降解的花蛤样品中粗蛋白含量为12.58%,用不同浓度的臭氧降解后的花蛤样品的粗蛋白含量与降解前相比,有增加有减少,但变化不是很明显,通过显著性差异分析,得Sig=0.125>0.05,故臭氧通入时间对花蛤样品中的粗蛋白含量没有显著影响。所以用臭氧降解农残的过程中对花蛤中的粗蛋白含量没有明显影响。
2.5 臭氧降解对花蛤中总糖的影响
通入不同时间臭氧时对花蛤中总糖的影响见表6。
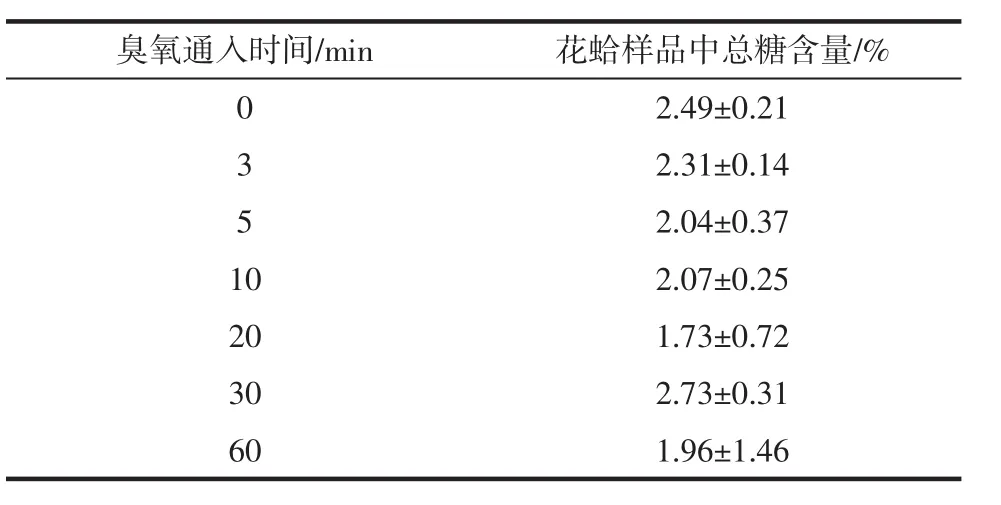
表6 通入不同时间臭氧时花蛤样品中总糖含量Table 6 Total sugar content in color clams when ozone is introduced at different times
由表6可得,未用臭氧降解前花蛤样品中总糖含量为2.49%,用不同浓度的臭氧降解后的花蛤样品的总糖含量都略有减少,但通过显著性差异分析得,Sig=0.100>0.05,臭氧通入时间对花蛤样品中的总糖含量没有显著影响。故用臭氧降解农残过程中对花蛤中的总糖含量无较大影响。
2.6 臭氧降解对花蛤中氨基酸组成的影响
花蛤中各氨基酸含量在臭氧降解前后的对比见图1。

图1 花蛤中各氨基酸含量在臭氧降解前后的对比图Fig.1 Comparison of amino acid content in color clams before and after ozone degradation
本试验共测定了花蛤样品中的16种氨基酸的含量。其中,苏氨酸、缬氨酸、异亮氨酸、亮氨酸、苯丙氨酸、赖氨酸为测定中的6种必需氨基酸,其总量在臭氧降解前为2.75 g/100 g,降解后为2.77 g/100 g,略有上升。对于花蛤而言,鲜味为其特有的,而决定鲜美程度的包括呈味氨基酸的组成和含量。其中通过图1也可以看出,天冬氨酸、谷氨酸、甘氨酸、丙氨酸、精氨酸的含量相对于其他氨基酸为较多。这5种氨基酸属于鲜味氨基酸[25-26],含量由5.47 g/100 g下降到5.26 g/100 g(相对误差为3.84%),略有下降。其中天冬氨酸和谷氨酸是呈鲜味的特征氨基酸,样品中二者的含量也是最高的,臭氧降解前分别为:1.70 g/100 g和1.75 g/100 g,臭氧降解后为:1.61 g/100 g(相对误差为5.29%)和1.63 g/100 g(相对误差为6.86%),两种氨基酸的含量都略有减少。通过显著性差异分析,同样得出,天冬氨酸的Sig=0.042<0.05,故臭氧通入时间对花蛤样品中的天冬氨酸的含量有显著影响,而谷氨酸的Sig=0.020<0.05,所以臭氧通入时间对花蛤样品中的谷氨基酸的含量也有显著影响。这可能是由于天冬氨酸和谷氨酸都是酸性氨基酸,其结构式中都含有两个羧基,而臭氧有强的氧化性,可能将羧基氧化了,导致这两种氨基酸的含量减少。而甘氨酸和丙氨酸是呈甘味的特征氨基酸,样品中二者的含量臭氧降解前分别为0.72 g/100 g和0.72 g/100 g,臭氧降解后分别为0.71 g/100 g(相对误差为1.39%)和0.70 g/100 g(相对误差为2.78%),这两种氨基酸降解前后的变化不大,显著性差异分析同样也未得出有显著性影响。而精氨酸的含量,臭氧降解前后分别为:0.58 g/100 g和0.61 g/100 g(相对误差为4.92%),略有增加。整体而言,臭氧降解农残的过程中会对花蛤中的氨基酸有一定的影响,如必需氨基酸会上升,而鲜味氨基酸略有下降,但是都在可接受的范围内(相对误差小于6.86%),不会对食用产生较大的影响。
2.7 臭降解对花蛤中脂肪酸组成的影响
花蛤中脂肪酸含量在臭氧降解前后的对比见图2。
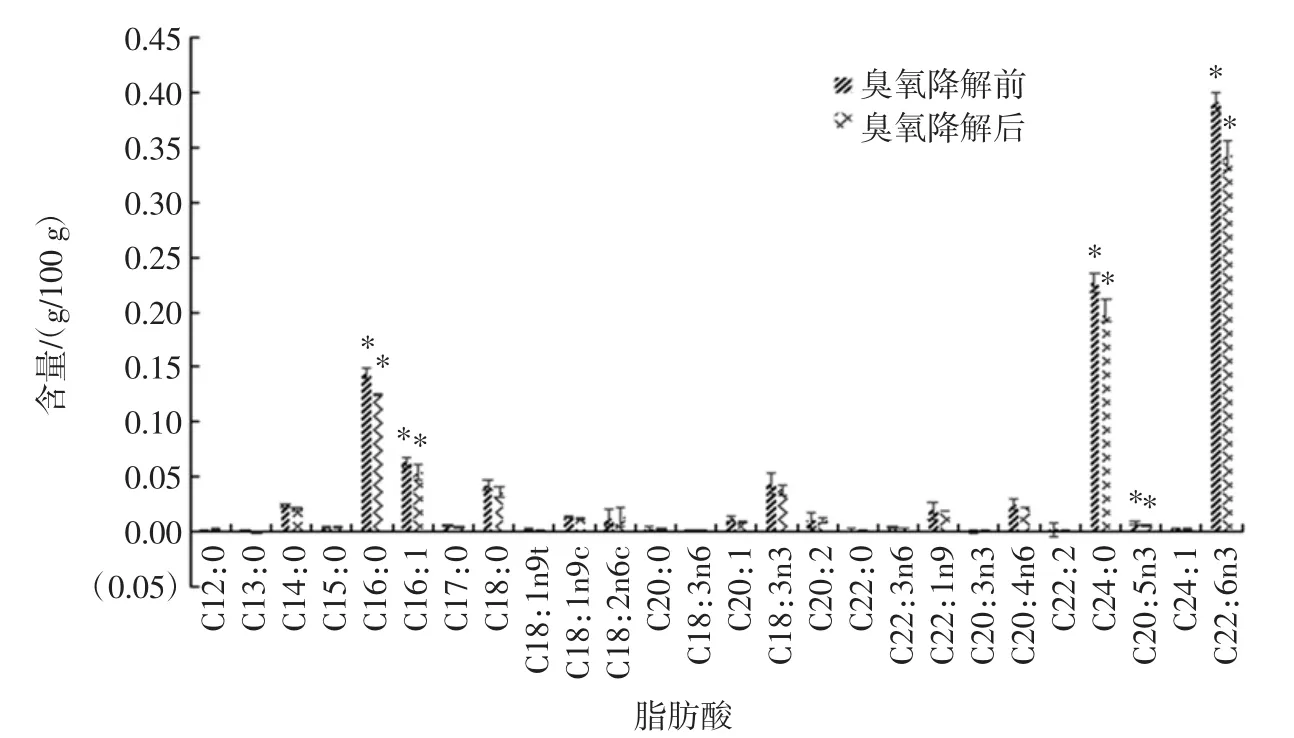
图2 花蛤中各脂肪酸含量在臭氧降解前后的对比图Fig.2 Comparison of fatty acid content in color clams before and after ozone degradation
通过气相色谱法测定花蛤中的脂肪酸,共发现了26种脂肪酸。其中饱和脂肪酸有10种,不饱和脂肪酸有16种,不饱和脂肪酸的含量占脂肪酸总量的57.5%。从图2数据中可得,脂肪酸的含量在臭氧降解农残的过程中都会受到略微的影响,其中不饱和脂肪酸受到的影响可能要大于饱和脂肪酸。且不饱和脂肪酸中双键的个数越多,受到的影响越大。但也有些不饱和脂肪酸的含量是增加的,如C24:1和C18:2n6c的含量,由降解前的0.000 9 g/100 g和0.013 0 g/100 g,上升为0.001 0 g/100 g和0.013 5 g/100 g。故不可说臭氧降解农残的过程中对花蛤中的脂肪酸都是起降解的作用,反而有些脂肪酸的含量是增加的。出现这样的现象可能是某些不饱和脂肪酸降解后恰好又形成了另一种脂肪酸,从而导致了有些脂肪酸的含量反而增加。整体而言,臭氧降解农残对花蛤的脂肪酸这一方面可能会起到一些降解的作用,但测定的26种脂肪酸中只有5 种(C22:6n3、C20:6n3、C16:1、C24:0、C16:0)脂肪酸的含量在臭氧降解前后有显著性差异,其他没有显著性差异。且其相对误差均小于9.17%,在可接受的范围内。
2.8 臭氧降解对花蛤中矿物质的影响
花蛤中矿物质含量在臭氧降解前后的对比见图3。
花蛤中主要的矿物质有 K、Ca、Na、Mg、P、Fe、Mn、Zn、Cu、Se这10种,从图3中可以看到,用通入30 min臭氧制得的臭氧水去处理的花蛤与未用臭氧水处理的花蛤相比,各矿物元素的含量没有较大差异。但有些元素的含量是有下降的,也有些是上升的。如钾的含量由1.85×103mg/kg下降为1.59×103mg/kg,钠的含量由3.72×103mg/kg下降为3.60×103mg/kg,而钙的含量却是由1.01×103mg/kg上升为1.16×103mg/kg。虽然各矿物元素有细微的差异,但有显著性差异的是Fe元素和Mn元素,这可能是由于臭氧在降解农残的过程中,这两种元素被氧化所造成的。
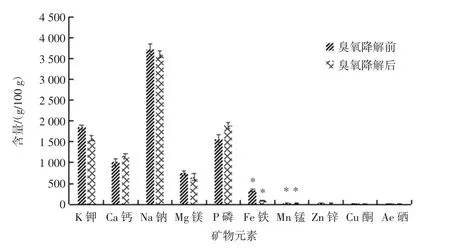
图3 花蛤中各矿物元素含量在臭氧降解前后的对比图Fig.3 Comparison of the content of various mineral elements in color clams before and after ozone degradation
2.9 臭氧降解对花蛤中维生素的影响
花蛤中维生素含量在臭氧降解前后的对比见图4。
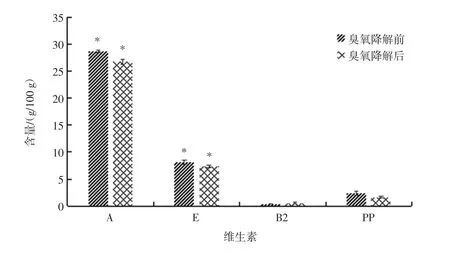
图4 花蛤中各维生素含量在臭氧降解前后的对比图Fig.4 Comparison of vitamins content in color clams before and after ozone degradation
花蛤中维生素含量丰富,其中维生素A、维生素E、维生素B2、维生素PP的含量较高,故选择测定了这4种维生素在臭氧降解前后含量的对比。由测定的结果可得,维生素A、维生素E的含量,臭氧降解后的含量要比臭氧降解前的含量略低,通过显著性差异分析,同样可以得出,维生素A的Sig=0.020<0.05,即臭氧通入时间对花蛤样品中的维生素A含量有显著影响,而维生素E的Sig=0.026<0.05,即臭氧通入时间对花蛤样品中的维生素E含量也有显著影响,但其相对误差均<10%。而维生素B2和维生素PP的含量在臭氧降解前后没有显著性差异。故可认为采用臭氧去降解农残的这个过程中对花蛤自身的维生素含量有一定影响,但也在可接受的范围内。
3 结论
采用臭氧降解农残的过程中,对花蛤样品中的水分含量无显著影响,无臭氧处理组的花蛤样品的水分含量为80.85%,用通入时长为60 min的臭氧水处理组的花蛤样品的水分含量为81.5%。同样对花蛤样品的灰分含量、粗脂肪含量、粗蛋白含量、总糖含量都无较为显著的影响。对比经过臭氧处理的花蛤样品和未经过臭氧处理的花蛤样品,发现:必需氨基酸的含量由2.75g/100g上升为2.77g/100g,鲜味氨基酸的含量由5.47 g/100 g下降为5.26 g/100 g(相对误差为3.84%)。对脂肪酸的影响显著,尤其是不饱和脂肪酸。10种矿物质和4种维生素的含量在臭氧降解前后,有些有显著性差异,但也在可接受的范围内。整体而言,在用臭氧降解农残的过程中,并不会对花蛤样品的九大营养方面产生明显的影响(相对误差均小于10%),故不会出现所担心的营养成分被破坏,造成营养的流失。同时对花蛤而言,也不会出现鲜味变弱,口感变差的现象。但采用臭氧处理,却可以有效去除食品中的一些有毒有害的农、兽药的残留,也可以明显地降低一些致病菌。
