香格里拉葡萄酒产区野生酿酒酵母的分离鉴定和发酵性能研究
2020-08-24杨宽张帅王柱华王慧玲王佩毛如志王文鹏何霞红
杨宽,张帅,王柱华,王慧玲,王佩,毛如志,王文鹏,何霞红,*
(1.云南农业大学农业生物多样性应用技术国家工程研究中心,云南昆明650201;2.云南农业大学食品科学技术学院,云南昆明650201)
葡萄酒是一种营养丰富的低酒精度发酵饮料,是用新鲜葡萄或葡萄汁经过酵母发酵、陈酿而成,由于其具有诱人的“色香味”以及很强的国际认同感,受到了越来越多人的关注和喜爱[1-2]。葡萄酒的酿造主要是在酿酒酵母的作用下,采用自然发酵或纯种发酵,将葡萄原料中的优良品质在酒中充分表现出来[3]。酿酒酵母的发酵特性因菌株不同而存在明显差异,对底物的利用和发酵产物也不同,从而使葡萄酒的风味物质存在差异,赋予产品独特的风味[4-5]。因此,酵母菌株的品质和特性对葡萄酒的质量影响很大,直接影响到葡萄酒的口感和风味,对葡萄酒特色和风格的形成至关重要[6]。现已知的葡萄酒香气成分超过1000种,其中由酵母菌发酵产生的香气成分超过400种[7]。酿酒酵母作为当地“风土terroir”的一部分,是充分体现当地葡萄酒特色的必要条件。我国葡萄种植面积广,不同葡萄酒产区的生态环境差异大,但随着种植面积逐年扩大,葡萄酒产量逐年上升,为保证发酵速率和发酵产品的一致性并避免污染,大多数国内葡萄酒生产商倾向于使用进口活性干酵母,这在一定程度上减少了当地野生酵母对葡萄酒香气的贡献,从而导致我国葡萄酒品质单一化、同质化严重等问题。研究表明,许多著名葡萄酒都是当地葡萄、工艺技术和微生物菌群共同作用的产物,形成独具特色的产地酒[8]。
关于酿酒酵母对于葡萄酒风味的影响,国内外的很多专家已经做了大量的研究。程仕伟等对烟台贵人香自然发酵醪中的野生酿酒酵母进行了选育及发酵特性的研究,发现菌株YGF2酿造的葡萄酒质量较好,香气浓郁,部分指标优于商品酿酒酵母,具备生产区域特色葡萄酒的潜力[9]。李金鹏对宁夏贺兰山东麓酿酒酵母进行了分离鉴定和发酵性能研究,结果在野生酿酒酵母发酵产物中检出了14种商业酿酒酵母没有检出的物质[10]。刘峻溪等探究了野生酵母和商品酵母在发酵葡萄酒中的挥发性成分差异,结果表明野生酿酒酵母所酿造的葡萄酒中主要挥发性物质的总含量要高于商品酿酒酵母[11]。Parapouli等从当地葡萄品种自然发酵过程中筛选出野生酵母,通过和商用酵母进行对比,结果表明用野生酵母所酿的酒风味更加丰富多样[12]。Carrascosa等研究了用野生酵母菌发酵西班牙白色葡萄品种Albariño,结果表明用当地分离的酵母菌可以调节Albariño白葡萄酒的感官特性[13]。Knight等研究发现分离自不同地区的酿酒酵母对葡萄酒香气质量的影响具有独特的地理特征,香气物质会随着不同的酵母地理来源而出现变化[14]。Vilanova等的研究表明通过筛选当地的野生酵母菌可以积极的影响葡萄酒的最终质量,他还进一步证明了,通过自然发酵得到的葡萄酒比接种选定的酵母菌株可以获得更多的芳香物质[15-16]。
香格里拉葡萄酒产区的葡萄园主要建在金沙江和澜沧江流域海拔1 700 m~2 800 m的干热和干冷河谷地带,是目前世界上海拔最高的酿酒葡萄产区之一[17]。香格里拉葡萄酒产区酿酒葡萄种植面积已超2万亩,并且坐落着著名的酒企,如酩悦轩尼诗香格里拉酒业,香格里拉酒业,梅里酒庄等。香格里拉地质地貌和气候多样性非常丰富,蕴含着大量的微生物资源。商敬敏[18]对香格里拉葡萄酒产区德钦地区葡萄园土壤中的酵母菌进行了分离鉴定和耐受性分析,共分离到8属8种,但并未分离到酿酒酵母;史涛涛[19]研究了德钦冰葡萄自然发酵过程中酵母菌的动态变化,并对冰葡萄分离出的酿酒酵母发酵特性进行了检测。赵悦等[20]对香格里拉葡萄酒产区的非酿酒酵母进行了分离鉴定及发酵香气分析。而本研究拟从香格里拉葡萄园中采集自然成熟的赤霞珠葡萄,对这些葡萄进行人工破碎后自然发酵,从自然发酵的葡萄醪中分离筛选酿酒酵母,通过对分离酿酒酵母的耐受性、发酵特性进行分析,并以商业酵母为对照,以期能够筛选到耐受性强,发酵性能优良的酿酒酵母,进而运用到香格里拉酒企的实际酿酒生产当中,增加香格里拉葡萄酒的产区特色。
1 材料与方法
1.1 试验材料
1.1.1 菌株分离材料
从香格里拉葡萄酒产区金沙江和澜沧江河谷流域选取5个5年以上的葡萄园,运用五点取样法,每个园子采集10 kg的葡萄样品,人工捣碎放在10 L的广口玻璃瓶中进行自然发酵。其中采样点斯农(SN)、江坡(JP)和阿东(AD)属于澜沧江流域,东水(DS)和东旺(DW)属于金沙江流域,从成熟葡萄自然发酵过程中分离野生酵母菌株。商业酵母UV43(加拿大Lallemand公司)、F15(法国laffort公司):香格里拉酒业股份有限公司提供。香格里拉葡萄酒产区采样点信息见表1。
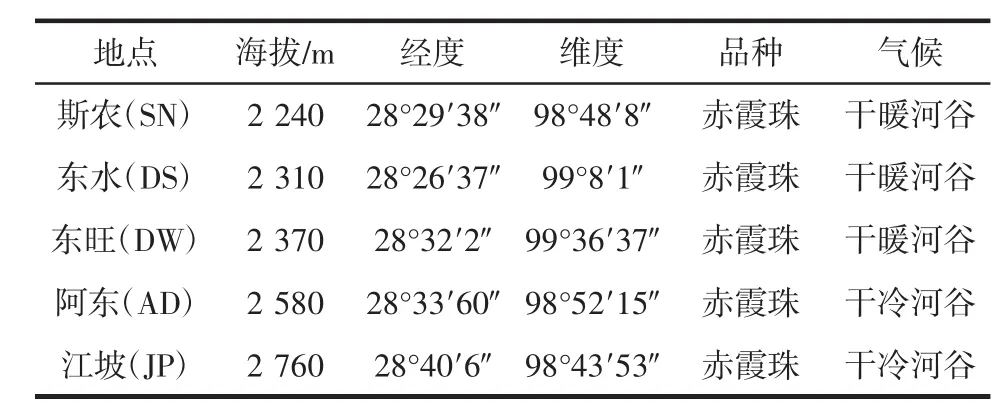
表1 香格里拉葡萄酒产区采样点信息Table 1 Information on the sampling point of Shangri-La wineproducing region
1.1.2 常用培养基
研究中主要使用以下培养基类型,配制完成后高压101℃灭菌30 min备用。
YEPD(yeast extract peptone dextrose)培养基:葡萄糖20.0 g/L,酵母浸粉10.0 g/L,蛋白胨20.0 g/L,琼脂20.0 g/L,为了防止细菌污染添加100 mg/L的氯霉素。
WL(wallerstein laboratory)营养琼脂培养基[21]:酵母浸粉4.0 g/L,胰蛋白胨5.0 g/L,葡萄糖50.0 g/L,磷酸二氢钾0.55 g/L,氯化钾0.425 g/L,氯化钙0.125 g/L,硫酸镁0.125 g/L,氯化铁0.002 5 g/L,硫酸锰0.002 5 g/L,溴甲酚绿 22 mg/L,琼脂 20.0 g/L,pH 5.5。
发酵培养基:葡萄糖20.0 g/L,酵母浸粉10.0 g/L,蛋白胨20.0 g/L,为了防止细菌污染添加100 mg/L的氯霉素。
模拟酒精发酵培养基:蛋白胨20.0 g/L,酵母浸粉10.0 g/L,葡萄糖 200.0 g/L。
1.1.3 主要试剂及配方
酵母基因组提取试剂盒:北京天根生化科技有限公司;酵母26S rDNA D1/D2区序列扩增(Master Mix、DNA Marker、ddH2O、琼脂糖、TAE 电泳缓冲液):北京擎科生物科技有限公司;引物NL1(5′-GCATATCAATAAGCGGAGGAA AAG-3′)、NL4(5′-GGTCCGTGTTTCAAGACGG-3′):由北京擎科生物科技有限公司合成;斐林试剂、NaOH标准滴定溶液、钨酸钠、钼酸钠、单宁酸、硫酸锂、溴水、没食子酸、硫酸铜、氢氧化钠、酒石酸钾钠和邻苯二甲酸氢钾:西陇化工股份有限公司。
1.2 仪器与设备
人工气候箱(MGC-300H)、电热鼓风干燥箱(PH-030A):上海一恒科学仪器有限公司;全温振荡培养箱(HZQ-F280):常州申光仪器有限公司;超净工作台(BCM-1600A):苏州安泰空气技术有限公司;光学显微镜(CX41):奥林巴斯(中国)有限公司;数显恒温水浴锅(HH.S21-8):上海博讯实业有限公司医疗设备厂;电子天平(CP214)、pH 计(ST5000-B):奥豪斯仪器(上海)有限公司;紫外-可见光分光光度计(UV-3150):日本岛津公司;高压灭菌锅(GI54DW):致微(厦门)仪器有限公司;凝胶成像系统仪(Quantum ST4):北京五洲东方科技发展有限公司;聚合酶链式反应(polymerasechainreaction,PCR)扩增仪(6311000070):Eppendorf。
1.3 试验方法
1.3.1 酵母菌的分离
自然发酵过程中酵母菌的分离:将采集的成熟葡萄样品,人工除梗破碎后放入10 L的玻璃罐中进行自然发酵,用WineScan FT 2-FOSS葡萄酒成分快速分析仪监测发酵过程,分别在发酵的前、中、后期取发酵液0.1 mL,加入0.9 mL无菌水中进行梯度稀释至10-5或10-6,取0.1 mL稀释后的发酵液放入YEPD固体培养基,以无菌涂布器涂匀,28℃培养2 d~3 d,根据菌落的颜色和形态差异,在每个发酵时期分别选取10个~15个菌落进行划线纯化,多次纯化后放入4℃冰箱中保存备用。
1.3.2 酵母菌的鉴定
1.3.2.1 酵母菌的初步形态学分类
将分离纯化到的酵母菌用划线法接种到WL培养基上,28℃培养5 d后,根据菌落的颜色和形态初步鉴定酵母的种属,并对形态相似的菌株进行归类。基于WL的培养结果,再在每种培养类型中选取1株~2株进行26S rDNA D1/D2区序列分子鉴定。
1.3.2.2 酵母菌的26S rDNA D1/D2区序列分子鉴定
首先提取酵母基因组DNA,然后用PCR扩增26S rDNA D1/D2区序列,PCR反应采用50 μL体系,其中双链总DNA模板各2 μL,上下游引物各2 μL,Master Mix 25 μL,最后添加 ddH2O 定容至 50 μL,PCR 产物送至北京擎科生物技术有限公司进行测序,然后将测序结果放在NCBI上进行BLAST search,比较供试菌株与Genbank中相应菌株的相似性,根据Kuttzman等[22]的酵母菌分类标准,同种内不同菌株间D1/D2区序列差异不超过1%,则它们应属于同一个种,再结合前面的菌落形态分析,初步确定酵母菌的种属。
1.3.3 酵母菌的发酵力测试
运用杜氏管发酵法,取100 mLYEPD液体培养基分装到15 mm×150 mm试管中,倒置放入杜氏管(保证杜氏管中无气泡),121℃灭菌20 min后备用。将冷却至常温的试管中接种酵母菌,放入28℃的人工气候箱中培养,每隔4 h观察杜氏管中气体的积存量并记录下来,连续观察7 d,最终根据酵母的产气情况,凝聚性和发酵液的气味来对酵母菌进行初步筛选。
1.3.4 酿酒酵母的抗性评价
1.3.4.1 葡萄糖耐受性评价
分别配置不同葡萄糖质量浓度(30%、40%、50%、60%),不同 NaCl质量浓度(6%、8%、10%、12%、14%、16%),不同乙醇体积分数(10%、12%、14%、16%)的发酵培养基,分别取10 mL分装到15 mm×150 mm试管中,倒置放入杜氏管,保证杜氏管中无气泡。接种活化的供试菌株到试管中,28℃静置培养,每隔4 h观察一次杜氏管内的气体寄存量并做好记录[20]。
1.3.4.2 高温耐受性评价
取灭过菌的YEPD液体培养基1mL分装到1.5mL的无菌离心管中。接种酵母菌到离心管中,分别置于35、40、45、50、55、60 ℃恒温水浴锅中温育 4 h,取出后再在28℃的培养箱中培养2 h,最后取100 μL用涂布器涂布于YEPD培养基平板上,28℃培养2 d~3 d,观察记录菌落生长情况。
1.3.5 模拟酒精发酵试验
配置200 g/L的YEPD液体培养基作为模拟酒精发酵液,取100 mL培养基分装到250 mL三角瓶中,121℃灭菌20 min后备用。然后将活化的待测菌株接种到三角瓶中,立即称重1次,28℃,120 r/min摇床培养,每隔24 h称重一次,参照国标GB/T 15038-2006《葡萄酒、果酒通用分析方法》测定发酵液的理化指标。
1.3.6 葡萄酒发酵试验
从香格里拉葡萄园中采摘赤霞珠葡萄运抵实验室后,立即进行破碎,将破碎后的发酵醪装入10 L的发酵玻璃瓶中,装量约为80%,并按照60 mg/L的量加入二氧化硫,浸渍24 h后接种待测酵母菌,酵母菌的接种量约为106个活酵母细胞/mL。然后进行酒精发酵,在发酵期间每天进行压帽2次~3次,待还原糖降为4 g/L时,视为发酵结束,后浸渍36 h后分离皮渣,最后静置澄清1个月后,分离酒泥,得到葡萄原酒。
1.3.7 葡萄酒的常规理化性质测定
还原糖:斐林试剂法;酒精度:密度瓶法;干浸出物:密度瓶法;总酸:氢氧化钠溶液滴定法(以酒石酸计);挥发酸:水蒸气蒸馏滴定法(以乙酸计)。以上指标均按照国标GB/T 15038-2006《葡萄酒、果酒通用分析方法》测定。
1.3.8 色度、色调的测定
采用可见-紫外分光光度计测定波长在420、520、620 nm条件下的吸光值。色度值记为三者之和,即色度=A420+A520+A620;色调以420 nm与520 nm下吸光值的比值计算,即色调=A420/A520。
1.3.9 单宁、总酚含量的测定
单宁:采用福林-丹尼斯法(Folin-Denis);总酚:采用福林-肖卡法(Folin-Ciocalteu)。
1.3.10 数据处理
本研究试验数据采用Excel 2010软件进行计算,用SPSS 18.0软件进行方差分析(analysis of variance,ANOVA)。
2 结果与分析
2.1 野生酿酒酵母的分离和鉴定
初步鉴定为酿酒酵母的菌落和细胞形态以及PCR扩增条带见图1。

图1 初步鉴定为酿酒酵母的菌落和细胞形态以及PCR扩增条带Fig.1 Initially identified as S.cerevisiae colony and cell morphology and PCR amplified bands
从香格里拉5个葡萄园中的葡萄皮上和自然发酵过程中共分离到230株酵母菌。全部接种到WL培养基上,培养5 d后,根据菌落颜色和形态进行聚类,菌落特征为奶油色带绿色,球形突起,表面光滑,不透明,奶油状的可以初步判断为酿酒酵母(如图1a)。
其中有98个菌株聚为此类,为了进一步确定WL培养基鉴定的准确性,在聚类为酿酒酵母的类别中随机选择2个菌株进行分子鉴定,对菌株的26S rDNA D1/D2区序列进行测序,在NCBI上进行BLAST。根据Kurtzman和Robnett的酵母菌分类标准,同种内不同菌株间D1/D2区序列相似率大于99%,一般可认为是同一个种,随机挑选的两个菌株(AD3-1,SN1-9)的序列比对结果见表2。

表2 2株代表菌株的分子鉴定结果Table 2 Molecular identification of two representative strains
可以看出两个菌株和酿酒酵母的相似率为99%,可以鉴定为酿酒酵母,且两个菌株的26S rDNA D1/D2区序列已经上传至NCBI,获得了基因库登录号(AD3-1:MF769586,SN1-9:MF769605)。
2.2 酿酒酵母的杜氏管发酵试验
采用杜氏管法对香格里拉葡萄园自然发酵过程中分离得到的98株酵母菌进行初步发酵力的测定,从中筛选出16株起发早、发酵快、产香好的菌株,其发酵力测定结果见表3。
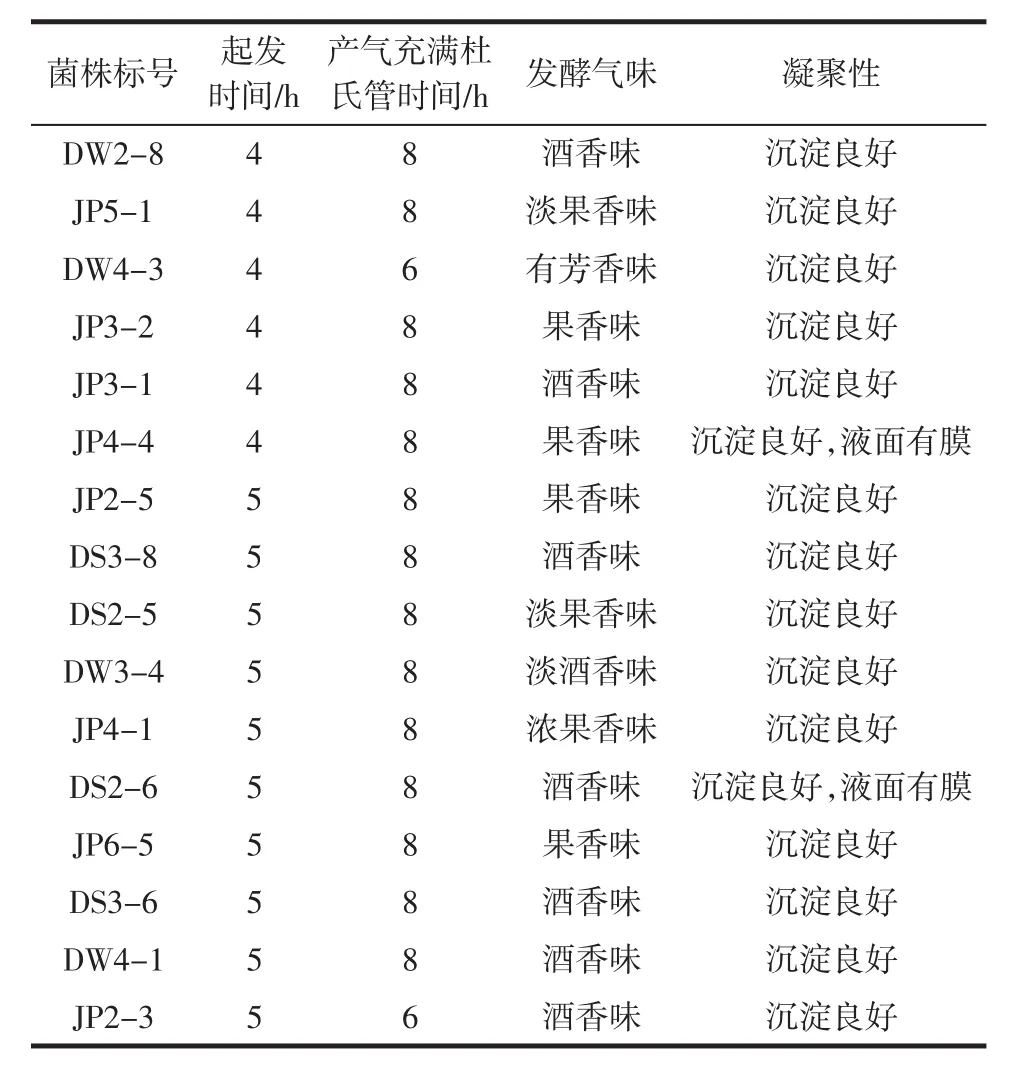
表3 16株酿酒酵母的杜氏管发酵力比较Table 3 Comparison of fermentation capacity of 16 strains of Saccharomyces cerevisiae in Durham tube
从表3中可以看出,所选的16株酿酒酵母最晚起发时间为5 h,一般为4 h就可以启动发酵,在起发时间后的2 h~4 h后,所有菌株产气均充满杜氏管,且发酵液呈现不同的香味,无不愉快的气味。相对于其他82株酿酒酵母,所筛选的16株酿酒酵母起发早、发酵速度快、产香好,可用于进一步的评价筛选。
2.3 16个菌株的综合抗性比较
对筛选出16株起酵快,发酵力强的酿酒酵母菌株,通过葡萄糖耐受性、NaCl耐受性、酒精耐受性、高温耐受性等指标进行综合评价,见表4。

表4 16株酿酒酵母的综合抗性评价Table 4 Comprehensive tolerance evaluation of 16 strains of Saccharomyces cerevisiae
从表4可以看出,16株酵母菌都能耐受400 g/L葡萄糖,12%vol的酒精,12%的NaCl浓度,且能正常产气发酵,生长繁殖不受影响,这完全可以满足一般葡萄酒的生产要求。
16株酵母菌株的耐受特性不同,某些菌株只能在1个~2个耐受性方面表现出色,而很少有在各个方面都很强的菌株,综合杜氏管发酵数据和耐受性数据,最终选出 DW4-3、DS3-8、DS2-5、DS3-6、JP2-3 等5 株抗性相对较强的菌株做下一步的模拟酒精发酵试验。
2.4 5个酵母菌株的模拟酒精发酵试验
对以上选出的5株酿酒酵母做模拟酒精发酵试验,并与2株商业酵母F15和UV43做对比,分别比较它们的发酵力,产酸、酒精和残糖的数据。7株酿酒酵母的模拟酒精发酵试验见表5。
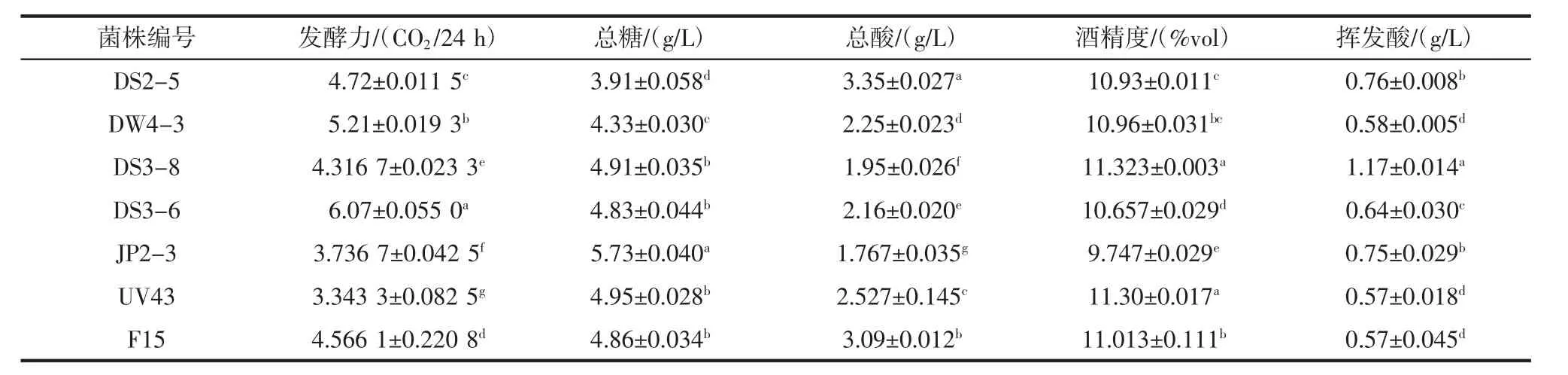
表5 7株酿酒酵母的模拟酒精发酵试验Table 5 Comprehensive tolerance evaluation of 7 strains of Saccharomyces cerevisiae
由表5可以看出各菌株发酵性能之间差异明显,但各有优劣,其中野生酵母DS3-6的发酵力最强,菌株DW4-3、DS2-5的发酵力均比两株商业酵母的强,且具有显著差异,而商业酵母UV43相对较弱;针对产酒精能力,菌株DS3-8最强,其次是商业酵母UV43和F15;对于挥发酸和总酸来说,菌株DS3-8也较高;整体而言,自选酵母的不同菌株在发酵过程中表现各不同,各有优缺点,商业菌株UV43和F15发酵性能表现较稳定,其他5株野生酵母发酵力较好。
2.5 葡萄酒发酵试验
以香格里拉产区赤霞珠葡萄为原料,按照干红葡萄酒酿造工艺接种筛选的5株酵母DW4-3、DS3-8、DS2-5、DS3-6、JP2-3进行发酵,并与商业酵母 F15作对比发酵,发酵结束后,对每个葡萄原酒酒样进行理化指标检测,包括总糖、酒精度、总酸、挥发酸、干浸出物质、单宁、总酚和色度色调。所选酿酒酵母菌株酿造干红葡萄酒的理化性质分析见表6。
根据表6的结果,所有菌株发酵酿造干红葡萄酒,所得酒样总糖含量均在4 g/L以下,达到干红葡萄酒关于总糖含量的标准。酒精度除了CK外,均在14%vol左右,相对于商业酵母,除了菌株DS2-5,其它菌株酒精度均比F15高,且差异显著(p<0.05)。所有菌株的总酸含量在5.76 g/L~7.78 g/L之间,其中CK的最高,其次是菌株JP2-3,野生酿酒酵母和商业酵母无显著差异。关于挥发酸,除了菌株DW4-3和DS3-6在国家规定范围内之内[23],其他菌株酿造干红葡萄酒的挥发酸普遍较高,其中菌株JP2-3甚至接近2 g/L,商业酵母也较高,其中菌株DS2-5和商业酵母挥发酸含量无显著差异,推测可能在葡萄酒存放过程中由于醋酸菌感染造成挥发酸升高。葡萄酒的干浸出物是葡萄酒的一个很重要的理化指标,也是一个衡量葡萄酒质量的重要指标,它和葡萄品种,葡萄原料的质量以及酿酒工艺都有很大的关系,除了这些,干浸出物中还含有一些酵母酒精发酵的副产物,所以这和酵母菌株也有很大的关系。研究结果表明,干浸出物含量最高的是DS 2-5,含量为28.75 g/L,菌株DS3-8含量最低,其余3株自选酵母所酿干红葡萄酒和商业酵母均无显著差异。各菌株所酿葡萄酒单宁、总酚、色度和色调的情况见表7。
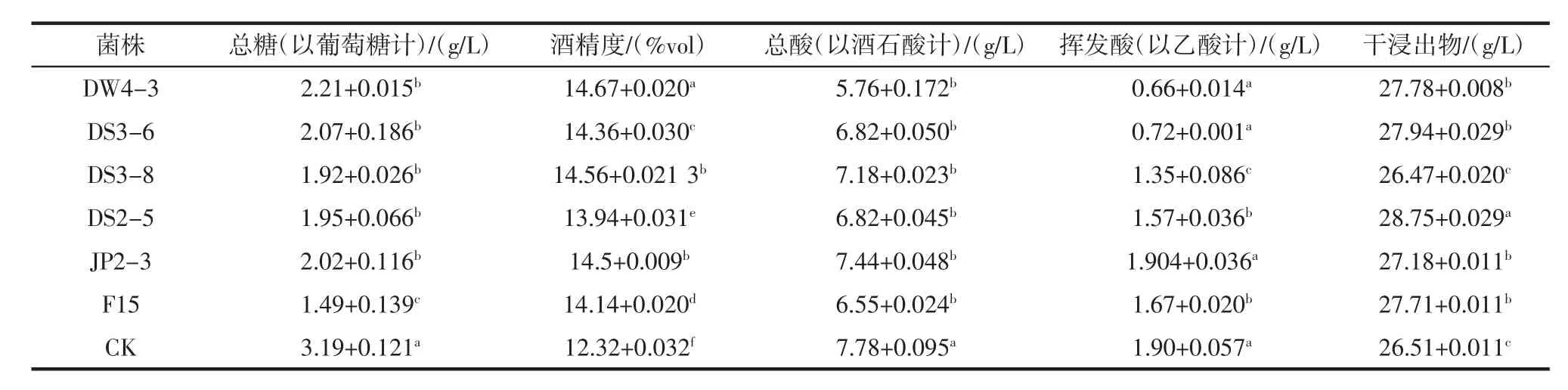
表6 所选酿酒酵母菌株酿造干红葡萄酒的理化性质分析Table 6 Physicochemical properties of dry red wine brewed by selected strains
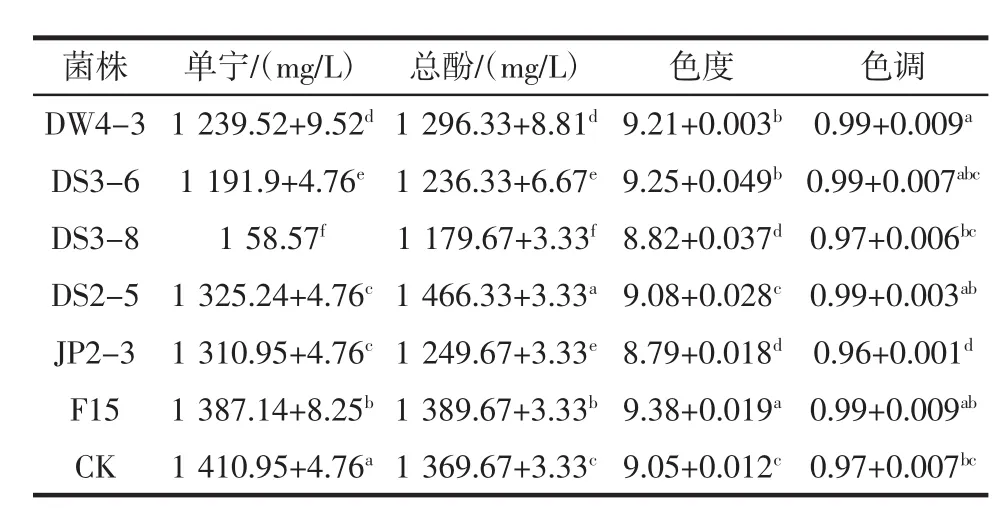
表7 所选酿酒菌株酿造干红葡萄酒的理化性质分析Table 7 Physicochemical properties of dry red wine brewed by selected strains
一般来说,葡萄酒的总酚含量和色度呈正相关性,因为葡萄酒中的显色物质多为酚类物质,从所测结果来看,菌株DS2-5所得总酚含量最高,其次是商业酵母,并具有显著差异。葡萄酒的发酵过程,同时是葡萄果实中的酚类物质、单宁和香气的浸渍提取过程,提取效果的好坏,和发酵过程的温度、pH值和操作工艺有关,同时酵母菌的活动也会影响这个过程[24]。单宁的含量可以影响葡萄酒的酒体结构和口感质地,除了CK,商业酵母所酿酒的单宁含量最高,其次是DS2-5和JP2-3,CK的含量最高,推测在葡萄原料相同的情况下,自然发酵过程中酿酒酵母的混合菌株发酵可能更有助于单宁的浸渍提取,这有待下一步的验证。相对于商业酵母,除了菌株JP2-3,野生自选菌株的色调和商业酵母均无显著性差异。综合不同菌株所酿葡萄酒的理化性质指标,菌株DS2-5所酿干红葡萄酒总糖、酒精度和总酸均符合干红葡萄酒国家标准,且在干浸出物,总酚和单宁含量等方面表现突出,干浸出物和总酚含量高于商业酵母F15,色调和商业酵母无显著性差异,可以作为优选酵母菌做下一步的酿酒试验以及用于实际酿酒生产当中。
3 讨论与结论
本研究一共在香格里拉葡萄酒产区分离到98株酿酒酵母,首先对这些菌株进行杜氏管发酵试验初步筛选出起发早,产香好的菌株,然后对这些菌株进行耐糖、耐酒精、耐氯化钠以及耐高温等进行抗性评价,最终选出 DW4-3、DS3-8、DS2-5、DS3-6、JP2-3 等 5株表现较好的菌株做下一步的葡萄酒发酵试验。经过模拟酒精发酵以及干红葡萄酒小试,综合不同菌株所酿葡萄酒的理化性质指标,菌株DS2-5所酿干红葡萄酒总糖、酒精度和总酸均符合干红葡萄酒国际规定,且在干浸出物,总酚和单宁含量等方面表现突出,干浸出物和总酚含量高于商业酵母F15,色调和商业酵母无显著性差异,可以作为优选酵母菌做下一步的酿酒试验以及用于实际的酿酒生产当中。
酿酒酵母在发酵葡萄酒的过程当中,会遇到各种不利条件,如高温,低温,高渗透压以及高酒精度等,如果酿酒酵母菌株抗胁迫能力不强,就会有发酵迟滞和发酵停止的风险[25]。而在其他外界条件适宜的情况下,酵母耐葡萄糖能力越强,其生长和发酵速率受影响越小,产酒度越高,耐高温菌株可以间接降低葡萄酒的生产成本[18]。所以对酿酒酵母菌株进行耐受性检验,是进行工业生产的基础。王风梅等[26]探究了内蒙古西部地区葡萄酒酿酒酵母的发酵特性,从菌株的耐受性和发酵特性展开研究,筛选到了可以耐受18%vol酒精度和14%NaCl浓度的酿酒酵母,而本研究分离的菌株最大酒精耐受度为16%vol,最大NaCl浓度为12%,高糖耐受性相同,推测酿酒酵母在不同地理气候环境下具有产区差异,但都可以满足正常的葡萄酒发酵过程。程仕伟等[27]对新疆霞多丽葡萄自然发酵醪中的酿酒酵母进行了选育及酿造特性研究,结合发酵特性、耐受性分析以及酿酒试验,最终选出一株(XXF3)可以耐受500 g/L葡萄糖,19%vol酒精的酿酒酵母,其整体发酵指标较好,部分指标优于商业酵母,和本研究的结果类似。张莉等[28]在苹果园土壤、果实及表皮中的酿酒酵母菌株进行了耐受性分析,筛选到菌株Y-2和F-3在400 g/L葡萄糖下能够快速启动发酵,同时能够耐受16%vol酒精、20 g/L的柠檬酸和200 mg/L的SO2。综合以上分析,在不同葡萄酒产区或者不同地域都可以分离到大量的酿酒酵母,不同菌株间耐受性差异较大,经过不同条件筛选,都可以分离出抗逆性较强的菌株,以期用于实际的生产当中。
葡萄酒的理化指标在很大程度可以反映葡萄酒的质量,葡萄酒在由葡萄转化为酒的过程当中,酵母菌是其中主要的驱动力量,酿酒酵母把葡萄汁中的糖分转为为酒精、二氧化碳和其他不同的副产物,同时酵母的活动也会影响葡萄果实酚类物质、单宁和香气的浸渍提取过程[24]。在葡萄原料,发酵工艺相同的情况下,酿酒酵母同样影响着葡萄酒的质量。本研究中野生酵母菌株和商业酵母菌株F15所酿葡萄酒相比,残糖均在4 g以下,除了菌株DS2-5,其它菌株酒精度均高于F15,且差异显著;总酸无显著差异;干浸出物菌株DS2-5高于F15,且具有显著差异;单宁含量F15高于野生酵母;总酚含量菌株DS2-5高于F15,且差异显著。解卫海等[29]研究了玫瑰香葡萄自然发酵醪中选育的酿酒酵母的酿造特性,用筛选的酿酒酵母发酵赤霞珠葡萄酒,结果表明野生酵母菌株MF1的发酵酒样在常规参数上与对照组无明显差异,在总酚和单宁含量均高于商业酵母D254和RC212,和本研究结果相似。蒋文鸿等[30]对昌黎赤霞珠葡萄相关酿酒酵母进行了分离与筛选,发现野生分离菌株a和d所酿葡萄酒干浸出物和总酚含量均高于商业酵母,和本研究中所分离的菌株DS2-5特性类似。综上所述,酿酒酵母在一定程度可以影响葡萄酒的理化性质,进而影响葡萄酒的质量,经过前期筛选,可以获得发酵性能和商业酵母无差异的菌株,并且可以发现,优选野生酵母菌株所酿葡萄酒在单宁、总酚和干浸出物这方面优于商业酵母,推测在酒精发酵过程当中优选野生酵母菌株增加了葡萄皮的浸渍效果。
香格里拉是一个新兴的、具有高原特色的葡萄酒产区,该地区气候多样、地理地貌多样。香格里拉金沙江流域和澜沧江流域的葡萄园中,蕴藏着丰富的微生物资源,富集了大量的葡萄酒相关酵母,发掘这些酵母资源为酵母菌多样性的保护和利用奠定了基础。酿酒酵母作为葡萄酒发酵过程当中最重要的一类微生物之一,当地野生酿酒酵母更能够突显产地葡萄酒的质量和风格特色。在本研究中共筛选到5株发酵性能优良的酿酒酵母,下一步要对筛选出的酿酒酵母进行重复小试、中试以及应用到实际生产,以期最终制作成商品菌剂,应用到香格里拉高原特色葡萄酒的生产当中。
