产胞外多糖酵母菌的分离鉴定及其发酵条件优化
2020-08-24马岩石刘韩裴芳艺
马岩石,刘韩,裴芳艺
(齐齐哈尔医学院科研处,黑龙江齐齐哈尔161000)
微生物多糖是细菌、真菌等在生长代谢过程中产生并分泌到细胞外的一类多糖[1]。酵母多糖分为胞外多糖(exopolysaccharides,EPS)和胞壁多糖[2],与胞壁多糖相比,胞外多糖更易与菌体分离,且在水溶液中呈稳定的胶体状态[3-4]。酵母EPS主要由半乳糖和葡萄糖组成,其中酵母葡聚糖是第一个被发现具有免疫活性的葡聚糖[5],有抗肿瘤、抵抗微生物感染、抗辐射、增强机体免疫力,预防糖尿病、心血管疾病和控制体重等作用[6-7]。但截止到目前,酵母菌EPS的很多特性未得到解析,因此研究酵母EPS具有较强的市场竞争力和广阔的发展前景。孙晓萌等从海参肠道内分离出可产EPS的季也蒙假丝酵母(Candida guilliermind)HS-J9,对所产EPS抗氧化能力进行研究发现,EPS2-1具有较强的抗氧化活性和还原力[8]。马文锦从胶红酵母(Rhodotorula mucilaginosa)CM-1和 CICC 33013液体培养基中分别分离得到水溶性EPS,其产量分别为7.35 g/L和6.2 g/L,对其EPS结构、生物活性及转录组表达差异进行了分析,弥补了R.mucilaginosa产EPS这一领域的技术空白[9]。
锁掷孢酵母属(Sporidiobolus)包含锁掷孢酵母(S.johnsonii)、小孢子锁掷孢酵母(S.microsporus)、近玫色锁掷孢酵母(S.pararoseus)、鲁宁锁掷孢酵母(S.ruinenii)、赭色锁掷孢酵母(S.salmonicolor)[10]。其中S.pararoseus作为一类非常规酵母,早期研究主要集中在分类学及生态分布等方面[11],但随着研究的不断深入,发现此类酵母在环境治理、生物防治、食品和医药等领域有着突出的作用[12]。S.pararoseus细胞不仅可以积累油脂、产生色素还可以代谢EPS等有益代谢产物[13-14]。张可可等在烟草废水中分离出一株具有产油脂和色素潜力的S.pararoseus,为有机酿造废水的资源化利用提供参考[15]。赵利娜等利用蛋白质组学技术对S.pararoseus进行体外降解展青霉素(patulin,PAT)研究,其结果为推动生物法控制及降解PAT做出一定贡献[16]。性能优良的菌种,与菌种生长相匹配的发酵条件决定发酵过程的成败[17]。发酵过程的碳源和氮源的添加量、培养基的初始pH值和发酵过程各参数的控制是影响酵母EPS产量的关键因素[18]。本试验以葡萄园土壤为试验材料,利用YPD和WL选择培养基筛选出高产EPS的菌株,通过显微形态观察、菌落形态观察、生理生化鉴定以及18S rDNA技术对所获得菌种进行鉴定,并以该菌株为出发菌株,通过响应面法优化菌株产EPS条件。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
土壤:取自齐齐哈尔市周边某葡萄园。
1.1.2 试剂
生理生化试剂:葡萄糖、半乳糖、麦芽糖、蔗糖、蜜二糖、乳糖、纤维二糖、松三糖、棉子糖、核糖、木糖、鼠李糖、水杨苷、甘油、木糖醇、山梨醇、甘露醇、肌醇、七叶苷、马尿酸、硝酸盐、亚硝酸盐、尿素酶、赖氨酸脱羧酶:北京陆桥技术股份有限公司;海藻糖、菊糖、淀粉、D-阿拉伯糖、L-阿拉伯糖、赤藓糖醇、核糖醇、L-精氨酸双水解酶、硫化氢:青岛高科技工业园海博生物技术有限公司。葡萄糖、硫酸铵、硫酸镁、氯化钙、磷酸氢二钾、氯化钠、苯酚、硫酸、三氯乙酸:均为分析纯,天津市江天化工技术有限公司。
酵母基因组DNA提取试剂盒(DP307-02)、Lyticase溶壁酶(3000 U)(RT410-02)、6×DNA 电泳 Loading Buffer(RT201-01)、Agarose LE(RT101)、50×TAE Buffer(RT204)、GeneRed 核酸染料(RT211)、D2000 DNA Marker (MD114-01)、D15000DNA Marker(MD110-01)、2×Taq PCR Mastermix(KT201-02):天根生化科技(北京)有限公司;山梨醇buffer(DZSL0332):北京酷来搏科技有限公司。
1.1.3 培养基
YPD琼脂培养基(货号HB5193)、YPD液体培养基(货号HB5193-1)、WL营养琼脂(货号HB0300):青岛高科技工业园海博生物技术有限公司。
产糖基础培养基(g/L):葡萄糖 15,硫酸铵 15,硫酸镁1.8,氯化钙0.28,磷酸氢二钾0.24,氯化钠0.6,蒸馏水,1 L,pH值7.0,121℃灭菌 15 min,用于产糖菌株的筛选。
1.1.4 仪器与设备
高速离心机(22331Hamburg)、台式高速大容量冷冻离心机(5804R):德国 Eppendorf公司;pH计(FE28)、电子天平(AL204):梅特勒-托利多集团;可见分光光度计(V-5000):上海元析仪器有限公司;电热恒温培养箱(DHP-9162)、落地振荡器(HZQ-211C):上海一恒科学仪器有限公司;PCR仪(C1000-touch)、全自动荧光和化学发光成像分析系统(ChemiDoc MP):美国Bio-rad;光学显微镜(CX31):日本 Olympus公司。
1.2 试验方法
1.2.1 S.pararoseus菌株的初步分离筛选
称量10.0 g葡萄园中采集的土壤,放入100 mL无菌水内振荡培养1 h,制成菌悬液,梯度稀释至10-7,分别取每个梯度的稀释液0.1 mL涂布于YPD固体培养基上,每个稀释度作2个平行样,28℃培养3 d,挑取单菌落保存备用。
将保藏的菌株用YPD液体培养基活化后,三区划线的方法接种于WL固体培养基上,28℃培养7 d后,挑取单菌落保存备用。
1.2.2 形态特征观察
将菌株接种到YPD液体培养基中,28℃培养3 d,在显微镜下观察菌体的形状、大小及繁殖方式。分别将菌株三区划线于YPD、WL固体培养基上,28℃培养7 d,观察其形成的菌落颜色、质地、表面形态、边缘形态及培养基颜色变化情况[10,19]。
1.2.3 高产EPS菌株的筛选
利用苯酚-硫酸法测定发酵液中EPS含量[20],筛选出高产EPS的菌株。取1.5 mL发酵液,12 000 r/min离心10 min,将上清液适当稀释后取1 mL与1 mL体积分数6%的苯酚溶液和5 mL浓硫酸溶液混匀,静置冷却至25℃后,于波长490 nm处测定吸光度值。以葡萄糖为标准制作标准曲线[21],根据标准曲线计算发酵液中EPS的含量。
1.2.4 生理生化特征鉴定
按照试剂盒说明书要求,制备菌悬液,接种生化试剂管,28℃培养2 d后观察[10,22]。同化试验碳源主要包括葡萄糖、半乳糖、麦芽糖、蔗糖、海藻糖、蜜二糖、乳糖、纤维二糖、松三糖、棉子糖、菊糖、淀粉、核糖、木糖、D-阿拉伯糖、L-阿拉伯糖、鼠李糖、水杨苷、甘油、赤藓糖醇、核糖醇、木糖醇、山梨醇、甘露醇、肌醇、七叶苷、马尿酸。氮源主要包括硝酸盐,亚硝酸盐和赖氨酸脱羧酶、L-精氨酸双水解。其它生化试验主要包括:尿素酶、葡萄糖产气试验、硫化氢试验。
1.2.5 18S rDNA序列分析及构建系统发育树
基因组DNA提取:活化的种子液经12 000 r/min离心1 min后收集沉淀。按照基因组DNA提取试剂盒说明书,提取基因组DNA。以NS1:5'GTAGTCATATGCTTG TCTC 3';NS6:5'GCATC ACAGA CCTGT TATTG CCTC 3'为引物进行18S rDNA部分序列扩增。聚合酶链式反应(polymerase chain reaction,PCR)扩增体系:2×Taq PCR Mastermix 25 μL;模板 DNA 2 μL;上下游引物各1 μL;补加ddH2O至50 μL。PCR 扩增条件:95℃预变性5 min;95℃变性 30 s,58℃退火 30 s,72℃延伸 90 s,35个循环;72℃再延伸7 min。PCR产物经凝胶验证后,送上海生工生物公司测序。测序结果上传至NCBI数据库,获得GeneBank登录号。在NCBI数据库中进行 BLAST,利用 MEGA 5.0,Neighbor-Joining方法构建系统发育树,确定菌株同源性和种属水平[23-24]。
1.2.6 Plackett-Burman(PB)试验设计
根据基础产糖培养基的成分,在单因素试验的基础上,确定影响EPS产量的8个因素(葡萄糖、硫酸铵、硫酸镁、氯化钙、磷酸氢二钾、氯化钠、装液量、初始pH值),及每个因素的水平范围。以EPS产量Y为响应值,将每个因素分为高(+1)、低(-1)2个水平。Plackett-Burman(PB)试验设计因素与水平见表1,共进行15组试验,每组3个平行[25-26]。以2%的接种量接种,28℃140 r/min振荡培养5 d。
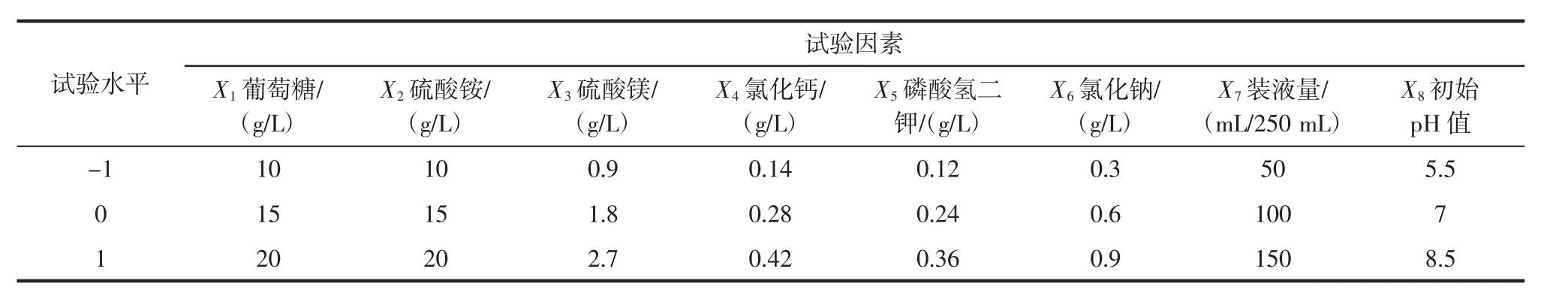
表1 两水平析因试验因素与水平Table 1 Factors and levels of factorial tests with two levels
1.2.7 中心组合试验(central composite design,CCD)
根据PB试验的结果,以EPS产量Y为响应值,对EPS产量的影响因素葡萄糖、硫酸镁、初始pH值,进行响应面分析试验,得到最优方案。响应面试验设计因素与水平见表2。
1.2.8 验证试验
多糖的提取参照DU等的方法[27]。菌株以2%接种量接种到优化后的发酵培养基中,28℃140 r/min振荡培养5 d得到发酵液。4℃、11 000 r/min离心20 min去除菌体。在上清液中加入3倍体积的预冷体积分数95%的乙醇,4℃过夜,4℃、11 000 r/min离心20 min收集沉淀,用适量去离子水溶解多糖沉淀,加入等体积的10%三氯乙酸,充分搅拌,4℃静置24 h,4℃、11 000 r/min离心20 min,去除沉淀。在上清中加入3倍体积的预冷体积分数95%的乙醇,4℃过夜,4℃、11 000 r/min离心20 min收集多糖沉淀,溶于50 mL去离子水中,装入透析袋,4℃透析2 d,每8 h换1次水。
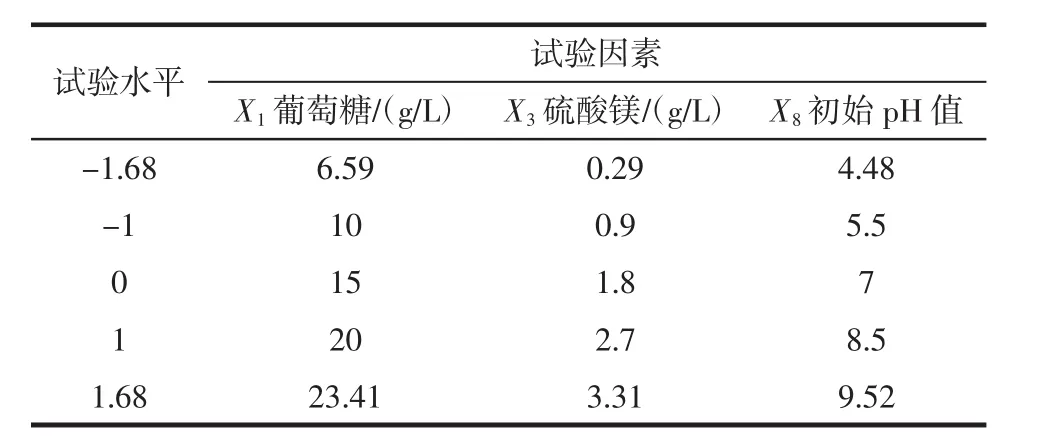
表2 中心组合设计因素与水平Table 2 Factors and levels of central composite design
1.3 数据统计分析
响应面试验设计使用Design Expert 8.0;系统发育树构建使用MEGA 5.0;统计分析使用SPSS 19.0,以p<0.05为差异显著,p<0.01为差异极显著;绘图使用Excel 2016。
2 结果与分析
2.1 试验菌株的筛选
通过菌落形态观察和苯酚-硫酸法测定发酵液中EPS含量,共得到4株具有产糖能力的S.pararoseus,EPS产量分别为PFY-B1菌株(3.58±0.12)g/L、PFY-F1菌株(2.92±0.19)g/L、PFY-G1 菌株(3.27±0.22)g/L、PFY-Z1 菌株(4.14±0.11)g/L(p<0.05)。包怡红等从自然界中筛选获得1株可以产EPS的东方伊萨酵母(Issatchenkia orientalis)Z20,EPS 产量为 1.137 g/L[28]。孙晓萌等从海参肠道中分离分离出可产EPS的C.guilliermind HS-J9,EPS产量为0.137 g/L[8]。与上述研究相比,本研究分离得到的酵母菌产糖能力相对较强。因此,选择PFY-Z1菌株为出发菌株进行后续试验。
2.2 菌株形态观察
菌株PFY-Z1在YPD、WL固体培养基上生长形态见图1。

图1 菌株PFY-Z1在YPD、WL平板上的菌落形态Fig.1 Colony morphology of strain PFY-Z1 on YPD and WL agar plate
在YPD平板上培养前3 d与其它酵母菌株无明显区别,但不随着培养时间延长而改变颜色,观察单菌落形态为表面凸起、有褶皱、不透明、圆形、边缘锯齿状。该菌落形态与李侨飞在葡萄园采集样品中分离得到的S.pararoseus Y16形态一致[29]。在WL平板上,培养初期单菌落表面有褶皱、圆形、边缘锯齿状,培养4 d后表面褶皱逐渐消失,表面光滑。
显微镜观察结果见图2,细胞呈椭圆形,与一般酵母相似,表现出明显的出芽生殖。
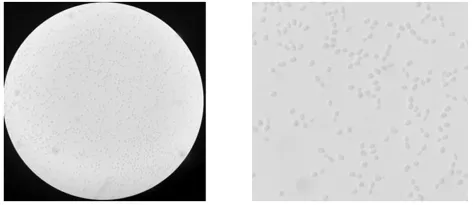
图2 菌株PFY-Z1显微形态观察(640×)Fig.2 The microscopic morphology of strain PFY-Z1(640×)
2.3 生理生化鉴定
参考《常见与常用真菌》[22]及《酵母菌的特征与鉴定手册》[10],对菌株PFY-Z1的部分生理生化性质进行了研究,结果见表3。菌株PFY-Z1在28℃培养时生长良好,可利用碳源种类较少,氮源利用率相对较好,生长无运动性,尿素酶为阳性。
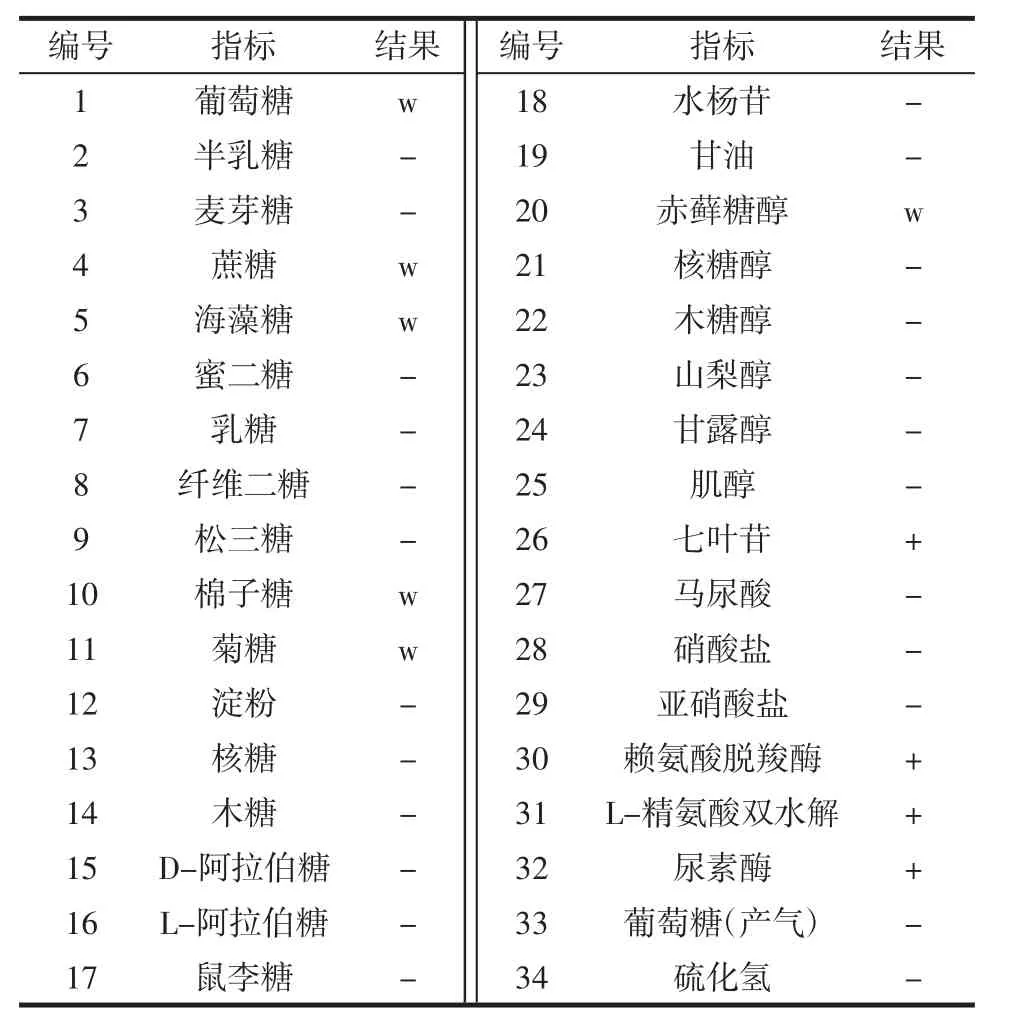
表3 菌株PFY-Z1的部分生理生化特性Table 3 Physiological and biochemical results of the strain PFY-Z1
2.4 18S rDNA序列分析和系统发育树构建
提取菌株PFY-Z1的基因组DNA,PCR反应扩增菌株的18S rDNA序列,扩增产物经琼脂糖凝胶电泳后,在1 300 bp处获得清晰条带,结果见图3。
PCR产物送上海生工生物工程有限公司进行测序,将测序结果与GenBank公布的数据库进行比对,通过比对发现该菌株与S.pararoseus相似度极高,同源性>99%,结果上传到NCBI数据库,获得GeneBank登录号为MN956988。
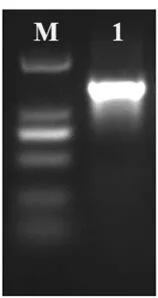
图3 菌株PFY-Z1的18S rDNA PCR扩增结果Fig.3 Electrophoregram of 18S rDNA amplification products of PFY-Z1
应用Mega5.0软件中的Neighbor-Joining法构建系统发育树,将菌株PFY-Z1与25株菌的核酸序列进行比对,按比例绘制系统发育树,见图4。因此将该菌株命名为S.pararoseus PFY-Z1。
2.5 PB试验
微生物发酵产EPS不仅受自身性质影响,培养及成份和初始pH值对其EPS产量也具有显著影响[30]。微生物只有在特定的条件下才能产生EPS,并且不同的条件会产生不同种类的EPS[31]。因此,本试验在对菌株PFY-Z1产EPS单因素试验基础上,设计PB试验,确定对菌株PFY-Z1产EPS具有显著影响的因素。试验设计及结果见表4,回归分析结果见表5。

图4 Neighbor-Joining法构建菌株PFY-Z1的18S rDNA系统发育树Fig.4 Phylogenetic tree of strain PFY-Z1 18S rDNA base on using Neighbor-Joining method

表4 PB试验设计及统计结果Table 4 Experimental design and results of the PB design
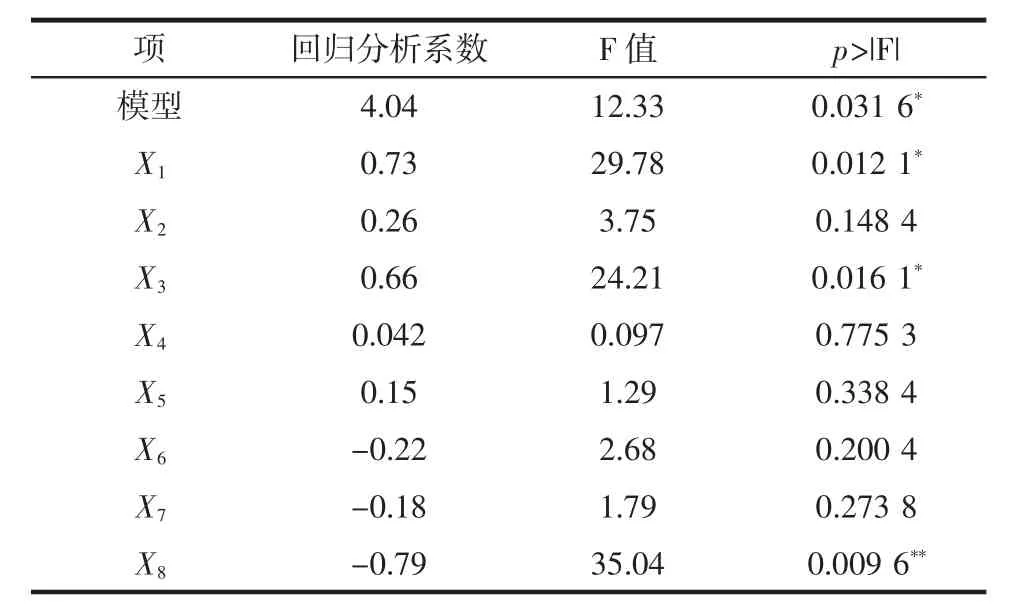
表5 PB试验回归分析结果Table 5 Results of the regression analysis of the PB design
由表4可知,EPS产量从(2.49±0.11)g/L升到(6.74±0.18)g/L,说明培养基成分对发酵菌株产EPS有很大影响。根据PB试验结果,得到模型拟合方程如下:EPS含量=4.04+0.73X1+0.26X2+0.66X3+0.042X4+0.15X5-0.22X6-0.18X7-0.79X8。
由表5可知,模型F值为12.33,两水平析因试验模型项显著(p=0.031 6<0.05),表明该模型具有重要意义,R2=0.970 5,说明存在97.05%的试验数据可用该模型解释,调整 R2=0.891 8,信噪比=10.465(>4),证明该模型可以很好的拟合试验数据。由p值可用于判断各变量对EPS影响的显著性可知,各变量对EPS影响显著程度依次为 X8>X1>X3>X2>X6>X7>X5>X4,即葡萄糖(X1)对菌株PFY-Z1的EPS产量影响显著(p=0.012 1<0.05),具有正效应;硫酸镁(X3)对菌株 PFY-Z1 的 EPS产量影响显著(p=0.016 1<0.05),具有正效应;初始pH值对EPS产量影响极显著(p=0.009 6<0.01),具有负效应。其他变量在PB试验条件下对菌株的EPS产量无显著影响,因此选择葡萄糖、硫酸镁、初始pH值3个因素进行CCD试验。碳源是影响微生物产EPS的重要因素,添加碳源的含量直接影响EPS的含量[32]。包怡红等通过对I.orientalis Z20产糖培养基优化发现,乳糖和蔗糖基本不被利用合成EPS,果糖和葡萄糖相比,葡萄糖有利于EPS,对葡萄糖添加量进行优化后,结果显示,添加8%葡萄糖时,EPS产量最大为2.046 g/L[28]。韩梅等的研究显示,S.pararoseus JD-2产EPS的氮源中(NH4)2SO4最有利于EPS积累[33]。杨迎凤等研究发现,Mg2+对EPS的产量有促进作用,当添加0.01%的MgSO4时,酵母菌YF-01的EPS产量为4.672 g/L[34]。马文锦的研究显示,当MgSO4含量为0.1%时,R.mucilaginosa CICC33013的EPS产量为6.2 g/L[9]。赵英杰等[35]、包怡红等[28]、杨迎凤等[34]、韩梅等[17]的研究均显示初始pH值在5~6范围时,最有利于酵母菌产EPS,与本试验结果相一致。
2.6 CCD试验
菌株PFY-Z1产EPS含量CCD试验结果见表6,回归分析见表7。
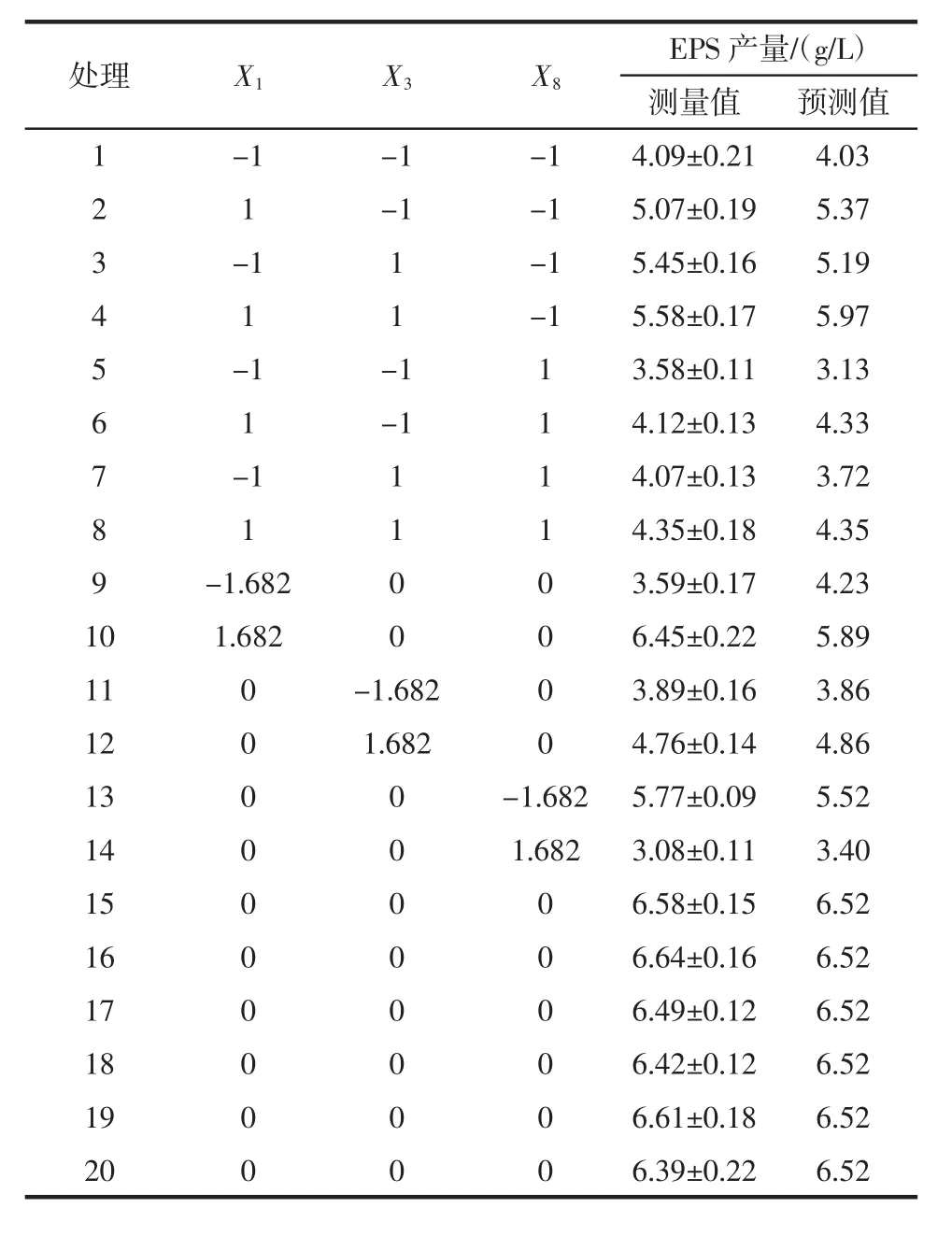
表6 CCD试验设计及结果Table 6 Experimentaldesign and results of the CCD

表7 CCD试验回归分析结果Table 7 Results of the regression analysis of the CCD
由表6和表7可知,CCD试验模型项极显著(p<0.000 1),R2=0.942 9,说明存在94.29%的试验数据可用该模型解释,调整 R2=0.891 4,信噪比=11.84(>4),变异系数CV=7.85%,表明试验结果所得模型能够较好的拟合试验数据。葡萄糖含量(X1)和初始pH值(X8)及各变量二次项(X12、X32、X82)对菌株的 EPS 产量有极显著影响(p<0.01),硫酸镁含量(X3)对菌株 EPS 产量有显著影响(p<0.05),X1X3、X1X8、X3X8对菌株的 EPS产量无显著影响(p>0.05)。各变量间的相互作用对菌株EPS产量影响见图5~图7。
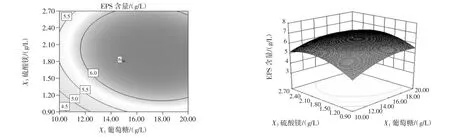
图5 葡萄糖和硫酸镁对菌株产糖影响的等高线图和曲面图Fig.5 The contour plot and surface response of EPS yield vs glucose and MgSO4
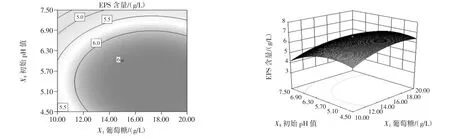
图6 葡萄糖和pH值对菌株产糖影响的高线图和等曲面图Fig.6 The contour plot and surface response of EPS yield vs glucose and pH

图7 硫酸镁和pH值对菌株产糖影响的等高线图和曲面图Fig.7 The contour plot and surface response of EPS yield vs MgSO4and pH
根据CCD试验结果,得到模型拟合方程如下:EPS含量=6.52+0.49X1+0.3X3-0.63X8-0.14X1X3-0.036X1X8-0.14X3X8-0.52X12-0.76X32-0.73X82。模型方程中二次项系数均为负,可知该方程拟合的曲面开口朝下,方程有极大值。预测葡萄糖糖含量、硫酸镁含量和初始pH值分别为17.34、1.98 g/L和5.3时,方程有极大值,EPS的预测产量为6.81 g/L。
变量间的相互作用关系可从等高线图和曲面图形状看出,椭圆形表明变量间的相互作用有显著影响,圆形则表明无显著影响。由图5可知,当初始pH值为6时,葡萄糖和硫酸镁的交互作用对EPS的合成影响不显著;以葡萄糖含量为定值,随硫酸镁含量的增加,EPS产量先增加再减少,硫酸镁含量在接近1.8 g/L时,EPS含量最高,以硫酸镁含量为定值,EPS含量随葡萄糖含量的增加呈现先上升后趋于缓慢下降趋势,葡萄糖含量在16 g/L~18 g/L时,EPS含量最高。由图6可知,当硫酸镁为1.8 g/L时,葡萄糖和初始pH值的交互作用对EPS的合成影响不显著。由图7可知,当葡萄糖为15 g/L时,初始pH值和硫酸镁的交互作用对EPS的合成影响不显著,以硫酸镁为定值,EPS的产量随pH值的升高而降低。
2.7 验证试验
使用中心组合试验中预测最佳产EPS试验点进行验证试验,在此条件下,菌株PFY-Z1的EPS含量为(6.74±0.13)g/L,与预测值6.81 g/L无显著差异(p>0.05)。响应面法优化后,菌株PFY-Z1产EPS水平是优化前(4.14±0.11 g/L)的1.63倍。赵英杰等从乳扇中获得9株产EPS能力较好的酵母菌株,其中金黄色隐球酵母(Cryptococcus aureus)DF-12产EPS能力最强,优化后EPS含量为3.511 g/L[35]。PAVLOVA等从南极分离出4株产糖酵母,在以葡萄糖为碳源的培养基中EPS产量为1.75 g/L~2.63 g/L[36],优化后罗伦隐球菌(Cryptococcus laurentii)AL100在发酵96 h的时候可以产生6.4g/L的EPS[37]。与此相比,本试验获得S.pararoseus PFY-Z1不仅自身EPS产量相对较高,而且优化后EPS产量也高于目前所报道的大部分菌株。
3 结论
本试验从葡萄园土壤中分离得到一株高产EPS的酵母菌,经形态学鉴定、生理生化试验和分子生物学试验鉴定该菌株为S.pararoseus,并命名为S.pararoseus PFY-Z1。以该菌株为出发菌株,采用响应面方法优化菌株产EPS条件。首先,两水平析因试验设计结果表明,葡萄糖、硫酸镁和无初始pH值对S.pararoseus PFY-Z1产EPS有显著影响。CCD试验表明葡糖糖含量、硫酸镁含量和初始pH值分别为17.34 g/L、1.98 g/L 和 5.3时,EPS的产量最高为(6.74±0.13)g/L,是优化前(4.14±0.11 g/L)的1.63倍。因此,利用S.pararoseus PFY-Z1发酵产EPS,不仅为EPS的生产提供了菌种来源,也为今后利用S.pararoseus大规模生产EPS提供了理论基础。
