齐墩果酸A环衍生物的合成与体外抗肿瘤活性研究
2020-08-24孟艳秋
王 强, 孟艳秋
(沈阳化工大学 制药与生物工程学院, 辽宁 沈阳 110142)
齐墩果酸(oleanolic acid,OA)是一种五环三萜类化合物,在自然界中分布广泛,主要以游离或与糖结合成糖苷的形式存在.OA具有广泛的生物活性,如护肝、抗病毒、抗炎、抗糖尿病、抗肿瘤等[1-4].OA结构中可供修饰的位点有限,研究主要集中在A环、C环、C-3和C-28位,对其他位点进行改造的报道不多.目前,Honda等[5-6]发现了化合物1(化合物1~3的结构见图1)是OA研究领域的一个重大突破,其具有极强的抗肿瘤活性.化合物2和化合物3等均表现出显著增强的抗肿瘤活性,并且能够作用于细胞内多条信号转导通路,是迄今为止抗肿瘤活性最强的半合成三萜化合物[5-7].因此,化合物1的结构优化也成为当前的研究热点.WIEMANN等[8]对OA的C-3位羟基和C-28位羧基进行了结构修饰,合成的氧肟酸衍生物较OA抗肿瘤活性有了显著增强.另有研究发现[9-11],将C-28位羧基改造成酯或酰胺,对提高OA的抗肿瘤活性有利.
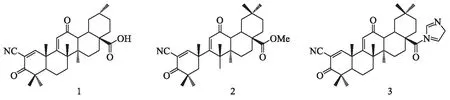
图1 化合物1~3的结构
本文结合前期OA结构改造的经验[12-13],将A环C-2,3位改造成酮肟基,形成新型A环结构,同时C-28位羧基进行成酯或酰胺化,设计合成了两类共10个新型OA衍生物.合成路线见图2.
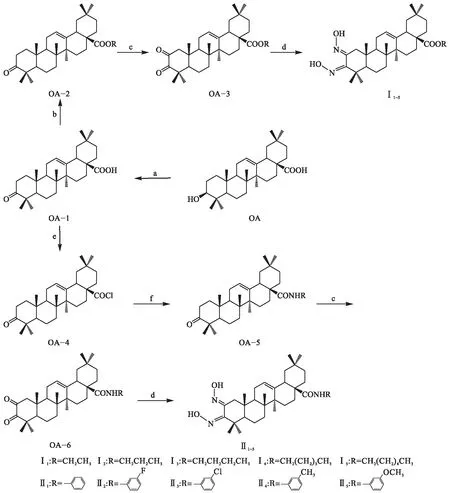
试剂和条件:a 丙酮,琼斯试剂,室温 b 二甲基甲酰胺,无水碳酸钾,溴代烷 c 叔丁醇,叔丁醇钾,50 ℃ d 盐酸羟胺,无水吡啶 e 二氯甲烷,草酰氯,二甲基甲酰胺,室温 f 苯酰胺,三乙胺,室温
1 实验部分
1.1 化学合成
1.1.1 3-氧代-齐墩果烷型-12-烯-28-羧酸的制备(OA-1)
OA(0.500 g,1.10 mmol) 溶解于50 mL丙酮溶液中,冰浴条件下缓慢滴加配制的新鲜Jones 试剂(0.64 mL,5.78 mmol),常温反应2 h后,加入异丙醇(15 mL),常温反应0.5 h.水洗,无水硫酸镁干燥,减压抽滤,蒸发溶剂.粗品分离纯化[V(石油醚)/V(乙酸乙酯)=20/1],得白色固体OA-1(0.470 g,质量分数为95 %).
中间体OA-1(0.470 g,1.05 mmol) 溶解于DMF(20 mL),加入碳酸钾(0.3g) 和溴乙烷[n(OA-1)∶n(溴乙烷)=1∶5],常温反应5 h.过滤,水洗,无水硫酸镁干燥,减压抽滤,蒸发溶剂.粗品分离纯化[V(石油醚)/V(乙酸乙酯)=50/1],得白色固体OA-2(0.380 g,质量分数为76 %).
1.1.3 2,3-二氧代-齐墩果烷型-12-烯-28-羧酸乙酯的制备(OA-3)
化合物OA-2(0.380 g,0.79 mmol) 溶解于叔丁醇(30 mL),加入叔丁醇钾(25 mg,2.22 mmol) 和四氢呋喃(3 mL),50 ℃水浴反应6 h.蒸发去除溶剂,先用盐酸进行酸洗,再用食盐水进行水洗,无水硫酸镁干燥,减压抽滤,蒸发溶剂.粗品分离纯化[V(石油醚)/V(乙酸乙酯)=50/1],得白色固体OA-3(0.440 g,质量分数为89 %).
1.1.4 2,3-二酮肟-齐墩果烷型-12-烯-28-羧酸乙酯的制备(Ⅰ1)
化合物OA-3(0.440 g,0.70 mmol) 溶解于无水吡啶(20 mL),加入盐酸羟胺(0.9 g,13.00 mmol),120 ℃油浴回流1 h.冷却到室温时,有白色固体析出,然后过滤、干燥.粗品分离纯化[V(石油醚)/V(乙酸乙酯)=20/1],得白色固体Ⅰ1(0.320 g,质量分数为86 %).
制备化合物Ⅰ2~Ⅰ5时替换为不同的卤代烷,按上述方法操作.
1.1.5 3-氧代-齐墩果烷型-12-烯-28-酰氯的制备(OA-4)
中间体OA-1(0.470 g,1.05 mmol) 溶解于二氯甲烷(25 mL),加入草酰氯(0.85 mL,1 mmol)和DMF(20 mL),常温反应4 h.蒸发去除溶剂,加入适量环己烷移除残余草酰氯,减压脱溶,得淡黄色固体OA-4(0.370 g,质量分数为74 %),直接进入下一步反应.
利用CPTU实测资料来估算土层重度,Larsson和Mulabdic(1991)通过对在瑞士、挪威和英国的试验资料的分析,提出采用净锥尖阻力(qt-σvo)和孔压参数比Bq对土的密度或重度进行估计。
1.1.6 3-氧代-齐墩果烷型-12-烯-28-酰-苯胺的制备(OA-5)
化合物OA-4(0.370 g,0.76 mmol) 溶解于二氯甲烷中,加入苯酰胺[n(OA-4)∶n(苯酰胺)=1∶1.2]和三乙胺(TEA,0.6 mL),常温下反应过夜,蒸发去除溶剂.粗品经硅胶柱色谱分离、纯化[V(石油醚)/V(乙酸乙酯)=60/1],得淡黄色固体OA-5(0.280 g,质量分数为69 %).
1.1.7 2,3-二氧代-齐墩果烷型-12-烯-28-酰-苯胺的制备(OA-6)
化合物OA-5(0.280 g,0.55 mmol) 溶解于叔丁醇(30 mL),加入叔丁醇钾(25 mg,2.22 mmol) 和四氢呋喃(3 mL),50 ℃水浴反应6 h.蒸发去除溶剂,加入适量乙酸乙酯溶液溶解,先用盐酸进行酸洗,再用食盐水进行冲洗,最后用无水硫酸镁干燥、过滤、蒸发去除溶剂.粗品经硅胶柱色谱分离、纯化[V(石油醚)/V(乙酸乙酯)=60/1],得淡黄色固体OA-6(0.240 g,质量分数为85 %).
1.1.8 2,3-二酮肟-齐墩果烷型-12-烯-28-酰-苯胺的制备(Ⅱ1)
化合物OA-6(0.240 g,0.40 mmol) 溶解于无水吡啶中(20 mL),加入盐酸羟胺(0.6 g,8.63 mmol),120 ℃油浴回流1 h.冷却到室温时,有白色固体析出,然后过滤、干燥.粗品经硅胶柱色谱分离、纯化[V(石油醚)/V(乙酸乙酯)=20/1],得淡黄色固体Ⅱ1(0.200 g,质量分数为84 %).
制备化合物 Ⅱ2~Ⅱ5时替换为不同的胺类,按上述方法操作.
1.2 初步体外活性测试
以吉非替尼和阿霉素为阳性对照物,采用MTT法对合成的目标化合物进行体外抗肿瘤活性测试.选用人胃癌SGC7901和人肺癌A549细胞为靶细胞.在96孔培养板内培养对数生长期的肿瘤细胞,每100 μL约4 000个细胞.将其置于37 ℃、体积分数为5 %的CO2全湿条件培养24 h.将含有不同浓度的合成的10个新型衍生物加入到给药组,设置3个平行孔.阴性对照组加有等体积的溶剂(无血清的RPMI-1640培养基),并设只加RPMI-1640培养基的空白对照组,置37 ℃、体积分数为5 %的CO2温箱中培养72 h,丢弃培养液,每孔加入MTT溶液50 μL,37 ℃ 下孵育4 h,丢弃上清液,每孔加入 DMSO 150 μL,轻度振荡溶解甲臜颗粒.在酶标仪波长490 nm条件下测定光密度值(OD),计算所测化合物对肿瘤细胞的抑制率和IC50值.实验重复3次,结果取平均值.
2 结果与讨论
2.1 目标化合物的确证
目标化合物结构经1H-NMR、MS等确证,数据见表1和表2.
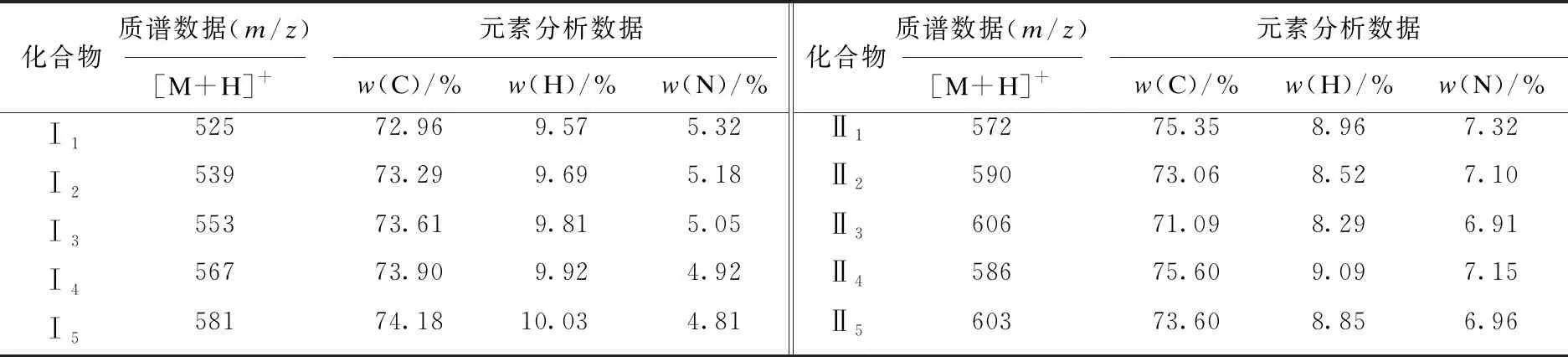
表1 目标化合物的质谱和元素分析数据

表2 目标化合物的氢谱数据
所有目标化合物结构经1H-NMR、MS等确证,为10个未见报道的新型齐墩果酸衍生物.
2.2 生物活性评价
采用MTT法对目标化合物进行初步的体外抗肿瘤活性测试.选用吉非替尼和多柔比星为阳性对照物,人胃癌细胞SGC7901和人肺癌细胞A549为靶细胞,实验结果见表3.
由表3中分析可知:在一定浓度下目标化合物对SGC7901、A549均具有一定抑制作用,且活性强于母体OA.C-28位羧基成酯时,活性整体呈上升趋势,表明随着酯链的延长活性更佳;C-28位羧基成酰胺时,活性普遍强于成酯类;其中化合物Ⅱ5表现出良好的抗肿瘤活性,IC50值分别为10.76和13.28,与吉非替尼活性相当,可进一步研究.
3 结 论
以OA为先导化合物,对A环及C-28位羧基进行结构改造,设计合成了两类新型OA衍生物.经体外药理活性测试,C-28位羧基成酯或成酰胺,均能显著提高抗肿瘤活性,表明OA的活性位点主要来自于A环,这与Honda等发现化合物1的观点一致,说明对A环的结构改造至关重要.同时化合物Ⅱ5表现出较强的抑制活性,可能与苯环上带有吸电子基团有关,说明在C-28位连接带有强吸电子基团的结构更能提高抗肿瘤的活性,这也是本文的下一步研究方向.综上所述,本研究结果对进一步OA结构修饰有一定的参考意义.
