中药有效成分纳米制剂抗肿瘤的研究进展*
2020-08-23周世月邵莹莹张湘兰于海洋
周世月,邵莹莹,李 媛,杜 博,张湘兰,于海洋
(1.天津中医药大学中医药研究院,天津 301617;2.天津中医药大学图书馆,天津 301617;3.中国医学科学院北京协和医学院生物医学工程研究所,天津市生物医学材料重点实验室,天津 300192;4.西北核技术研究院,西安 710613)
据2019年发布肿瘤统计数据,全国恶性肿瘤的发病率增加了3.9%、病死率增加了2.5%,成为了仅次于心脏病的第二号杀手[1-2]。癌症的常规治疗方法包括化疗、放疗等[3],并且常伴有严重的毒副作用[4],这促使科学家们寻找更新的替代疗法[5],近年来,中药有效成分的抗癌效果得到了广泛的关注[6-11]。中药有效成分毒性小、抗肿瘤效果明显,但具有靶向性差[12]、水溶性低[13-14]、分布广[15]、消除速度快等[16]缺点,因此将中药有效成分进行剂型的改造。随着脂质体[17]、胶束[18]、纳米粒[19]、纳米凝胶[20]、纳米囊[21]等新剂型的出现(见图1),提高了中药有效成分的生物利用度和靶向性,能更好的应用于肿瘤的治疗。
1 中药有效成分抗肿瘤的纳米剂型
1.1 脂质体 脂质体是由一个或多个磷脂双层膜包裹药物组成的球形囊泡[22]。脂质体具有安全性、生物降解性、制备方法简单、高效低毒等优点,是目前研究最多的纳米剂型之一。
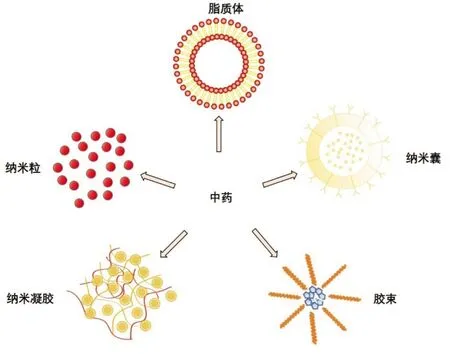
图1 文献中发现的用于癌症的中药纳米制剂
Steffes等[23]研究了用PEG修饰的紫杉醇阳离子纳米脂质体(PEG-CLPTX NPs)对于前列腺癌PC3细胞和黑色素瘤M21细胞体外抗肿瘤活性的影响。据研究报道,脂质体通过修饰聚乙二醇(PEG)来延长了体内血液的循环时间。在肿瘤细胞治疗72h后,发现PEG-CLPTX NPs表现出较低的IC50值[(20.5±0.3)nmol/L],说明与游离紫杉醇[(32±1)nmol/L]相比有更好抑制肿瘤细胞增殖的作用。
徐炳欣等[24]研究了葫芦素B固体脂质纳米粒和葫芦素B游离药对人神经母细胞SK-N-SH细胞形态变化、增殖及周期的影响,发现葫芦素 B固体脂质纳米粒能更好地以剂量依赖的方式抑制细胞增殖作用和影响细胞形态,尤其是在低浓度(≤3.58 μmol/L)时效果更佳。同时,葫芦素B固体脂质纳米粒能使SK-N-SH细胞阻滞于G2/M期,从而达到抗肿瘤的效果。
1.2 胶束 纳米胶束是由两亲性分子在一定条件下自组装形成的纳米粒子。纳米胶束具有独特的核-壳结构,可以作为药物传递的载体来溶解胶束核内的疏水性药物,从而改善了难溶于水的药物的溶解度,延长其体内的循环时间,并具有良好的生物相容性[25]。
Ding等[26]采用薄膜分散法制备了粒径61.9 nm、Zeta电位为(-1.16±1.06)mV、包封率为 90.9%、载药量为4.67%的胡椒碱纳米胶束。体外研究表明,胡椒碱纳米胶束与游离胡椒碱相比具有持续释放的特点。在抑制HepG2增殖实验中,胡椒碱纳米胶束的 IC50为(1.21±0.58)μg/mL,游离胡椒碱的 IC50为(4.2±0.86)μg/mL,说明胡椒碱纳米胶束比游离胡椒碱有更强的肿瘤细胞杀伤能力。在细胞摄取实验中,观察到在1、3、6 h HepG2细胞对胡椒碱纳米胶束摄取量明显高于游离胡椒碱。药代动力学研究表明,胡椒碱纳米胶束的药时曲线下面积(AUC)是游离胡椒碱的2倍。说明胡椒碱纳米胶束比游离胡椒碱有更好的抗肿瘤效果。
1.3 纳米凝胶 纳米凝胶由亲水性或两亲性高分子自组装形成的网络结构的聚合物凝胶[27]。纳米凝胶是一种很有开发前景的载体,因为它们具有亲水性、可变型性、稳定性、生物相容性和与软组织纹理非常相似类等特点。
Duan等[28]制备了粒径为99.6 nm的冬凌草甲素纳米凝胶,通过噻唑蓝(MTT)检测法表明冬凌草甲素纳米凝胶和冬凌草甲素溶液对细胞抑制活性均随药物浓度的增加而增加,而冬凌草甲素纳米凝胶对肝癌HepG2细胞有更好的抑制作用。除此之外,与冬凌草甲素溶液相比,在相同的pH值下冬凌草甲素纳米凝胶能使HepG2细胞发生明显的损伤。MTT实验和细胞形态学分析表明,冬凌草甲素纳米凝胶能增强抗肿瘤活性。
1.4 纳米囊 纳米囊是由高分子薄膜聚合物膜将药物包裹成粒径较小的微胶状的粒子。纳米囊具有亲脂性药物在其油性核内的高结合效率和药物的持续释放等优点。
Abdelmoneem等[29]制备了甘草次酸(GA)或乳酸(LA)修饰的乳铁蛋白纳米囊(LF-NCS),用于联合输送索拉菲尼(SFB)和槲皮素(QRC)两种疏水抗癌药物,实现双靶标靶向治疗肝癌细胞。与游离的索拉菲尼和槲皮素(SFB+QRC)(IC50=25.10 μmol/L)相比,GA/LF-NCS(IC50=14.69 μmol/L)和 LA/LF-NCS(IC50=11.82 μmol/L)能更好的抑制细胞增殖,提高细胞对药物的吸收。体内实验表明,LA/LF-NCS抑制了二乙基亚酰胺(DEN)诱导的肿瘤坏死因子-α(TNF-α)、血管内皮生长因子(VEGF)、核转录因子κB(NF-κB)和肿瘤增殖抗原(Ki-67)蛋白的表达,并促进了凋亡蛋白半胱氨酸-天冬氨酸蛋白水解酶-3(Caspase-3)蛋白的表达,从而抑制了肝癌的发展。
1.5 无载体纳米粒子 无载体纳米粒子由纯药物分子自组装而成的。其具有合成方法简单、载药量高、生物利用度高等优点,避免了生物载体带来的不安全因素。
Zhao等[30]将 10-羟基喜树碱(HCPT)和阿霉素(DOX)自组装成纳米粒子。HD NPs作为一种双药纳米制剂,有效增强了耐药癌细胞的细胞毒性。HCPT和DOX的联合作用显示出协同作用,并且改善了耐药癌MCF-7R细胞P-糖蛋白(P-gp)外流的药物滞留。此外,克隆形成实验抑制肿瘤细胞的增殖,这些实验证实了HD NPs比游离药物有更好的抗肿瘤作用。
2 中药有效成分纳米制剂对肿瘤的靶向治疗
2.1 被动靶向 被动靶向是药物利用载体通过正常的生理功能运送到特定的组织、器官,从而发挥药效的靶向方式。正常血管的结构完整性好,可以防止颗粒大的药物渗出血管,而肿瘤发生的病理生理表现为肿瘤血管渗漏、淋巴循环障碍及肿瘤微环境的相互作用,从而影响肿瘤的通透性和滞留效应(EPR),使药物聚集在肿瘤部位并发挥作用。Zhang等[31]合成了粒径为39 nm、Zeta电位为-32.5 mV的白藜芦醇金纳米粒子(Res-GNPs),通过采用噻唑蓝(MTT),蛋白质免疫印迹(Western blot)等实验方法,检测了Res-GNPs对肝癌细胞凋亡的影响。与游离白藜芦醇(Res)相比,Res-GNPs能更好的抑制细胞的增殖。通过下调半胱氨酸-天冬氨酸蛋白酶Caspase-9、Caspase-3、磷脂酰肌醇 3-激酶(PI3K)和蛋白激酶B(Akt),上调Caspase-8和Bcl-2相关X蛋白(Bax)蛋白的表达量,说明Res-GNPs是通过PI3K/Akt信号通路调节细胞的凋亡。体内实验表明,Res-GNPs可显著抑制肿瘤生长,促进肿瘤凋亡,苏木精-伊红(HE)染色显示Res-GNPs对心脏、肝脏、肾脏和脾脏无明显毒性,而肿瘤坏死区域明显增加。结果显示,Res-GNPs比游离白藜芦醇能更好的抑制肿瘤的增长。
2.2 主动靶向 主动靶向制剂是将纳米粒子表面修饰配体或单克隆抗体等,使药物主动富集在肿瘤部位。主动靶向治疗不仅能有效促进肿瘤周围纳米粒子的富集,且不依赖于EPR效应,还能增强纳米粒子跨越肠黏膜或血脑屏障等生理屏障的能力。据研究显示,与正常细胞相比,肿瘤细胞或组织表面会过度表达某些受体和抗原,如叶酸受体、表皮生长因子受体、转铁蛋白受体等,从而有利于纳米粒子的主动靶向。
2.2.1 叶酸受体 Soe等[32]研究了叶酸(FA)修饰的纳米粒子用于传递雷公藤红素(CS)和伊立替康(Ir)两种药物进行肿瘤的靶向治疗。研究表明,相同药物剂量下,在叶酸高表达的乳腺癌MCF-7、MDAMB-231细胞中,雷公藤红素、伊立替康两、雷公藤红素/伊立替康纳米粒子(CS/IR NPs)、雷公藤红素/伊立替康叶酸纳米粒子(CS/IR-FA NPs)均能抑制细胞的增殖,然而CS/Ir-FA NPs组抑制效果最为显著。在缺少叶酸表达的A549细胞系中,CS/Ir-FA NPs组与CS/Ir NPs组表现出相似的细胞毒性。同时研究表明,MCF-7、MDA-MB-231细胞与 A549细胞相比对Cs/Ir-FA NPs的摄取量显著增高。体内实验表明,肿瘤体积、血管生成标志物(CD31)的蛋白量和细胞增殖标志物(Ki-67)显著减少,凋亡蛋白Caspase-3和聚腺苷酸二磷酸核糖基聚合酶(PARP)蛋白表达增加,表明CS/Ir-FA NPs增强了抗肿瘤的活性。因此,通过体内外实验研究表明CS/Ir-FA NPs主动靶向肿瘤从而抑制了乳腺癌的发生发展。
2.2.2 表皮生长因子受体 Li等[33]制备了靶向表皮生长因子受体(EGFR)的靶向吴茱萸氨基酸纳米颗粒(GE11-Evo-NPs)。结果表明,与游离吴茱萸(Evodiamine)相比,GE11-Evo-NPs对结肠癌细胞的抑制作用显著增强,通过下调EGFR、VEGF、基质金属蛋白酶(MMP)蛋白的表达,能有效抑制结直肠癌LOVO细胞的转移。此外,体内研究表明,GE11-Evo-NPs在抑制BALB-c小鼠结直肠癌的侵袭转移、肿瘤体积方面比吴茱萸碱、Evo-NPs表现出更强的抑制作用,从而延长了小鼠的生存时间。
2.2.3 转铁蛋白受体 Song等[34]制备了转运蛋白(TF)修饰的粒径为 100 nm、多分散指数(PDI)≤0.2,Zeta电位为(4.47±0.02)mV 的转铁蛋白(TF)修饰的长春新碱和粉防己碱脂质体。体外研究表明,TF修饰长春新碱和粉防己碱脂质体在体外释放率(≤26%)高于长春新碱脂质体(≤20%)及粉防己碱脂质体(≤20%),同时TF修饰的长春新碱和粉防己碱脂质体通过下调PI3K和MMP-2蛋白的表达,上调Caspase蛋白的表达来抑制胶质瘤C6细胞和胶质瘤耐药C6/ADR细胞的增殖、血管的形成和细胞迁移的面积,并且效果较长春新碱脂质体和粉防己碱脂质体明显。同时研究表明TF修饰长春新碱和粉防己碱脂质体通过抑制过表达的P-gp蛋白对C6/ADR细胞产生了明显的抑制作用;体内小鼠研究表明,TF修饰的长春新碱加粉防己碱脂质体可明显聚集于脑肿瘤部位,对携带胶质瘤的小鼠具有较强的抗癌作用,从而延长了小鼠的存活时间。
2.3 物理化学靶向 物理化学靶向是采用物理化学的方法,使药物运输至特定的位置(如肿瘤部位)并发挥药效。
2.3.1 磁性纳米粒 磁性纳米粒是一种低细胞毒性的生物相容性纳米材料,因其具有定位特性和缓释功能被广泛应用于靶向药物的载体。
Fang等[35]研究表明,藤黄酸呈剂量依赖性和时间依赖性抑制结直肠癌LOVO细胞的增殖,而其制备的藤黄酸Fe3O4的磁性纳米颗粒(GA-MNPs-Fe3O4)抑制效果更为显著。与藤黄酸组相比,GAMNPS-Fe3O4处理后,明显观察到LOVO细胞凋亡的形态学特征,同时细胞色素C、Caspase 9和Caspase 3的蛋白的表达升高,而 p-PI3K、p-Akt、p-Bad、pro-Caspase 9、pro-Caspase 3 的蛋白表达均下降,表明含Fe3O4的磁性纳米粒可显著促进细胞凋亡,这可能与调控人结肠癌治疗中PI3K/Akt/Bad通路密切相关。
2.3.2 pH敏感纳米粒子 pH敏感纳米粒子依据肿瘤组织与正常组织所在的pH环境不同,在特定部位由pH不同触发的药物递送。
Yu等[36]评价了两亲性甲氧基聚(乙二醇)-聚(丙交酯)-聚(β-氨基酯)-1,4丁二醇-二丙烯酸二乙二醇酯姜黄素纳米粒子(CUR/MPEG-PLA-PA1)和两亲性甲氧基聚(乙二醇)-聚(丙交酯)-聚(β-氨基酯)姜黄素纳米粒子(CUR/MPEG-PLA)的细胞活力、药物释放、粒径大小和细胞摄取等特征。结果显示,CUR/MPEG-PLA-PA1(IC50=298.5mg/mL)表现出更低的 IC50值,与 CUR/MPEG-PLA(IC50=100.3 mg/mL)相比有更强的细胞毒性。CUR/MPEG-PLA-PA1随pH的降低释放率增高,而CUR/MPEG-PLA释放率几乎保持不变。与CUR/MPEG-PLA(17.1~25.5)nm相比,CUR/MPEG-PLA-PA1有较大的粒径(128.4~171.0)nm,能延长在血液中循环,当遇到酸性环境时,粒径减小至30 nm,提高了肿瘤的渗透,增加了肿瘤细胞的吸收,有效地抑制肿瘤细胞的增殖。同时体内研究表明,CUR/MPEG-PLA-PA1确实能延长体内的循环时间并特异性靶向肿瘤,能更好的抑制肿瘤的增长。
Duan G等[37]研究了合成了3个半乳糖化程度不同的冬凌草甲素纳米凝胶(ORI),在不同的pH值下测定了ORI的体外释放行为,研究了不同pH条件下HepG2和MCF-7细胞的生长情况和半乳糖修饰是否能增强半乳糖纳米凝胶的抗肿瘤效果。结果表明,纳米凝胶中冬凌草甲素的释放行为具有pH依赖性,在弱酸性条件下可以加速释放。同时冬凌草甲素纳米凝胶有较好体外抗肿瘤活性,冬凌草甲素负载纳米凝胶比未发生半乳糖化的药物负载纳米凝胶具有更高的抗肿瘤活性,且抗癌活性随着HepG2细胞中半乳糖分子数量的增加而增加。
2.3.3 光敏感纳米粒子 Wen等[38]通过自组装的方式将10-羟喜树碱(HCPT)和光敏剂二氢卟吩e6(Ce6)制备成粒径长为360 nm、宽为150 nm、Zeta电位为-33 mV且具有化学-光动力的双重纳米粒子(HCPT/Ce6 NRs)。在没有激光(Laster)照射下,HCPT/Ce6 NRs对乳腺癌4T1、MCF-7细胞和肺癌A549细胞的抗增殖作用与游离HCPT相似,而在有激光照射的情况下,HCPT/Ce6 NRs明显抑制了肿瘤细胞的增殖。荧光成像系统实验表明,HCPT/Ce6 NRs在体内分布良好,随着时间推移,HCPT/Ce6 NRs主要富集在肿瘤部位,能够明显抑制了小鼠体内肿瘤的增长;病理切片显示,与HCPT、Ce6+Laster相比,HCPT/Ce6 NRs+Laster组的肿瘤组织出现了严重的损伤。结果表明,HCPT/Ce6 NRs+Laster能明显抑制肿瘤的生长,并具有良好的应用前景。
3 中药有效成分纳米制剂抗肿瘤的临床实验
中药有效成分纳米颗粒一直受到医学领域科学研究者的广泛关注,Hersh等[39]旨在测定粒径为130 nm的白蛋白结合型紫杉醇(Abraxane)在局部复发或转移性黑色素瘤患者中的应用,并确定该药物的安全性和耐受性。这项研究(NCT00081042)对两组共37名患者进行了研究,每组患者都曾接受过化疗,先前治疗组的有效率为2.7%,而未接受化疗组的有效率为21.6%。中位无进展生存期(PFS)分别为3.5个月和4.5个月,中位生存期分别为12.1个月和9.6个月。白蛋白结合型紫杉醇被发现具有良好的耐受性,并且在先前治疗的患者和未接受化疗的患者中都表现出良好的活性。与达卡巴嗪治疗黑色素瘤相比,白蛋白结合型紫杉醇的应答率、PFS和生存率更好。KarEn Wong等评价了姜黄素纳米脂质体Ⅱ期临床试验(NCT0243985)对于结直肠癌的治疗。研究的对象为结直肠癌不可切除转移的患者,阿瓦斯丁联合叶酸、氟尿嘧啶、伊立替康化疗,每14 d治疗1次,口服姜黄素纳米脂质体给予100 mg剂量,每日两次,直至完成化疗。检测受试者2年的无进展生存时间,应答率、安全性、生活质量等也将作为次要结果进行评估。
4 “中药有效成分纳米制剂”抗肿瘤目前的局限性和研究难点
中药有效成分的纳米药物已经成为一种非常有前景的癌症治疗方式,并被证明比传统的中药更有优势。尽管纳米药物的应用和益处数不胜数,但同时也出现了许多的局限性和研究难点[40]。1)安全性:纳米制剂存在不稳定性、多分散性、反复给药的毒性等缺陷,需要在临床应用前加以解决。此外,制备过程中使用的有机溶剂不易去除,或未完全去除,使这些纳米制剂容易产生副作用。大多数靶向纳米制剂也需要静脉注射,以防口服给药后对表面修饰的损害。在纳米粒子被广泛应用与药物之前,纳米材料的毒性也应该被考虑,特别是无机纳米粒。2)大规模生产:目前纳米药物的生产大多是在实验室高度优化的条件下进行的,然而将纳米中药进行批量生产仍然是一个巨大的挑战。由于纳米药物的形状、大小、组成、电荷的不同,检测结果也有很大的不同。因此为了减少批量的变化,合成步骤必须简化。3)成本问题:由于中药有效成分纳米制剂尚处于起步阶段,需要投入大量的资金购买设备、聘请合格人员运营其生产设施以及维护设备和控制污染。4)质量控制:缺乏质量控制标准,无法保证中药有效成分纳米制剂的内在质量,不利于生产。
5 讨论
近年来,由于肿瘤发病率和病死率的增加,现有治疗手段已不能满足临床需求,迫切需要研究新的治疗方法更好地为治疗恶性肿瘤患者的治疗与预后提供有效帮助。文章综述了当前研究的许多中药有效成分不同剂型的纳米制剂,这些剂型都改善了中药本身溶解性低、吸收不好、新陈代谢快和生物利用度有限等问题,进一步通过控制释放、靶向给药、改善稳定性和增加细胞摄取来实现中药对肿瘤的靶向治疗,见表1。受安全性、大规模生产、成本消耗及质量控制有限性的影响,中药有效成分纳米制剂依然存在尚未攻克的研究难点。另一方面,这些中药有效成分的纳米制剂与肿瘤细胞之间的机制以及相互作用仍然是未知的,需要进一步探索。但中药有效成分纳米药物由于其生物尺寸和形状微小,不仅可以增加抗癌的效果,还可以保证药物的靶向和释放。而且当前众多体内外研究已经肯定了纳米药物对于不同遗传特征的肿瘤细胞有不同的抑制效果(见图2)。这些研究正不断推动中药有效成分纳米制剂的进一步发展,从而造福更多患者。但是针对中药有效成分纳米药物在肿瘤治疗中的应用还处于起步阶段,今后的研究还需要更多考虑到纳米药物制剂的安全性,同时综合肿瘤发生机制的复杂性,迎接中药有效成分纳米药物临床转化可能面临的诸多困难和挑战。
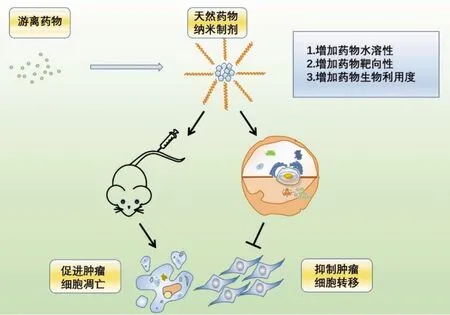
图2 中药纳米制剂作用机制

表1 中药有效成分抗肿瘤纳米剂型的典型实例
