咪唑离子液体用于反相色谱流动相添加剂分析苯甲酸和山梨酸
2020-08-21关福晶殷振杰万长长马亚杰
关福晶,殷振杰,万长长,马亚杰,于 泓
(哈尔滨师范大学 化学化工学院,黑龙江 哈尔滨 150025)
防腐剂作为一种食品添加剂,可有效减缓微生物繁殖引起的食品变质,使其保持原有品质。苯甲酸、山梨酸为食品添加剂中的一类防腐剂,在食品、饮品中被广泛使用[1-3],其用法及用量直接决定食品的品质。食品安全问题与人们的切身利益和健康密切相关。若食品添加剂的含量控制不当,长期过量食用苯甲酸钠会引起肝肾功能损伤、致癌、苯中毒的危害,对人体健康造成严重威胁[4-5]。由于人们对食品中苯甲酸、山梨酸的含量倍受关注,因此有必要发展检测苯甲酸和山梨酸的简单、快捷、精准的分析方法。
目前文献报道分析山梨酸和苯甲酸的常见方法有紫外分光光度法[6-7]、气相色谱或气相色谱-质谱联用法[8-9]、高效液相色谱或高效液相色谱-质谱联用法[10-12]、毛细管电泳法[13-14]等。这些方法仍在不断发展中。离子液体作为一种新型的绿色溶剂近年在化学领域得到广泛的应用[15-17]。在色谱分析领域,离子液体可以用作气相色谱与液相色谱的固定相[18-19],以及液相色谱流动相的添加剂等[20]。由于离子液体作为液相色谱流动相添加剂可有效改善分析物的保留、分离和检测,并且实验上易于实现,因而引起色谱研究者的关注,相关研究报道不断增多。目前,采用离子液体作为液相色谱流动相添加剂分析碱性有机化合物[21-22]、阴离子[23-24]、阳离子[25-26]等已有报道,但尚未见检测苯甲酸和山梨酸的研究报道。
本研究探索采用咪唑离子液体作为流动相添加剂,反相色谱法分析苯甲酸和山梨酸的可能性。其目的是发展分离和检测苯甲酸和山梨酸的新方法。考察了咪唑离子液体种类与浓度、甲醇浓度、紫外检测波长等因素对反相色谱法分离和检测苯甲酸和山梨酸的影响规律,并优化了色谱条件。建立了以咪唑离子液体为流动相添加剂的反相色谱-紫外检测苯甲酸和山梨酸的方法,并成功将方法应用于食品饮料的分析。
1 实验部分
1.1 试剂与仪器
苯甲酸(C6H5COOH,分析纯)、山梨酸(C6H8O2,分析纯)、甲醇(色谱纯),均购自北京百灵威科技有限公司;氯化1-乙基-3-甲基咪唑([EMIm][Cl])、氯化1-丁基-3-甲基咪唑([BMIm][Cl])、氯化1-己基-3-甲基咪唑([HMIm][Cl])离子液体,纯度均不小于99%,购自上海成捷化学有限公司。
1200 型高效液相色谱仪(美国 Agilent 公司),配有G1322A 型在线脱气机、G1311A 型四元泵、ALSG1329 型自动进样器、TCCG1316A 型色谱柱温箱、DADG1315D型二极管阵列检测器和 Revision B.04.01 色谱工作站;DOA-P504-BN 型无油真空泵(美国IDEX公司);Simplicity 型纯水系统(美国Millipore 公司)。
1.2 溶液的配制
1.2.1 标准溶液的配制分别取苯甲酸、山梨酸标准品适量,用超纯水(电阻率18.2 MΩ·cm)分别溶解后置于各自容量瓶中定容至100 mL,配制成质量浓度均为0.30 g/L的标准储备液,保存于冰箱冷藏室中。待用时,取5 mL标准储备液至50 mL容量瓶中,稀释成质量浓度为30.0 mg/L标准溶液。
1.2.2 流动相的配制和处理依据实验需要,用超纯水配制一定浓度的甲醇-离子液体流动相,经0.22 μm滤膜抽滤和真空脱气后备用。
1.3 色谱条件
采用Agilent公司ZORBAX ODS色谱柱(4.6 mm×250 mm,5 μm)进行分离;流动相为甲醇-0.2 mmol/L[BMIm][Cl]水溶液(40>∶60,体积比);紫外检测波长230 nm;流速1.0 mL/min;色谱柱温度35 ℃;进样体积20 μL。
1.4 样品处理与检测
将碳酸饮料、橙味饮料以及发酵饮料分别稀释10倍,即用移液管精密量取原样品10.0 mL至100 mL容量瓶中加水定容,摇匀。取样品4份,其中1份作为本底,另外3份分别加入5.0、20.0、40.0 mg/L的苯甲酸和山梨酸标准溶液进行回收率考察。稀释样品溶液经0.22 μm微孔过滤膜过滤后,按照“1.3”色谱条件进行分析。

图1 咪唑离子液体种类对苯甲酸和山梨酸分离效果的影响Fig.1 Effect of imidazolium ionic liquid type on separation efficiencies of benzoic acid and sorbic acidA:[EMIm][Cl];B:[BMIm][Cl];C:[HMIm][Cl];D:H2O.1:benzoic acid;2:sorbic acid;chromatographic conditions:column:ZORBAX ODS;mobile phases:methanol-0.2 mmol/L ionic liquid aqueous solution(40>∶60);ultraviolet detection:230 nm;column temperature:30 ℃;flow rate:1.0 mL/min;injection volume:20 μL
2 结果与讨论
2.1 咪唑离子液体种类与浓度的影响
用甲醇-咪唑离子液体水溶液为流动相,分别考察了不同咪唑离子液体种类([HMIm][Cl]、[BMIm][Cl]、[EMIm][Cl])作为流动相添加剂时,对苯甲酸和山梨酸分离和检测的影响(见图1)。由图1可知,当流动相只用甲醇-水时,2种分析物的保留时间较长,色谱峰的对称性较差。当流动相中加入离子液体后,分析物的保留时间缩短,色谱峰的对称性变好,检出限降低,并按[HMIm][Cl]、[BMIm][Cl]、[EMIm][Cl]次序,分析物的保留时间缩短程度增大。实验也考察了甲酸铵作为流动相添加剂对2种分析物测定的影响。结果表明,相比于咪唑离子液体,甲酸铵作为流动相添加剂时,2种分析物的分离度较小,检出限较高。综合考虑保留时间、分离度和检出限等,选择[BMIm][Cl]作为最佳流动相添加剂。

图2 [BMIm][Cl]浓度对苯甲酸和山梨酸分离效果的影响Fig.2 Effect of [BMIm][Cl]concentration on separation efficiencies of benzoic acid and sorbic acid [BMIm][Cl]concentration(A-E):0.1,0.2,0.3,0.4,0.5 mmol/L;1:benzoic acid;2:sorbic acid
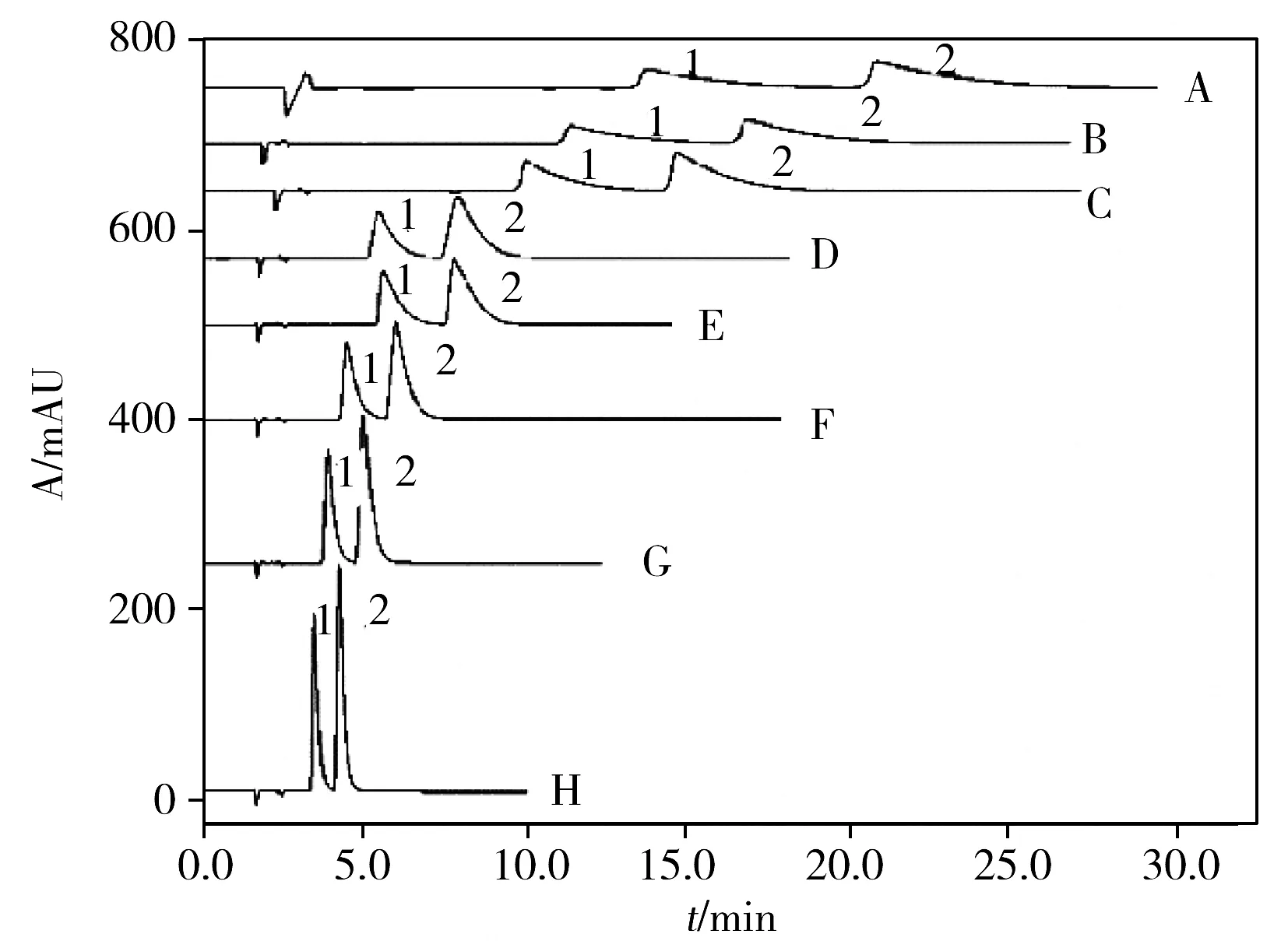
图3 甲醇体积分数对苯甲酸和山梨酸分离效果的影响Fig.3 Effect of methanol volume proportion on separation efficiencies of benzoic acid and sorbic acidvolume proportion of methanol(A-H):15%,20%,25%,30%,35%,40%,45%,50%;1:benzoic acid;2:sorbic acid
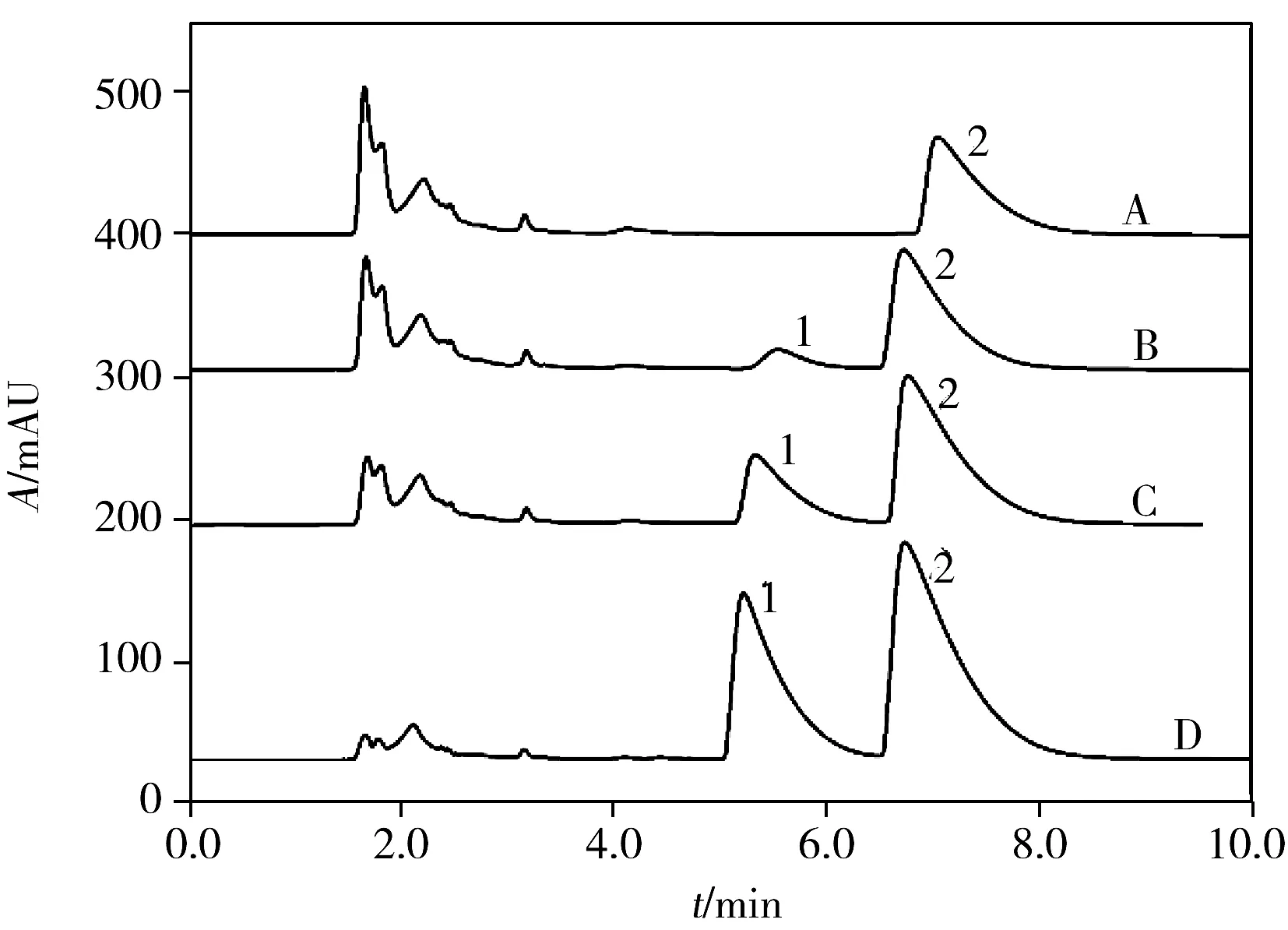
图5 发酵饮料样品中苯甲酸和山梨酸的色谱图Fig.5 Chromatograms of benzoic acid and sorbic acid in fermented beverage samplesA:fermented beverage;B:standard addition 5.0 mg/L;C:standard addition 20.0 mg/L;D:standard addition 40.0 mg/L;1:benzoic acid;2:sorbic acid
以甲醇-[BMIm][Cl]水溶液为流动相,进一步考察不同离子液体[BMIm][Cl]浓度(0.1、0.2、0.3、0.4、0.5 mmol/L)对苯甲酸和山梨酸分离的影响(见图2)。由图2可知,随着[BMIm][Cl]浓度的升高,2种分析物的保留时间逐渐缩短,分离度逐渐减小。保留时间逐渐缩短的原因是[BMIm][Cl]起到了洗脱剂的作用,其浓度的增加导致流动相的洗脱能力增强[27]。综合考虑保留时间、分离度,选用[BMIm][Cl]的最佳浓度为0.2 mmol/L。
2.2 甲醇浓度的影响
以甲醇-0.2 mmol/L[BMIm][Cl]为流动相,保持其他色谱条件不变,考察了流动相中甲醇体积分数变化(15%、20%、25%、30%、35%、40%、45%、50%)对分离检测的影响(见图3)。结果显示,随着甲醇体积分数的增大,苯甲酸和山梨酸的保留时间缩短。这是由于甲醇浓度的增大,使得流动相的疏水性逐渐增强,导致分析物苯甲酸和山梨酸在反相固定相上的保留减弱,保留时间缩短[28]。当流动相中甲醇浓度较低时,两种分析物的保留时间较长;而当甲醇浓度较高时,两种分析物的保留时间过短。综合考虑分析物的保留时间和分离度,选择流动相中甲醇的体积分数为40%。
2.3 检测波长的影响
苯甲酸紫外吸收光谱的最大吸收波长在228 nm 左右,山梨酸的最大吸收波长在252 nm 左右[29]。本实验考察了检测波长在200~290 nm变化时对测定苯甲酸和山梨酸的影响。结果显示,检测波长对2种分析物的峰高影响较大。当检测波长为230 nm时,2种物质的峰高、噪音值均较好。因此,实验选择检测波长为230 nm。
2.4 色谱柱温度的影响
当流动相为甲醇-0.2 mmol/L[BMIm][Cl](40>∶60),检测波长为230 nm,流速为1.0 mL/min时,考察了不同色谱柱温度(25、30、35 ℃)对分析物测定的影响。结果显示,随着色谱柱温度的升高,2种分析物的保留时间逐渐缩短,分离度逐渐增大(2.12、2.29、2.62),噪声值略有增大。综合考虑保留时间、分离度和基线噪声,选择色谱柱温度为35 ℃。
2.5 线性范围与检出限
通过以上考察,确定分析苯甲酸和山梨酸的适宜色谱条件见“1.3”。在此色谱条件下测定2种分析物的标准溶液(质量浓度分别为1.0、5.0、10.0、20.0、30.0、50.0、80.0、100.0 mg/L),其中30.0 mg/L标准溶液的色谱图见图4。在7.0 min内可实现苯甲酸和山梨酸的分离和检测。以峰面积(y)对分析物的质量浓度(x,mg /L)计算线性回归方程。以 3 倍信噪比(S/N=3)计算检出限。连续7次重复测定苯甲酸(30.0 mg /L)和山梨酸(30.0 mg /L)混合标样,计算峰面积的相对标准偏差(RSDs)和保留时间的相对标准偏差(RSDt)。结果显示,苯甲酸和山梨酸均在1.0~100.0 mg/L范围内呈良好的线性关系,相关系数(r)分别为0.999 9和0.999 7,检出限均为0.02 mg/L,RSDs和RSDt均小于1.5%。方法符合定量分析的要求。
2.6 实际样品的分析
将本方法应用于碳酸饮料、橙味饮料和发酵饮料中苯甲酸和山梨酸的分析。按“1.4”进行样品处理和分析,色谱图见图5。由图5可知样品基质对苯甲酸和山梨酸的测定基本无影响。样品分析结果和加标回收率见表1。2种物质的加标回收率为93.9%~104%,相对标准偏差(RSD)不大于4.0%,表明方法的准确性和精密度良好,能满足待测物定量分析的要求。
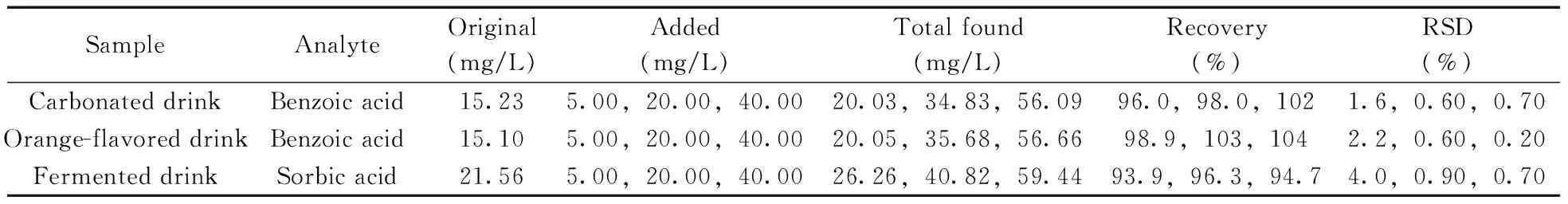
表1 饮料中苯甲酸和山梨酸的含量及其加标回收率(n=5)Table 1 Contents of benzoic acid and sorbic acid in drink samples and their spiked recoveries(n=5)
3 结 论
本研究发展了以咪唑离子液体作为流动相添加剂的反相色谱测定苯甲酸和山梨酸的方法,采用反相色谱柱,以甲醇-[BMIm][Cl]水溶液为流动相,可以实现2种物质的分离和紫外检测,并成功应用于饮料样品的测定。本方法的检出限较低,线性、重现性及准确性满足定量分析的要求,且方法简便,易于推广使用,可为食品中的苯甲酸和山梨酸检测提供参考。
