气相色谱-质谱法测定血浆中31种游离脂肪酸含量
2020-08-21刘佩珊马安德周枝凤
刘佩珊,牟 燕,马安德,周枝凤
(南方医科大学 公共卫生学院 卫生检验检疫学系,广东 广州 510515)
脂肪酸是脂质的重要组成部分,是维持人体生长发育和健康所必需的物质。血浆中的游离脂肪酸(FFAs)组成是膳食脂肪酸的摄入及内源性脂肪酸代谢的反映,FFAs种类多达40余种[1]。血浆中FFAs代谢失衡会引起心血管疾病、肿瘤、免疫和代谢性疾病等多种疾病[2]。妊娠期妇女血浆中FFAs代谢异常,不仅影响母体健康,还会影响胚胎发育,导致胎儿生长发育迟缓和神经系统发育异常[3]。因此,为更好地反映人体FFAs代谢状况,建立一种高效、灵敏、较全面测定血浆中FFAs含量的分析方法尤为重要。
气相色谱法(GC)和气相色谱-质谱法(GC-MS)是目前测定FFAs最常用的方法[4],这两种方法测定血浆中FFAs含量的样品前处理通常包括两个步骤:血浆中的FFAs经有机溶剂提取后,在衍生化试剂的作用下与甲醇发生酯化反应,生成对应的脂肪酸甲酯(FAMEs)[5]。脂肪酸提取的常用溶液体系有氯仿-甲醇和甲基叔丁基醚-甲醇溶液。常用衍生化方法有酸催化和碱催化,其中酸催化常以硫酸、盐酸、乙酰氯和三氟化硼为衍生化试剂[6],但盐酸催化反应时间长,易引入副产物,不适合大样本量检测[7];而三氟化硼毒性强、保质期短,易与氧气反应[8]。碱催化法主要用于动物油脂的衍生化,不适用于游离脂肪酸的甲酯化[9]。为节省时间和减少试剂耗材的使用量,有报道提出了直接衍生化样品的“一步”反应法,但其回收率低于“两步”反应[10]。目前,大部分分析方法所检测的FFAs种类较少,仅4~20余种[6-7,11-12]。本研究比较了不同脂肪酸提取方法及衍生化方法对血浆中FFAs测定的影响,优化了衍生化反应条件,并结合气相色谱-质谱将其用于孕妇血浆样本中FFAs的检测,可获得较全面、准确可靠的FFAs信息。
1 实验部分
1.1 仪器与试剂
QP 2010 Plus气相色谱-质谱联用仪(日本岛津公司),配AOC-20i+s自动进样器。包含31种脂肪酸甲酯在内的37种脂肪酸甲酯混合标准溶液(1 mL,不同浓度溶于二氯甲烷,美国Supelco公司);十九烷酸甲酯(C19>∶ 0,IS)、十三烷酸(C13>∶ 0)、二十三烷酸(C23>∶ 0)(100 mg,纯度>99%,上海安谱实验科技股份有限公司);甲醇(色谱纯,美国Merck公司);正己烷、甲基叔丁基醚(MTBE)、乙酰氯和甲醇钠(色谱纯,德国CNW公司);三氟化硼-甲醇溶液(14%三氟化硼溶于甲醇,上海麦克林生化科技有限公司);盐酸、硫酸、甲苯、氯仿、无水碳酸钾和氯化钠均为分析纯(广州化学试剂厂);实验用水由Milli-Q纯水仪(美国Millipore公司)制备。
1.2 标准溶液及质控样品的配制
取37种脂肪酸甲酯混合标准溶液,用二氯甲烷>∶ 正己烷(体积比1>∶2)稀释2、3、3.33、6.66、40、100、500、2 000倍,配制校准曲线用系列标准溶液。分别称取适量C13>∶ 0和C23>∶ 0标准品,用正己烷>∶甲醇(体积比1 >∶4)溶解并稀释制得1.6、100、640 μg/mL的质控标准溶液,用于计算回收率、精密度和准确度。称取适量C19>∶ 0标准品,用二氯甲烷>∶ 正己烷(体积比1>∶2)溶解配成25 μg/mL的内标(IS)标准溶液。血浆质控样品:取50 μL血浆于离心管中,加入10 μL 100 μg/mL质控标准溶液,涡旋1 min,用于计算方法回收率、精密度和准确度。
1.3 FFAs提取
提取方法①[13]:向血浆质控样品中加入750 μL氯仿>∶ 甲醇(体积比1>∶ 2)、250 μL氯仿和250 μL水,涡旋1.5 min,于4 ℃下以13 000 r/min离心5 min;转移有机层至反应瓶,向水层中加入250 μL氯仿,重复提取一次,合并两次提取液,氮气吹干,得干燥脂肪酸提取物A。
提取方法②[14]:向血浆质控样品中加入750 μL氯仿>∶ 甲醇(体积比2>∶1)和200 μL水,涡旋1.5 min,于4 ℃下以13 000 r/min离心5 min。转移有机层至反应瓶,向水层中加入500 μL氯仿>∶ 甲醇>∶ 水(体积比86>∶14∶1)重复提取一次,合并两次提取液,氮气吹干,得干燥脂肪酸提取物B。
提取方法③[15]:向血浆质控样品中加入300 μL甲醇、600 μL MTBE和300 μL 0.15 mmol/L醋酸铵,涡旋1.5 min,于4 ℃下以13 000 r/min离心5 min。转移有机层至反应瓶,向水层中加入300 μL MTBE重复提取一次,合并两次提取的有机层溶液,氮气吹干,得干燥脂肪酸提取物C。
1.4 FFAs衍生化
乙酰氯法[6]:向提取物A中加入200 μL乙酰氯和2 mL甲醇>∶ 正己烷(体积比4>∶1)溶液,密封混匀后于90 ℃反应1.5 h。待反应瓶冷却至室温后,加入5 mL 6%碳酸钾溶液和2 mL正己烷,混匀后转入离心管,涡旋1 min,于4 ℃下以13 000 r/min离心5 min,取有机层,氮气吹干,加入20 μL IS溶液和80 μL正己烷复溶,待测。
硫酸法[16]:向提取物A中加入1 mL 2.5%硫酸-甲醇溶液,密封混匀后于90 ℃反应1.5 h。待反应瓶冷却至室温后,加入3 mL 0.9%氯化钠溶液和2 mL正己烷,其余步骤同乙酰氯法。
盐酸法[7]:向提取物A中加入1 mL 3 mol/L盐酸-甲醇溶液,密封混匀后于90 ℃反应1.5 h。待反应瓶冷却至室温后,加入2 mL正己烷,其余步骤同乙酰氯法。
三氟化硼法[6]:向提取物A中加入100 μL甲苯和500 μL 14%三氟化硼-甲醇溶液,密封混匀后于90 ℃反应1.5 h。待反应瓶冷却至室温后,加入2 mL 0.9%氯化钠溶液和2 mL正己烷,其余步骤同乙酰氯法。
甲醇钠法[6]:向提取物A中加入1.25 mL 0.5 mol/L甲醇钠溶液,密封混匀后于90 ℃反应1 h。待反应瓶冷却至室温后,加入1.25 mL 14%三氟化硼-甲醇溶液,密封,混匀后于90 ℃反应0.5 h。待反应瓶冷却至室温后,再加入6 mL 0.9%氯化钠溶液和2 mL正己烷,其余步骤同乙酰氯法。
直接衍生化法[17]:向干净反应瓶中加入200 μL乙酰氯、50 μL血浆质控样品和2 mL甲醇>∶ 正己烷(体积比4>∶1)溶液,密封混匀后于90 ℃反应1.5 h。待反应瓶冷却至室温后,加入5 mL 6%碳酸钾溶液和2 mL正己烷,其余步骤同乙酰氯法。
1.5 GC-MS分析条件
色谱条件:SP-2560色谱柱(100 m×0.25 mm×0.2 μm,美国Supelco公司);升温程序:起始温度100 ℃,保持5 min,以4 ℃/min升至240 ℃,保持30 min。进样口温度:230 ℃;分流比10>∶1;载气:氦气(纯度>99.999%),流量:1.0 mL/min;进样量:1.0 μL。
质谱条件:EI离子源;离子源温度250 ℃;接口温度为230 ℃。溶剂延迟4 min;全扫描(SCAN)模式;质谱扫描范围:m/z33~450。

图1 31种 FAMEs和IS标准品的总离子流色谱图(TIC)Fig.1 Total ion chromatogram of 31 FAMEs and IS standardsthe peak number 1-31 were the same as those in Table 1

图2 不同衍生化方法对不同FFAs类型含量的影响(n=3)Fig.2 Effects of derivatization methods on the levels of different types of FFAs(n=3)
2 结果与讨论
2.1 分析条件的优化
采用分流和不分流进样对31种FAMEs进行分析,结果显示:不分流进样时,溶剂峰严重拖尾,无法与C4>∶ 0峰分离,且碳数为12以下的目标物色谱峰严重展宽,影响定量。经优化,确定最佳分流比为10>∶1。在此分析条件下31种FAMEs和十九烷酸甲酯(IS)的色谱图见图1。由图可见,31种FAMEs均能被有效分离和检测,总分析时间为60 min。
2.2 FFAs提取方法的选择
实验采用乙酰氯衍生化法考察了3种经典的脂肪酸提取方法对同一血浆样品中FFAs种类、提取含量及回收率的影响。结果显示,提取方法①和②均能提取出31种FFAs,而方法③提取了30种FFAs,无法有效提取C18>∶ 2n6t。进一步比较发现,方法①提取的饱和脂肪酸(SFAs)、单不饱和脂肪酸(MUFAs)、多不饱和脂肪酸(PUFAs)和总FFAs(Total FFAs)含量和加标回收率均为最高。因此,本文以方法①提取富集血浆中的FFAs。
2.3 FFAs衍生化方法的选择
在确定提取方法的条件下,实验用氯仿>∶甲醇(体积比1>∶2)提取质控样品中FFAs后,比较了“1.4”所述5种衍生化法对分析结果的影响(图2)。结果显示,5种衍生化方法均可获得31种脂肪酸甲酯,且以乙酰氯法获得FFAs组含量和加标回收率为最高。进一步比较了“两步”反应和“一步”反应的衍生化效果,发现两者均能获得满意的加标回收率(>90%),但“两步”反应所得各FFAs组含量显著高于“一步”反应。表明“两步”反应虽然消耗更多的时间和试剂,但能更准确地定量血浆样品中的FFAs组成,这与Amusquivar等[10]研究结果一致,因此本实验采用“两步”反应进行衍生化。
2.4 FFAs衍生化反应温度与时间的优化
为获得最优的衍生化温度和时间,以C13>∶ 0和C23>∶ 0为研究目标,考察了不同反应温度(40、60、80、90、100 ℃)和时间(0.5、1.0、1.5、2.0、3.0、4.0、5.0 h)FFAs甲酯化的影响。结果显示,C13>∶ 0和C23>∶ 0的衍生化效率随着反应温度的升高而逐渐增大,在90 ℃达到最大值,此后升高温度衍生化效率反而降低;且C23>∶ 0的反应温度~衍生化效率曲线比C13>∶ 0更陡峭,表明反应温度对超长链FFAs衍生化效率的影响更大。随着反应时间的延长,乙酰氯对C13>∶ 0和C23>∶ 0的衍生化效率逐渐增大,并在1.5 h达到最大值,继续延长时间衍生化效率反而逐渐降低。因此,确定乙酰氯衍生化脂肪酸的最佳温度和时间分别为90 ℃和1.5 h。这与Amusquivar等[10]用乙酰氯在80 ℃下衍生化2.5 h及Liu等[7]用盐酸-甲醇法在45 ℃下衍生化14 h的方法相比,本研究反应时间更短,更利于大样本量的检测。
2.5 方法学考察
2.5.1 线性范围、检出限(LOD)及定量下限(LOQ)在优化条件下,对“1.2”配制的31种FAME混合标准溶液进行测定,以FAME和IS的峰面积之比为纵坐标(Y),对应质量浓度比(X)为横坐标绘制标准曲线。结果显示,31种FAMEs在其各自的浓度范围内线性良好,相关系数(r)不低于0.999 0。以3倍信噪比(S/N≥3)和10倍信噪比(S/N≥10)分别计算得LOD和LOQ分别为0.010~0.050 μg/mL和0.034~0.167 μg/mL。LOD显著低于林晖等[16]报道的方法,LOQ低于Giera[18]报道的方法,且所用样本量(50 μL)比文献报道[10,16-17](100~200 μL)更少。31种FAMEs的保留时间、线性方程、线性范围、相关系数(r)、LOD和LOQ等结果见表1。

表1 31种FAMEs的保留时间、线性方程、线性范围、相关系数(r)、LODs及LOQsTable 1 Retention times,linear equations,linear ranges,correlation coefficients(r),LODs and LOQs of 31 FAMEs

(续表1)
2.5.2 回收率及相对标准偏差以C13>∶ 0和C23>∶ 0为研究目标物质,配制低、中、高(0.16、10、64 μg/mL)3个浓度水平的血浆质控样品,每个浓度水平平行实验6次,考察方法的回收率及相对标准偏差(RSD),并连续测定3 d,计算日内及日间RSD。结果表明,C13>∶ 0和C23>∶ 0的回收率为86.3%~115%,RSD(n=6)不大于9.6%,日内RSD(n=6)不大于6.3%,日间RSD(n=3)不大于7.8%,表明该方法准确可靠,精密度良好,均符合2018版FDA生物样品分析方法验证指南中对回收率、精密度和准确度的要求[19]。
2.6 实际样品检测
取49份健康孕妇血浆样本在优化条件下测定FFAs含量,结果显示,与国内外报道相比,本方法可从健康孕妇血浆中检出更多种类的FFAs(21~31种),最多可检出31种,其中C11>∶ 0、C17>∶ 1、C21>∶ 0、C22>∶ 0、C22>∶ 1n9和C22>∶ 2在已报道的健康孕妇血浆中未被检出[20-21]。检出31种FAMEs的样品总离子流色谱图见图3。孕妇血浆中C16>∶ 0浓度占总浓度比例最大,其次为C18>∶ 2n6c、C18>∶ 1n9c和C18>∶ 0,其余的FFAs占总浓度比例均小于10%(见图4)。此外,C16>∶ 0(棕榈酸)和C18>∶ 0(硬脂酸)为动物油中最常见的饱和脂肪酸,C18>∶ 1n9c(油酸)和C18>∶ 2n6c(亚油酸)为植物油中最常见的不饱和脂肪酸,这4种脂肪酸在被检血浆的FFAs中的构成比例较大,与人体膳食脂肪酸摄入的主要来源是动植物油有关,与Oliveira等[20]报道的结果相近。C18>∶ 3n3(α-亚麻酸)、C20>∶ 5(EPA)、C20>∶ 4n6(花生四烯酸)和C22>∶ 6(DHA)4种具有重要生理功能的多不饱和脂肪酸的含量与国内报道的正常孕产妇脐血中多不饱和脂肪酸含量接近[21]。
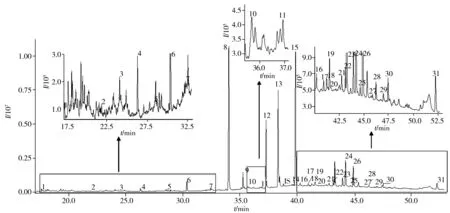
图3 孕妇血浆中31种脂肪酸甲酯的总离子流色谱图(TIC)Fig.3 Total ion chromatogram of 31 fatty acid methyl ester in pregnant woman's plasmathe number 1-31 were the same as those in Table 1
3 结 论
本文通过比较不同提取方法和衍生化方法对血浆中FFAs定性定量的影响,确定了以氯仿>∶ 甲醇(体积比1>∶2)提取血浆中的FFAs,乙酰氯法衍生化,建立了血浆中FFAs含量的气相色谱-质谱测定方法。方法可用于血浆中31种FFAs的准确定性和定量,具有灵敏、稳定、可靠、所需样本量少以及可获得血浆中更多FFAs信息等优点。将该方法应用于测定孕妇血浆中的FFAs组成和含量,从而获得较全面、准确可靠的FFAs代谢谱信息。研究结果既可反映孕妇膳食结构,又能反映其代谢情况,可为下一步制订和调整孕期膳食营养提供科学依据。
