多孔NiO的制备及其对水中四环素的吸附
2020-08-21连丽丽葛佳慧张鑫宇娄大伟
连丽丽,葛佳慧,杨 旭,张鑫宇,娄大伟
(吉林化工学院 分析化学系,吉林 吉林 132022)
近年来,畜禽养殖业中滥用抗生素的现象普遍存在,而抗生素在受药生物体内吸收率低,绝大部分药物将经代谢排出生物体外,进而造成土壤和水环境的污染。与此同时,抗生素庞大的需求量使得生产企业数量大幅增多,而制药产生的废水也会对环境造成污染。四环素(Tetracycline,TC)是一种由链霉菌代谢产生的广谱抗生素[1]。统计数据表明,TC类抗生素是第二大常用抗生素,是动物源食品和水样中抗生素残留的主导部分[2-4]。因此药厂废水及饮用水源中TC类抗生素的有效去除刻不容缓。
目前受TC类抗生素污染的水体的处理方法主要有生物处理法和物理化学处理法两大类。其中物理化学处理法中的吸附法由于具有便捷高效、无二次污染等优点受到广泛青睐。用于吸附TC类抗生素的吸附剂主要包括蒙脱石[5]、沸石[6]、活性炭[7]、碳纳米管[8]等。其中活性炭是水中污染物去除最有效的吸附剂之一,但其价格昂贵,再生性能差,应用受到限制。
NiO是一种典型的过渡金属氧化物,具有独特的电磁性质及优异的催化和吸附性能,被广泛应用于光催化[9]、气体传感器[10]、超电容器[11]、吸附分离[12-13]等领域。本文采用一种简便、温和的方法合成了一种具有花朵形状的多孔NiO材料。考察了溶液环境(吸附剂质量、溶液pH值、吸附时间、TC溶液初始浓度、温度)对NiO吸附性能的影响,评估了材料的重复使用性。
1 实验部分
1.1 试剂与仪器
四环素(色谱纯)购自阿拉丁试剂有限公司;甲醇、乙腈(色谱纯)购自美国Tedia公司;NiCl2·6H2O、无水乙醇、尿素、柠檬酸钠、草酸均为分析纯,购自天津大茂化学试剂厂;实验用水为高纯水。
使用PW 3710/31 X-射线衍射仪(Philips)进行产物晶型分析;通过Vertex 80V型傅立叶红外光谱仪(Bruker,德国)进行红外光谱分析;使用JSM-7500F型扫描电子显微镜(SEM,JEOL,日本)分析产物的形貌特征;TC的浓度由H-Class超高效液相色谱仪(UPLC,Waters,美国)测定。
1.2 色谱分析条件
色谱柱:Acquity UPLCTMBEH C18柱(50 mm×2.1 mm,1.7 μm)(美国Waters 公司);柱温35 ℃;样品室温度20 ℃;进样体积10 μL;流动相为乙腈-0.02 mol/L草酸水溶液;流速设为0.25 mL/min。紫外检测器波长为280 nm。
1.3 吸附实验
1.3.1 NiO的制备称取3 mmol的NiCl2·6H2O加入到75 mL水中,超声使块状固体溶解,依次加入6 mmol的尿素和0.3 mmol的柠檬酸钠,继续搅拌使其形成均一的浅绿色溶液。将混合溶液转移到水热合成釜中,置于烘箱120 ℃下加热6 h。反应结束后将产物Ni(OH)2离心,用去离子水和无水乙醇反复多次洗涤,80 ℃下真空干燥12 h。将固体转移至瓷坩埚中,在马弗炉中300 ℃煅烧2 h得到多孔NiO。
1.3.2 吸附实验将3 mg 的NiO加入到10 mL 质量浓度为10 mg/L的TC溶液中,25 ℃水浴振荡一定时间后高速离心分离出固体吸附剂,取上清液通过UPLC确定剩余TC的浓度。考察吸附剂质量、溶液pH值、吸附时间、TC溶液浓度、温度等参数对NiO吸附性能的影响。
2 结果与讨论
2.1 材料的表征
利用SEM对NiO的形貌进行了表征。如图1A、图1B所示,本文制备的NiO由大量弯曲的纳米片组成,呈现具有大孔的团簇状花朵结构。产物具有良好的结晶度,在37.3°,43.2°,62.9°,75.7°和79.7°处产生5个尖峰(图1C),分别对应NiO(111)、(200)、(220)、(311)和(222)晶面的特征衍射(JCPDS:047-1049)[14]。图1D为TC、NiO和吸附了TC的NiO的红外光谱(FTIR)谱图。TC的特征峰主要位于1 700~1 200 cm-1之间,归属于TC分子中苯环骨架的振动吸收。在NiO的FTIR谱图中,3 417 cm-1处的宽峰归属为吸附水分子—OH的伸缩振动,1 630 cm-1处的谱带与水分子中O—H的弯曲振动有关,416 cm-1处观察到的吸收峰归因为Ni—O的伸缩振动。吸附TC后,Ni—O的吸收峰位无移动,表明吸附TC并未改变NiO的结构,而TC分子位于1 458 cm-1处的吸收峰移至1 462 cm-1处,说明NiO与TC之间可能存在电子诱导效应,位于1 142 cm-1处的峰(归属于C—O和酚羟基的吸收)则向低频位置(1 115 cm-1)移动,证明TC分子与NiO发生表面络合作用[15-16]。
2.2 NiO质量对吸附效率的影响
在10 mL 质量浓度为10 mg/L的TC溶液中,加入不同质量的多孔NiO,25 ℃水浴振荡8 h,测定吸附后溶液中TC的浓度,进而考察吸附剂质量对吸附效率的影响。如图2所示,随着NiO质量的增加,吸附效率随之升高,当吸附剂的质量达到6.0 mg时,吸附效率大于94%。这是因为溶液中吸附剂质量的增大,提高了NiO颗粒和TC分子碰撞的几率,进而提高了多孔NiO对水溶液中TC的吸附效率。
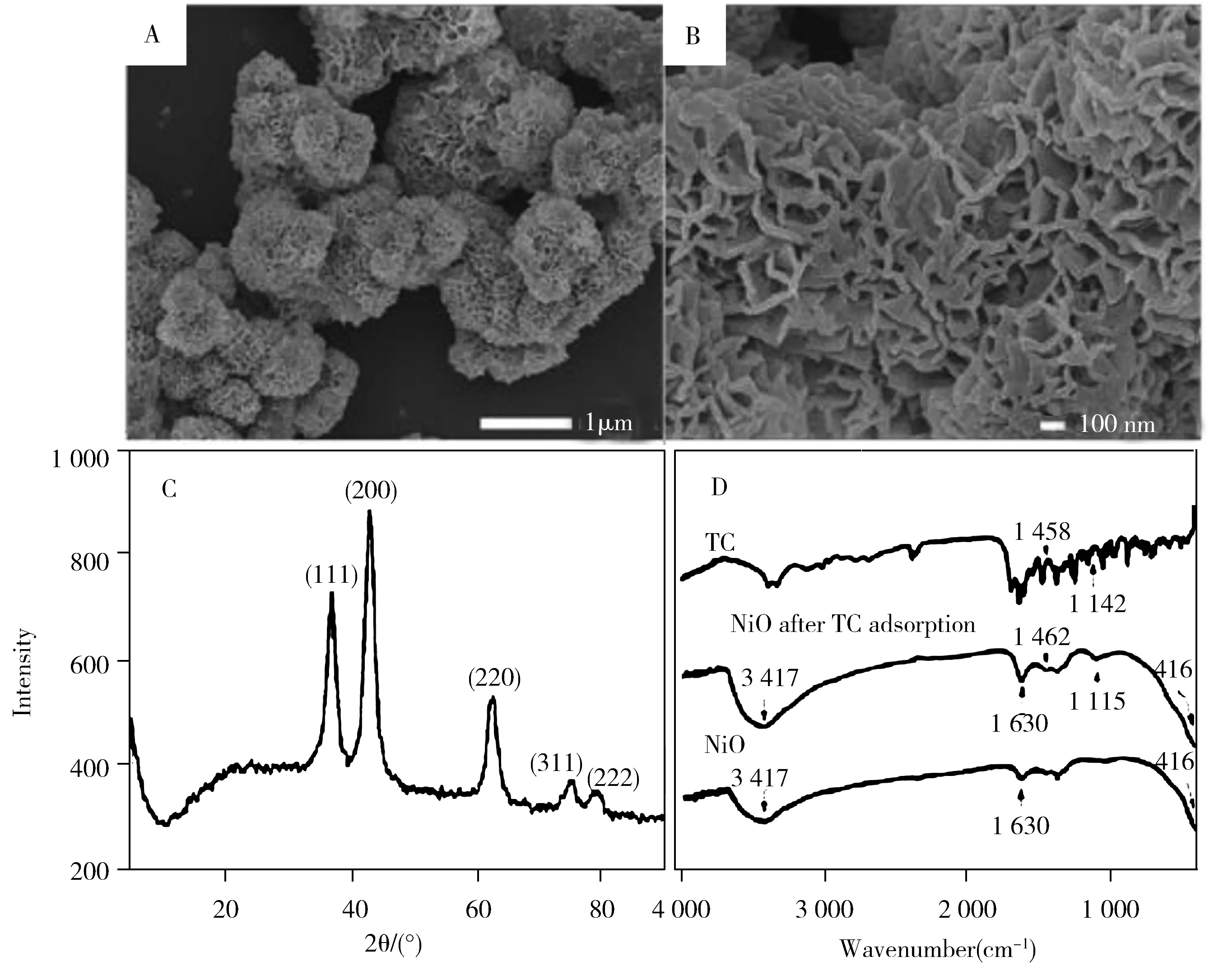
图1 NiO的SEM(A,B)和XRD谱图(C),以及NiO、TC和吸附了TC的NiO 的FTIR谱图(D)Fig.1 SEM images(A,B) and XRD pattern(C) of NiO,and FTIR spectra(D) of NiO,TC and NiO after TC adsorption
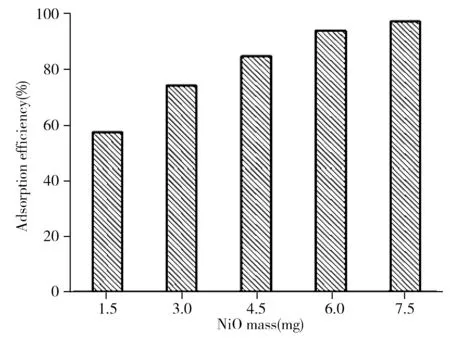
图2 NiO质量对吸附效率的影响Fig.2 Effect of NiO mass on the adsorption efficiency

图3 pH值对吸附的影响Fig.3 Effect of pH value on the adsorption
2.3 pH值对吸附的影响
考察了pH 2.0~10.0范围内NiO对TC的吸附能力。如图3所示,随着溶液酸度的降低,吸附容量呈线性增加,并于pH 7.0时达到最大,随后NiO对TC的吸附容量逐渐降低。因此pH 7.0时NiO对溶液中的TC吸附效果最优。这种现象的产生与吸附剂的性质和TC的分子结构有关。TC是一种两性分子,分子中同时含有可电离的酸性和碱性基团(—COOH,—OH,—NH2等),其带电情况与溶液的pH值相关。当pH<3.3,溶液中绝大部分TC分子带有正电荷;当pH值 介于3.3~7.7之间时,溶液中的TC主要以中性分子存在;pH>7.7时,TC分子主要带有负电荷[17]。NiO的电位等当点为8.5[18],当溶液pH<8.5时,NiO带正电;当溶液pH>8.5,NiO带负电。因此,在pH<3.0时,TC与NiO之间的静电排斥导致吸附剂的吸附容量降低。当溶液的pH值在3.0~7.0之间时,溶液中呈电中性的TC分子的百分比增加,吸附剂表面的Ni(Ⅱ)接受含氧官能团(羟基和羰基)的电子,进而与TC形成稳定的络合物,提高了吸附剂对TC的吸附容量。当pH值进一步增加,溶液中的TC以负离子为主导,与此时表面带有负电荷的NiO产生静电排斥作用而抑制吸附进行。因此,表面络合作用及静电作用是NiO吸附TC的主要作用机制。
2.4 动力学研究
在TC初始质量浓度为5~20 mg/L,溶液体积为25 mL,吸附剂加入量为3 mg,室温振荡3 h的实验条件下,考察反应时间对吸附过程的影响。如图4A所示,在上述条件下NiO对TC显示出良好的吸附性能,当吸附时间由0 min增至90 min,吸附量迅速上升,并在120 min时达到平衡。
应用准一级、准二级反应动力学模型对吸附数据进行拟合。准一级、准二级动力学方程如式(1)、式(2)所示:
(1)
(2)
其中qt和q1e(q2e)分别指在时间t和达到平衡时NiO对TC的吸附量,K1、K2为准一级、准二级反应速率常数。
以t/qt对t作图得到NiO吸附TC的准二级反应动力学模型图(图4B)。25 ℃时,当TC质量浓度由5 mg/L增加到20 mg/L,准一级反应速率方程的相关系数相对较低,在0.727 1~0.869 8之间,而准二级反应动力学的相关系数在0.989 6~0.998 3之间,说明此吸附体系更符合准二级动力学模型。这充分证明NiO对TC的吸附是一个由快到慢,并逐渐趋于平衡的过程;该吸附过程可能是涉及吸附剂与吸附质之间电子共享或电子转移的化学吸附过程[19]。
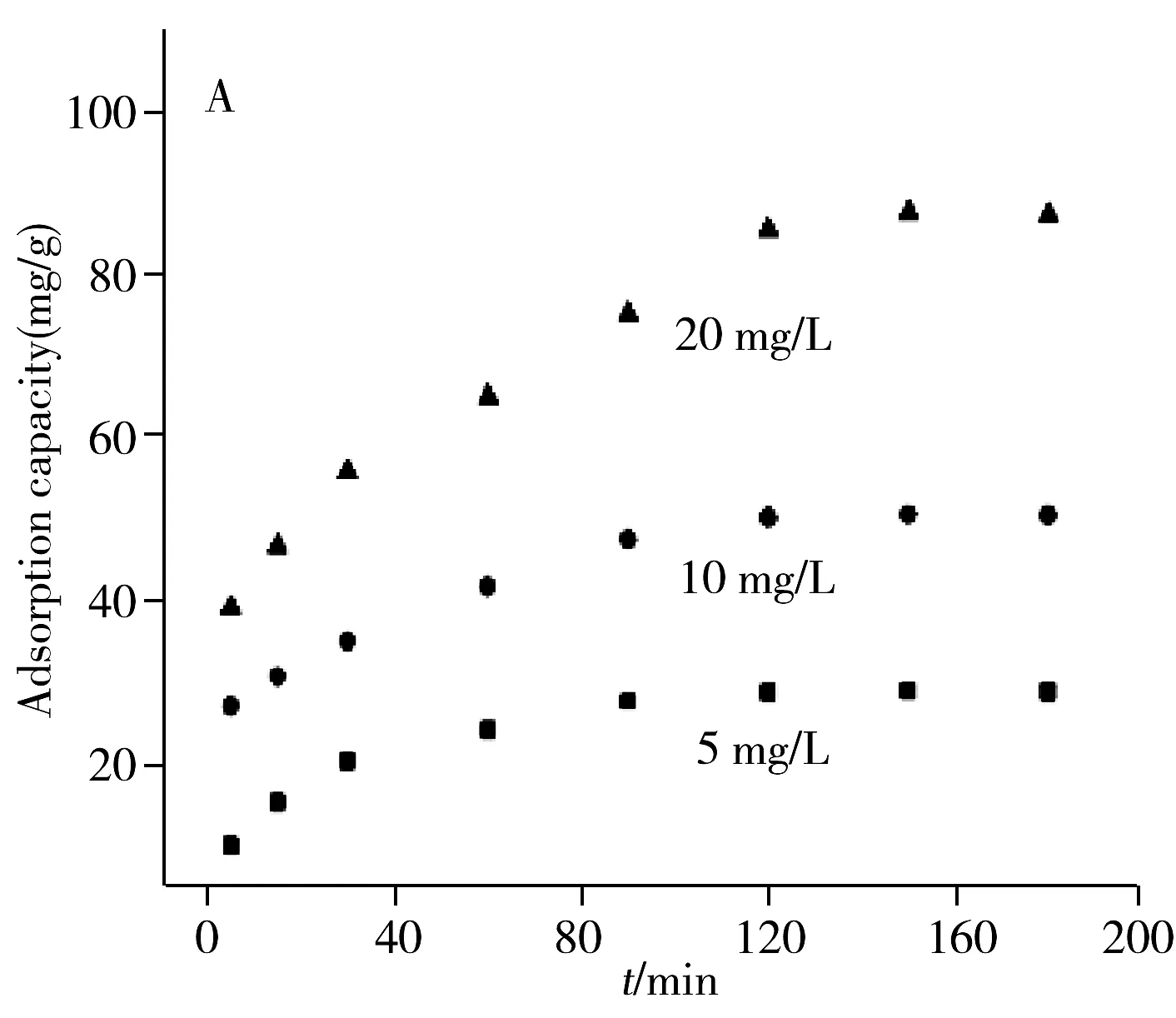

图5 NiO微球对TC吸附的等温线曲线Fig.5 TC adsorption isotherm curve on the NiO microspheres
2.5 等温吸附模型


表1 NiO与已报道的吸附剂对TC的单分子最大吸附量的比较Table 1 Comparison of the maximum monolayer adsorption for TC by NiO and the previously reported adsorbents
2.6 吸附热力学
如图6A所示,NiO对TC的吸附能力随着溶液温度的升高逐渐增大。通过范特霍夫方程(式(3)、式(4))对数据进行拟合,得到lnK与1/T的线性关系(图6B),计算此吸附反应的焓变(ΔH0)、吸附分配系数(K)、熵变(ΔS0)和吉布斯自由能改变(ΔG0)等热力学参数并列于表2。在所有温度下,ΔG0均为负值,且ΔH0=25.30 kJ/mol,说明TC在NiO表面的吸附是自发、吸热的。ΔS0为正值,表明NiO对TC的吸附是熵增过程,固-液界面混乱度增加。同时,ΔH0 ΔG0=-RTlnK (3) (4) 表2 TC吸附过程的热力学参数Table 2 Thermodynamic parameters of TC adsorption process 图7 NiO的重复使用性Fig.7 The reuse performance of NiO 再生性是吸附剂能否应用于实际水处理领域的重要指标。将3 mg 的NiO加入到10 mL pH 7.0的TC溶液中(10 mg/L),25 ℃水浴振荡120 min,测定浓度后使用甲醇-乙腈-0.02 mol/L草酸溶液(体积比为1>∶2>∶7)对NiO进行再生处理,并多次用于水中TC的吸附。实验结果表明(图7),在最初的5个循环中,吸附量下降较小(<15%),表明NiO具有良好的重复使用性。 本文采用水热法并通过高温煅烧制备了团簇花朵状的多孔金属氧化物NiO,其多孔的结构及表面大量存在的具有强络合能力的金属Ni(Ⅱ)使之对TC具有优异的吸附性能,且吸附速度快、吸附量大。实验发现中性条件有利于NiO对TC的吸附,且吸附过程为自发吸热过程,符合准二级动力学模型。通过Langmuir等温吸附模型拟合得到NiO对TC的最大吸附量为144.90 mg/g。本研究拓展了环境友好的金属氧化物在水处理领域的应用,为水体中抗生素污染物的去除提供了理论指导。

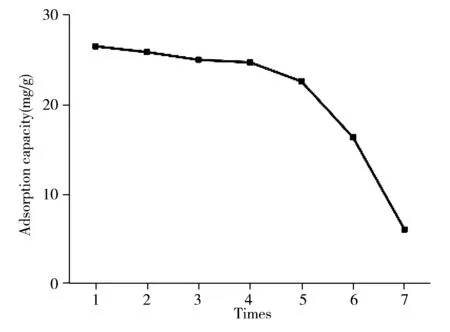
2.7 NiO的脱附与再生
3 结 论
