CYP2C19多态性和P2Y12抑制剂对急性冠状动脉综合征患者远期预后的影响
2020-08-21王赟赟李彤刘迎午刘博江赵杰赖朝辉苏斌赵云王昭
王赟赟 李彤 刘迎午 刘博江 赵杰 赖朝辉 苏斌 赵云 王昭
天津市第三中心医院心脏中心,天津市重症疾病体外生命支持重点实验室,天津市人工细胞工程技术研究中心300170
0 引言
阿司匹林联合P2Y12抑制剂的双联抗血小板治疗是经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)术后及急性冠状动脉综合征(acute coronary syndromes,ACS)患者的最重要治疗策略之一。氯吡格雷是一种经典的P2Y12抑制剂,需经肝细胞色素P450酶代谢为活性代谢产物。CYP2C19基因多态性会影响细胞色素P450酶的活性,从而导致氯吡格雷的疗效差异。有研究结果显示,20%~30%的患者对氯吡格雷的抗血小板治疗应答不足[1]。CYP2C19基因具有高度多态性,其中CYP2C19*2和CYP2C19*3是功能缺陷等位基因,与氯吡格雷活性代谢产物生成减少有关,继而导致抗血小板作用降低,冠状动脉血栓事件风险增加[2]。新型P2Y12抑制剂(替格瑞洛或普拉格雷)的血小板抑制作用更强,可显著降低支架内血栓的风险[2],且其代谢不受CYP2C19基因多态性影响,个体间疗效差异较小[3]。目前多个国际指南推荐ACS患者优先使用新型P2Y12抑制剂,但其出血风险更高[4-6],尤以亚裔患者为甚[7-8]。
对于P2Y12抑制剂的选择,除依据患者的临床缺血/出血风险外,血小板功能及基因检测是最直接的方法。近年来,血小板基因检测备受重视。了解患者的CYP2C19基因代谢型,个体化选择P2Y12受体拮抗剂,有望提高抗血小板治疗的疗效。目前,关于亚裔人群血小板基因检测指导抗血小板策略的临床研究较少。本研究旨在探讨结合患者的CYP2C19基因代谢型和临床特征选择P2Y12受体拮抗剂与PCI术后ACS患者的远期预后是否相关。
1 资料与方法
1.1 临床资料
连续入选2016年3月至2016年10月在天津市第三中心医院心脏中心住院并接受PCI的ACS患者289例,对其进行CYP2C19基因多态性筛查,并通过心脏科门诊复查及电话收集信息,进行为期3年的临床随访,失访23例,共入组266例。入选标准:①年龄≥18岁且<90岁。②符合ACS诊断标准。③入院后进行血小板基因多态性检测。④入院后接受择期或急诊PCI治疗。⑤PCI术后常规服用双联抗血小板药物(阿司匹林联合氯吡格雷或替格瑞洛)治疗1年,服药期间出现严重出血减药或停药。排除标准:①心源性休克或射血分数<40%。②长期服用抗凝药物。③凝血功能异常。④发病24 h内行静脉溶栓治疗。⑤血小板计数<6×1010/L。⑥合并恶性肿瘤或其他预期寿命<3年的疾病。本试验为临床队列研究,获得天津市第三中心医院伦理委员会的批准(批准文号为20160109),所有入选患者均签署知情同意书。
1.2 方法
1.2.1 分组方法
根据是否携带CYP2C19功能缺陷基因,将289例入选患者分为携带CYP2C19功能缺陷基因组(A组,199例)和未携带CYP2C19功能缺陷基因组(B组,90例)。PCI术后选择不同的P2Y12抑制剂,随访3年,共失访23例,最终A组入组182例,B组入组84例。再根据随访3年内有无主要心血管不良事件(major adverse cardiovascular events,MACE),将A、B组各分为MACE亚组(58例、32例)和无MACE亚组(124例、52例)。
1.2.2 相关危险因素的收集
记录入选患者的性别、年龄、既往病史、吸烟史、饮酒史、早发冠心病家族史(一级亲属如父亲<55岁或母亲<65岁患有冠心病),并测量身高、体质量、血压,计算身体质量指数。入选患者入院24 h内取晨起空腹静脉血,检测相关生化指标、血常规、凝血功能、B型利钠肽及血小板CYP2C19基因多态性;双联抗血小板治疗5 d后检测血小板聚集功能,包括花生四烯酸抑制率和二磷酸腺苷抑制率。心脏彩超测量左心室舒张末期内径、射血分数等。
1.2.2.1 CYP2C19基因型检测
入选患者于入院后第2天清晨抽取静脉血2 ml,加入乙二胺四乙酸抗凝管中。采用Magen柱式核酸提取试剂盒(美基生物科技有限公司)提取基因组DNA,人类CYP2C19基因多态性检测试剂盒(武汉友芝友医疗科技股份有限公司)确定基因型,采用CobasZ480全自动荧光定量PCR分析仪(德国罗氏诊断有限公司)进行图像扫描及数据分析。
1.2.2.2 血小板聚集功能检测
入选患者于双联抗血小板治疗5 d后清晨抽取静脉血4 ml,加入枸橼酸抗凝管中。采用电阻抗法检测血小板聚集功能,仪器为Chrono-log Model 700血小板聚集分析仪(美国Chrono-log公司)。
1.2.3 PCI方法
入选患者于急诊PCI术前嚼服阿司匹林300 mg和氯吡格雷600 mg或替格瑞洛180 mg;择期PCI术前累计负荷量阿司匹林300 mg和氯吡格雷300 mg或替格瑞洛180 mg。经动脉鞘管给予普通肝素70~100 U/kg,维持活化凝血时间在250~350 s(使用替罗非班者,活化凝血时间保持在200~250 s)。术中干预相关动脉,并由术者根据冠状动脉病变特点决定血栓抽吸导管、血小板膜糖蛋白Ⅱb/Ⅲa受体拮抗剂(替罗非班)的使用和置入支架的种类、型号和数量。冠状动脉造影和介入治疗结果由2名经验丰富的冠状动脉介入医师及1名放射科医师共同进行定量分析。
1.2.4 冠状动脉病变程度判断
根据1975年美国心脏学会冠状动脉病变程度分类标准进行评价,冠状动脉的主要4支动脉为左主干、前降支、回旋支和右冠状动脉,左冠状动脉至少4个体位投照,右冠状动脉至少2个体位投照,造影示冠状动脉狭窄≥50%,诊断为冠状动脉狭窄。根据上述动脉受累数量,可分为单支、双支、三支病变,其中左主干病变视为双支病变。
1.2.5 PCI术后药物治疗
双联抗血小板治疗方案:患者PCI术后根据自身的血小板基因代谢型和临床特征(包括年龄、体质量、缺血风险、出血风险、糖尿病、卒中/短暂性脑缺血发作或颅内出血史、活动性出血、贫血、慢性肾病等),与医生协商、自愿采用阿司匹林联合氯吡格雷标准剂量(75 mg,1次/d)或氯吡格雷加量(100 mg,1次/d)或替格瑞洛(90 mg,2次/d)双联抗血小板治疗1年;对于携带CYP2C19功能缺陷基因型患者,医生更推荐新型P2Y12抑制剂。
其他药物治疗:低分子肝素抗凝治疗7 d,同时应用他汀类药物、β受体阻滞剂、血管紧张素转换酶抑制剂/血管紧张素Ⅱ受体拮抗剂、钙离子拮抗剂、质子泵抑制剂(有禁忌证者除外),视患者具体情况决定硝酸酯制剂、利尿剂和血管活性药等的应用,并积极处理高血压和糖尿病等合并症。
1.2.6 相关定义及诊断标准
ACS类型:①ST段抬高型心肌梗死。心肌肌钙蛋白>99%正常参考值上限(upper limit of normal,ULN)或者肌酸激酶同工酶MB>99%ULN,心电图表现为ST段弓背向上抬高,并伴有下列情况之一或以上者:持续缺血性胸痛;超声心动图显示节段性室壁活动异常;冠状动脉造影异常。②非ST段抬高型心肌梗死。心肌肌钙蛋白>99%ULN或者肌酸激酶同工酶MB>99%ULN,并伴有下列情况之一或以上者:持续缺血性胸痛;心电图表现为新发的ST段压低或T波低平、倒置;超声心动图显示节段性室壁活动异常;冠状动脉造影异常。③不稳定性心绞痛。心肌肌钙蛋白阴性,缺血性胸痛;心电图表现为一过性ST段压低或T波低平、倒置,少见ST段抬高(变异性心绞痛)[9]。
MACE主要包括再次血运重建、再发心肌梗死、主要出血(心肌梗死溶栓治疗分级标准指颅内出血或临床可见出血,伴血红蛋白浓度下降≥50 g/L)、卒中、心源性死亡、全因死亡等。
1.3 统计学方法
采用SPSS17.0统计学软件处理数据。符合正态分布的计量资料以均值±标准差(Mean±SD)表示,两组间比较采用独立样本t检验;符合偏态分布的计量资料以 M(Q1,Q3)表示,两组间比较采用Mann-Whitney U检验。计数资料以例(%)表示,无序分类资料组间比较采用χ2检验;双向有序多分类资料组间比较采用线性关联χ2检验;回归分析采用二分类Logistic回归分析,自变量为有序多分类变量时,进一步将其变换成哑变量处理。采用双侧检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 A、B组中不同亚组间临床资料比较
由表1可知,A组中MACE亚组的血小板体积、糖化血红蛋白(HbA1c)值、空腹血糖值、血肌酐浓度和左心室舒张末期内径均明显高于无MACE亚组,差异均具有统计学意义(均P<0.05);而B组中MACE亚组的低密度脂蛋白浓度和射血分数均低于无MACE亚组,左心室舒张末期内径高于无MACE亚组,差异均具有统计学意义(均 P<0.05);A、B 组中两亚组间其余临床资料比较,差异均无统计学意义(均 P>0.05)。
2.2 A、B组中不同亚组间冠状动脉病变及介入情况比较
由表2可知,A组中MACE亚组的单支血管病变比例及左主干血管病变进行介入干预血运重建的比例明显低于无MACE亚组(均P<0.05);而B组中MACE亚组三支血管病变比例及术中使用Ⅱb/Ⅲa受体拮抗剂替罗非班的比例明显高于无MACE亚组,双支血管病变比例低于无MACE亚组(均P<0.05);A、B组中两亚组间其余介入情况比较,差异均无统计学意义(均 P>0.05)。
2.3 A、B组中不同亚组间药物治疗方案比较
由表3可知,A组中MACE亚组替格瑞洛的使用比例明显低于无MACE亚组,而氯吡格雷加量(100 mg/d)及氯吡格雷标准剂量(75 mg/d)的使用比例明显高于无MACE亚组(均P<0.001);B组中两亚组间使用替格瑞洛及氯吡格雷的比例比较,差异均无统计学意义(均P>0.05);A、B组中两亚组间其余用药比例差异均无统计学意义(均P>0.05)。
2.4 A、B组Logistic回归分析结果
根据上述A、B组中两亚组的单因素分析结果,将P<0.05的危险因素入选,再采用Backward Wald法分别对A、B组进行多元Logistic回归分析。本研究中A组的双联抗血小板治疗方案为有序多分类变量,将其设置为哑变量进行处理,指定替格瑞洛的研究对象为参照组,分别比较氯吡格雷标准剂量(75 mg/d)组和氯吡格雷加量(100 mg/d)组相对于参照组发生MACE的风险。结果见表4和表5,A组中不同的P2Y12抑制剂与MACE相关(P<0.001),以替格瑞洛作为参照,氯吡格雷标准剂量(75 mg/d)方案患者的远期MACE发生风险是其12.971倍,而氯吡格雷加量(100 mg/d)方案患者的远期MACE发生风险是其6.029倍。由此可见,携带CYP2C19功能缺陷基因的ACS患者PCI术后双联抗血小板治疗方案中替格瑞洛的远期MACE发生风险最低;B组中不同P2Y12抑制剂与MACE无明显相关性(P>0.05)。
3 讨论与结论
本研究探讨接受PCI术的中国ACS患者在CYP2C19基因导向下,选择不同的P2Y12抑制剂与其3年内MACE风险是否相关。结果显示,在B组患者中,不同的P2Y12抑制剂与远期MACE无明显相关性;但在A组患者中,不同的P2Y12抑制剂是影响其3年内MACE的独立危险因素,且3种双联抗血小板治疗方案(替格瑞洛、氯吡格雷加量及氯吡格雷标准剂量)中,新型P2Y12抑制剂替格瑞洛的远期MACE发生风险最低。
双联抗血小板治疗是ACS患者的最重要治疗策略之一。早期有多项关于血小板功能及基因检测与临床结局的研究结论尚存在争议[10-12],其原因可能与不同研究纳入患者的临床特征存在差异有关。Siller-Matula等[13]发现,对于房颤或稳定性冠心病等中低危患者,CYP2C19基因多态性与其预后无明显相关性;而PCI术后或急性心肌梗死等高危患者,CYP2C19功能缺陷基因被证实与心血管不良事件相关。另有研究人员发现,ACS患者PCI术后根据CYP2C19基因检测指导抗血小板策略是可行且安全的[4,14-15]。目前,国内外的双联抗血小板治疗指南虽不推荐常规使用血小板功能检测指导抗血小板治疗策略选择,但在《2018 ESC/EACTS心肌血运重建指南》[16]和《2019专家共识声明:经皮冠脉介入治疗中血小板功能基因检测指导P2Y12受体抑制剂治疗》[17]中,均推荐对高危血栓或出血患者行血小板功能学检测,进行个体化抗血小板治疗。目前欧
美指南的制定主要针对西方患者,而亚裔患者可能与西方患者有所不同,亚裔患者PCI术后缺血事件发生率较低,出血事件发生率较高[7-8]。东亚人群中氯吡格雷慢代谢型较多,药物反应差异性大;CYP2C19功能缺陷基因在东亚人群中所占的比例远远高于欧洲和非洲人群[18],且携带CYP2C19功能缺陷基因的患者较野生型患者的心血管事件发生率更高[8]。
一项荟萃研究结果显示,对于仅行PCI的冠心病患者,CYP2C19功能缺陷基因与其不良事件相关,且这种相关性在白种人中相对较弱,在亚裔人中相对较强;但对于未行PCI治疗的患者,CYP2C19功能缺陷基因与其不良预后无明显相关性[19]。因此,血小板功能及基因检测对于PCI术后亚裔患者的意义可能更大,但相关报道较少。

表3 两组ACS患者PCI术后药物治疗方案比较
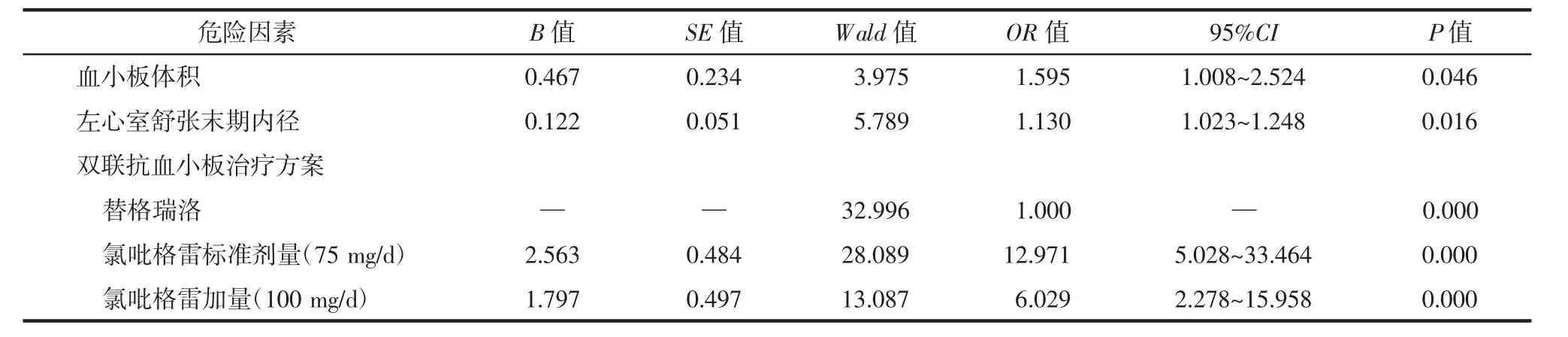
表4 携带CYP2C19功能缺陷基因患者组MACE相关因素的Logistic回归分析结果

表5 未携带CYP2C19功能缺陷基因患者组MACE相关因素的Logistic回归分析结果
关于CYP2C19基因多态性和不同P2Y12抑制剂与亚裔ACS患者远期预后是否相关,临床鲜有报道。目前国内外的相关研究主要集中于CYP2C19基因型指导组与常规治疗组的预后比较[8,20-21];中国的2项研究结果显示,基因检测指导抗血小板治疗策略可显著降低中国冠心病患者的心血管事件发生率[20-21]。而本研究不仅探讨了不同的CYP2C19基因型之间P2Y12抑制剂与远期预后的相关性有无差异,还比较了携带CYP2C19功能缺陷基因患者选取不同P2Y12抑制剂对预后的影响。本研究主要有两大发现:①在接受PCI术的未携带CYP2C19功能缺陷基因的ACS患者中,不同的P2Y12抑制剂与远期MACE无明显相关性,因此若未携带CYP2C19功能缺陷基因的患者出血风险较高、处于经济不发达地区或不能耐受新型P2Y12抑制剂,氯吡格雷是更合适的选择。POPular Genetics研究结果显示,未携带CYP2C19功能缺陷基因者选择氯吡格雷比新型P2Y12抑制剂抗血小板出血风险降低(HR=0.78,95%CI:0.61~0.98,P=0.04),1 年内 MACE 差异无统计学意义[22]。POPular Genetics研究对象为欧美ST段抬高型心肌梗死患者,而本研究的纳入对象为接受PCI治疗的中国ACS患者,故本研究结果对亚裔人群可能更有意义。②仅在携带CYP2C19功能缺陷基因患者中,不同的P2Y12抑制剂是影响其3年内MACE的独立危险因素。有文献报道,为了获得与未携带CYP2C19功能缺陷基因者氯吡格雷75 mg/d相似的血小板抑制程度,在健康志愿者中,携带1个CYP2C19功能缺陷基因者氯吡格雷需加至150 mg/d,携带2个CYP2C19功能缺陷基因者氯吡格雷需加至300 mg/d[23];在稳定性冠心病患者中,携带 1个CYP2C19功能缺陷基因者氯吡格雷需加至150~225 mg/d,而携带2个CYP2C19功能缺陷基因者氯吡格雷即使加至300 mg/d也不能拮抗其血小板高反应性[24]。但对于携带CYP2C19功能缺陷基因的亚裔ACS患者,哪种双联抗血小板治疗方案的远期预后更好,相关报道却不多。本研究比较了携带CYP2C19功能缺陷基因的中国ACS患者PCI术后,替格瑞洛、氯吡格雷加量(100 mg/d)及氯吡格雷标准剂量(75 mg/d)这3种双联抗血小板治疗方案与预后的关系,结果发现,替格瑞洛方案3年内的MACE发生风险最低,氯吡格雷100 mg/d方案的MACE发生风险是其6.029倍(OR=6.029,95%CI:2.278~15.958,P<0.001),氯吡格雷 75 mg/d 方案的MACE 发生风险是其 12.971倍(OR=12.971,95%CI:5.028~33.464,P<0.001)。因此,对于携带 CYP2C19功能缺陷基因的ACS患者,优先推荐新型P2Y12抑制剂替格瑞洛。
综上所述,血小板基因检测指导的抗血小板治疗策略有望成为实现ACS个体化治疗的一条新途径。在接受PCI治疗的ACS患者中,根据其血小板基因检测结果和临床情况选择不同的P2Y12抑制剂与其PCI术后远期MACE相关,携带CYP2C19功能缺陷基因者推荐新型P2Y12抑制剂替格瑞洛;对于未携带CYP2C19功能缺陷基因者,若出血风险较高、处于经济不发达地区或不能耐受新型P2Y12抑制剂,氯吡格雷是更合适的选择。本研究为单中心、开放性、观察性研究,纳入的病例数有限,存在一定的局限性,且CYP2C19基因多态性并非影响血小板反应的唯一因素[17,25],故仅根据CYP2C19基因变异来决策双联抗血小板治疗可能不够全面。未来可能会有更多基于CYP2C19基因分型的多中心随机对照临床试验,为抗血小板治疗策略的选择提供更多科学依据。
利益冲突所有作者均声明不存在利益冲突
