纳米银杂化的载辛伐他汀PLGA微球合成及性质研究
2020-08-21张金明刘宝会欧阳昭广贾智刘大勇
张金明 刘宝会 欧阳昭广 贾智 刘大勇
天津医科大学口腔医院300070
0 引 言
牙周炎是常见的慢性口腔疾病,是累及牙周支持组织的感染性疾病[1]。由细菌侵入造成的牙周组织损伤是造成牙龈萎缩、牙齿松动甚至脱落的主要原因,不仅影响患者的咀嚼、发音等生理功能,同时也对患者心理也产生不良影响[2]。传统牙周治疗仅能在短期内终止牙周炎的进一步发展,不能使被破坏的牙周组织完全恢复,如不定期进行牙周维护,牙周炎仍会复发[3-4]。因此,在牙周治疗的基础上,使用其他辅助疗法,如局部药物治疗等,对牙周炎患者进行牙周维护,抑制细菌增殖,甚至促进牙周组织再生,成为亟待解决的问题。
在牙周炎的药物治疗方法中,最安全且有效的方法是口腔局部缓释给药,其不仅能提升机体的药物利用度,减少全身用药带来的副反应,而且有助于长期维持血药浓度,降低用药量,提升患者的依从性[5-7]。由于口腔的特殊解剖结构、生态与生理特点,传统的口服给药或凝胶药物的局部涂抹给药均存在局限性,导致疗效较差[8-9]。为了优化局部给药方式,针对药物载体的生物材料缓释体系在口腔疾病治疗中的应用得到了广泛的研究[10]。
缓释系统(sustained release system,SRS)是控制药物在体内释放的一种材料,亦可称长效制剂或延效制剂,能通过适宜的方法延缓药物在体内的释放。SRS具有能调控药物的释放速率,长期维持有效的血药浓度;减少药物浪费及破坏;掩盖药物的不良气味;减少药物对机体组织刺激等诸多优点。大量的基础研究结果表明,聚乳酸-羟基乙酸共聚物[poly(D,L-lactic acid-co-glycolic acid)],PLGA]载 药微球是一种理想的SRS,其具有良好的生物相容性、可控的降解速率、便于工业化制备等优点,已被广泛研究和应用[11-12]。
辛伐他汀(simvastatin,SIM)可诱导成骨细胞及骨髓细胞中骨形态发生蛋白2(bone morphogenetic protein 2,BMP2)基因的表达,促进成骨细胞的分化,有利于骨组织的矿化[13-16]。纳米银粒子(Ag nanoparticles,AgNPs)由于其较强的抗菌能力,作为一种无机抗感染材料已受到广泛的关注和研究[17]。与抗生素不同,AgNPs的应用不会造成细菌耐药性,可有效避免抗生素的滥用[18]。此外,通过丝素蛋白(silk fibroin,SF)改性的载SIM的PLGA微球有较好的释放模式,其释放速率更低,释放曲线更为平缓[19]。因此,如能将SIM和AgNPs负载于PLGA微球内,并通过SF进行改性,从而制备出具有一定缓释效果的牙周炎辅助治疗联合载药SRS,有望在一定程度上抑制牙周细菌增殖,同时实现牙槽骨的修复再生。
1 材料与方法
1.1 主要材料与仪器
SF(北京圣诺泰德医疗科技有限公司公司),PLGA(美国 Sigma公司),聚乙烯醇(聚合度 500,水解度88%,中国石化集团四川维尼纶厂),SIM(江西大帝制药有限公司),壳聚糖(chitosan,CTS)(浙江金壳药业有限公司),AgNPs(长沙巴溪仪器有限公司),溴化钾(KBr)(天津市光复精细化工研究所),磷酸缓冲盐溶液(phosphate buffer saline,PBS)(索莱宝生物科技有限公司),透析袋(天津晟佰昊生物技术有限公司)。
5810R型低温高速离心机(德国Eppendorf公司),FD-1型冷冻干燥机(北京博医康实验仪器有限公司),DelsaNano型固体表面ZETA电位分析仪(美国贝克曼库尔特有限公司),Gemini 300扫描电子显微镜(德国Zeiss公司)。
1.2 方法
1.2.1 制备载SIM的PLGA微球
所使用的PLGA中,按分子质量统计的平均分子质量(重均分子质量)为10 000,DL-LA(D,L-lactic acid)与 GA(glycolic acid)的比例为 50∶50。采用乳化-溶剂挥发法制备SRS。分别称取100 mg PLGA与 5、10、15、20 mg SIM 共同溶于 10 ml的二氯甲烷;滴入50 ml体积分数为1%的聚乙烯醇溶液,800 r/min桨式搅拌2 h;在室温下待二氯甲烷完全挥发,8 000 r/min离心10 min,弃上清;去离子洗涤,并超声重分散,重复3次后,将样品冷冻干燥,并于-40℃下避光保存,从而得到具有不同SIM和PLGA质量比的载SIM的PLGA微球(SIM-PLGA微球)。
1.2.2 SF修饰的SIM-PLGA微球制备
称取10 mg SIM-PLGA微球(质量比1∶10)混于10 ml SF 溶液(1 mg/ml)中混悬 1 h,8 000 r/min下离心10 min,水洗3次;用10 ml体积分数为2%的戊二醛溶液交联1 h,8 000 r/m下离心10 min,水洗3次;加入10 ml硼氢化钠溶液(30 mmol/L)终止交联反应;30 min后,8 000 r/min离心10 min,水洗3次;将样品冻干,于-40℃下避光保存,从而得到SF修饰的SIM-PLGA微球(SF-SIM-PLGA微球)。
1.2.3 CTS吸附的SF-SIM-PLGA微球制备
取10 ml CTS乙酸水溶液(0.1 mg/ml)与10 mg SF-SIM-PLGA微球混悬30 min;8 000 r/min离心10 min,水洗3次;用10 ml体积分数为2%的戊二醛溶液交联1 h;8 000 r/min离心10 min,水洗3次;加入10 ml硼氢化钠溶液(30 mmol/L)终止交联反应;30 min后,8 000 r/min离心10 min,水洗3次;将样品冷冻干燥,并于-40℃下避光保存,从而得到CTS吸附的SF-SIM-PLGA微球(CTS-SF-SIM-PLGA微球)。
1.2.4 AgNPs杂化的CTS-SF-SIM-PLGA微球制备
重新按照1.2.3节中的步骤,将1 ml AgNPs水溶液(0.1 mg/ml)处理 CTS-SF-SIM-PLGA 微球,使AgNPs吸附于微球表面;将样品冷冻干燥,并于-40℃下避光保存,得到AgNPs杂化的CTS-SF-SIMPLGA微球(AgNPs-CTS-SF-SIM-PLGA微球)。
1.2.5 SF修饰的AgNPs-CTS-SF-SIM-PLGA微球制备
将10 mg AgNPs-CTS-SF-SIM-PLGA微球与10 ml丝素蛋白溶液(1 mg/ml)混悬 2 h;8 000 r/min 离心10 min,水洗;用10 ml体积分数为2%的戊二醛溶液交联1 h;加入10 ml硼氢化钠溶液(30 mmol/L)终止交联反应;30 min后,8000 r/min离心10 min,水洗3次;将样品冷冻干燥,并于-40℃下避光保存,得到SF修饰的AgNPs-CTS-SF-SIM-PLGA微球(SFAgNPs-CTS-SF-SIM-PLGA微球)。
1.2.6 载药微球的形态观察
将冻干的微球粉末分散在去离子水中制成混悬液,然后滴落至预先处理过的硅片上自然晾干,喷金后于扫描电子显微镜(scanning electron microscope,SEM)下观察,并分析能量色散X射线谱(energy dispersive spectroscopy,EDS)。
1.2.7 Zeta电位的测定
称取10 mg各载药微球,制备载药微球分散液各1 ml,稀释40倍后,放入Zeta电位测试仪中,测量3次。将结果取平均值,制作Zeta电位图。
1.2.8 傅里叶变换红外光谱表征
称取适量冻干的 SIM、SF、PLGA微球、SIMPLGA微球,SF-SIM-PLGA微球,分别与200 mg KBr粉末混合压片,用傅里叶变换红外光谱仪测定各样品的红外光谱图。

图1 聚乳酸-羟基乙酸共聚物(PLGA)微球扫描电镜图像与微球直径分布
1.2.9 载药微球的体外释放
精密称量4 mg的SIM-PLGA微球,置于经超纯水浸泡煮沸处理过的透析袋中,将透析袋两端扎紧;将透析袋悬置于盛有40 ml无水乙醇/PBS(体积比 1∶4)的缓释液中(pH 6.8);于 37℃下 100 r/min恒速振荡,并分别于 0.5、1、2、4、8、12、24 h 和 3、5、7、10、14 d时,取样4 ml;取样时立即补加相同量的释放介质,并在波长238 nm处测定试样的紫外吸光度,计算累积释放量。
1.3 统计学方法
采用SPSS22.0统计学软件处理数据,微球直径数据取3次测量的平均值,表面Zeta电位数据以均值±标准差(Mean±SD)表示。
2 结果
2.1 SIM-PLGA载药微球的表面形貌
采用单一乳化溶剂挥发法成功制备出PLGA微球。如图1A所示,所制备的PLGA微球呈直径大小不一的球形,表面上有凹坑。使用Nano Measure软件对SEM图像中的微球直径进行测量。结果表明,PLGA 微球直径在 4.2~16.4 μm,平均直径为9.7 μm,绝大多数 PLGA 微球的直径在 6.6~13.1 μm,如图1B所示。
具有不同SIM和PLGA质量比的SIM-PLGA微球的SIM图像如图2所示。基于SEM图像的微球直径测量结果表明,不同SIM-PLGA微球的直径范围为6.8~10.7 μm。所有SIM-PLGA微球外形均呈规则的球形,且大小不一。当SIM和PLGA的质量比为5∶100时,微球表面较为光滑,部分微球表面分布有凹坑(图2A);当SIM和PLGA的质量比为10∶100时,所有微球表面均匀分布有细小凹痕,使微球表面显示出较粗糙的形貌,部分微球表面分布有浅凹坑(图2B);当SIM和PLGA的质量比为 15∶100时,大多数微球表面分布有凹坑,微球表面形貌与质量比为 5∶100时较相似(图 2C);当 SIM 和 PLGA的质量比为20∶100时,所有微球表面均有紧密分布的凹坑,同时在微球表面可见大量SIM的晶体沉积(图2D)。
上述结果表明,随着SIM质量分数的升高,SIM-PLGA微球的形状未出现明显的改变,均呈规则的球形,且其表面呈凹坑状外观。综合考虑微球的直径分布和微球表面形貌,选取SIM和PLGA质量比为10∶100的SIM-PLGA微球进行后续研究。

图2 具有不同载辛伐他汀(SIM)与聚乳酸-羟基乙酸共聚物(PLGA)质量比的载药微球的扫描电镜图像

图3 表面改性后的的载辛伐他汀(SIM)的聚乳酸-羟基乙酸共聚物(PLGA)微球的扫描电镜图像
2.2 表面修饰后的SIM-PLGA载药微球的表面形貌
CTS-SF-SIM-PLGA和AgNPs-CTS-SF-SIM-PLGA微球的SEM图像如图3所示。可见,通过AgNPs杂化处理后,CTS-SF-SIM-PLGA微球的表面凹坑数量较少,且微球表面更粗糙。
2.3 SIM-PLGA载药微球的傅里叶变换红外光谱
图4中显示了SIM、PLGA微球、SIM-PLGA微球、SF、SF-SIM-PLGA微球的傅里叶变换红外光谱。结果显示,SF-SIM-PLGA微球在1 626 cm-1处出现峰值,其由丝素酰胺Ⅰ区的振动模式引起的,表明SF成功地对SIM-PLGA微球进行了修饰。
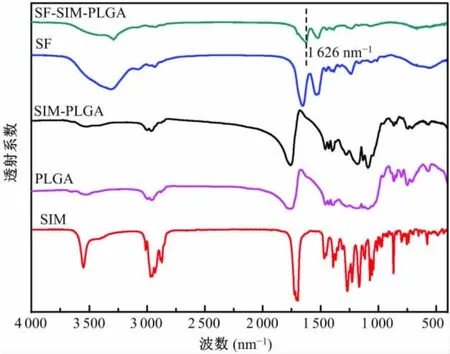
图4 载药微球与其成分的傅里叶变换红外光谱
2.4 EDS分析结果
各种PLGA载药微球的能谱分析结果如图5所示,其中SIM-PLGA微球的EDS谱线中可观察到氮元素(N)峰,CTS-SF-SIM-PLGA微球的EDS谱线中可观察到钠元素(Na)峰(图5C),AgNPs-CTS-SFSIM-PLGA微球的谱线中可观察到Ag峰(图5D)。EDS结果表明,SF、CTS和AgNPs纳米银已成功吸附在SIM-PLGA微球表面。

图5 载药微球的能谱分析图
2.5 载药微球表面Zeta电位
结果显示,SIM-PLGA微球的表面Zeta电位为(-30.3±1.31)mV;在 SF 表面改性后,SF-SIM-PLGA微球的表面电位Zeta电位为(-23.1±0.69)mV,仍为稳定状态;而继续经CTS修饰后,CTS-SF-SIM-PLGA微球的表面Zeta电位为(+12.62±2.52)mV,转变为正电且较为稳定;再通过AgNPs杂化后,AgNPs-CTS-SF-SIM-PLGA微球的表面Zeta电位为(-23.03±0.65)mV,说明AgNPs已成功负载于微球表面;最后再次通过SF丝素蛋白改性后,SF-AgNPs-CTS-SF-SIMPLGA 微球的表面 Zeta电位为(-25.4±0.70)mV,表明整个体系处于较为稳定的状态。(图6)
2.6 载药微球的体外释放
SF-AgNPs-CTS-SF-SIM-PLGA微球和SF-SIMPLGA微球的体外释放曲线如图7所示。结果表明,SF-SIM-PLGA微球的初始释放率为31.26%,其12 h内SIM的累计释放量为40.96%,并于24 h达到平稳状态,此时的累计释放量为44.75%;SF-AgNPs-CTS-SF-SIM-PLGA微球的初始释放率为23.68%,其12 h内SIM的累计释放量为28.45%,并于24 h达到平稳状态,此时的累计释放量为30.76%。由此可知,采用无机杂化材料修饰的载药微球具有更好的缓释特性。
3 讨论与结论
生物材料表面改性可从3个方面进行,即表面形貌改善、生物学性质改善、化学修饰[20-21]。因此,本研究中从不同角度对SIM-PLGA微球进行表面改性,并研究其性能。EDS结果表明,SF、CTS和AgNPs可成功吸附在SIM-PLGA微球表面。表面Zeta电位结果表明,修饰后的SRS处于稳定的状态。在本研究中,CTS与AgNPs通过正负电吸附作用相结合,修饰了经SF包覆的SIM-PLGA微球。CTS具有优异的生物相容性、抗菌性和促进创口愈合的性能,是一种最理想的抗菌材料[22-23]。AgNPs有良好的抗菌效果,且不会产生耐药性,作为替代抗生素的新型抗菌剂已在口腔疾病治疗中得到广泛研究[24-25]。将生物相容性极佳的CTS与抗菌性能极强的AgNPs相复合,有望制得兼具强效抗菌与低生物毒性的新材料。
载药微球的体外释放结果表明,SF-AgNPs-CTSSF-SIM-PLGA微球和SF-SIM-PLGA微球的初始释放速率均较快,且未发现明显的突释现象,在释放初期其释放的药物主要为包载于PLGA微球表面凹坑内的SIM。此外,由于释放介质中乙醇的存在,其会产生PLGA微球溶胀作用,也可能使载药微球的初始释放速率较快[26-28]。此后,载药微球内部药物的释放速率随PLGA微球的不断降解得到缓慢释放,并逐渐达到平稳释放状态,此时降解产物乙酸会逐渐增加,体系中的pH值逐渐降低[29],离子数量增加,而离子能催化PLGA的降解。随着PLGA降解的不断进行,其也在进行自催化降解[30]。此外,SFAgNPs-CTS-SF-SIM-PLGA微球的缓释效果明显优于未经无机材料杂化的SF-SIM-PLGA微球,原因是SIM-PLGA微球经包覆后,SIM释放到外界只需要通过丝素蛋白形成的孔隙,而AgNPs杂化并用SF修饰后,SIM 释放则需要经过 SF、CTS、AgNPs,以及最外层的SF,因此释放速率相对较慢。
在疾病治疗过程中,采用局部缓释给药系统,可以长期保持药物的有效浓度,从而提高临床治疗水平。与传统给药方式相比,SRS具有较强的优势,如长时间保持血药浓度、提高药物的生物利用度、有效避免药物的副反应等[31]。近年来,作为一种新型的SRS,各种微球被广泛研究[32]。其中,PLGA属于合成高分子材料,具有良好的生物相容性和生物可降解性,在缓释药物载体方面有着非常广泛的应用前景[33]。SF是一种天然高分子蛋白[34],具有良好的生物相容性、生物可降解性,且无毒性作用。SF表面有负电荷,并含有精氨酸、甘氨酸和天门冬氨酸组成的RGD序列,可以相互识别细胞膜上的受体整合素,这种特殊的相互作用有利于细胞的黏附和增殖[35]。PLGA与SF相结合有利于SRS发挥作用。
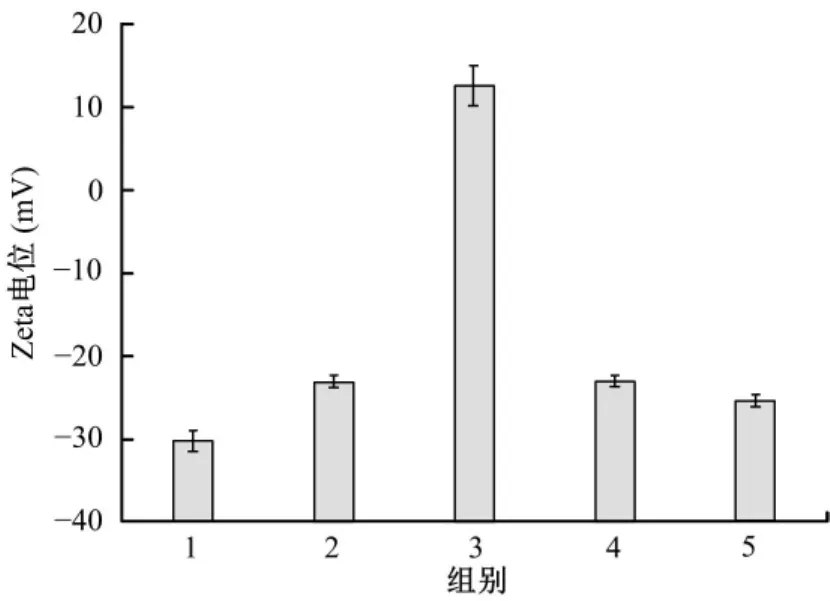
图6 载药缓释材料表面Zeta电位图
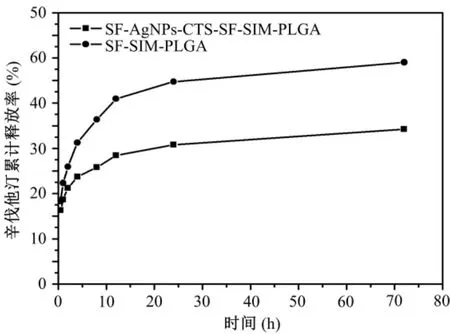
图7 载药微球的辛伐他汀体外释放曲线
针对口腔内特殊的解剖结构和微生物环境,可通过正负电吸附结合CTS与AgNPs并且修饰用SF进行表面改性处理的SIM-PLGA微球[36-37]。其中,CTS与AgNPs可使载药微球具有广谱抗菌特性。因此,AgNPs杂化的SIM-PLGA微球可同时发挥抑菌与成骨效应[38]。
本研究中采用乳化-溶剂挥发法制备SIM-PLGA微球,并依次通过SF及CTS对其表面进行改性,之后通过静电吸附将AgNPs加载到载药微球表面,最终使用SF在微球最外层进行修饰及包裹,获得SFAgNPs-CTS-SF-SIM-PLGA微球。该微球具有抑菌与成骨作用,且表现出较好的体外释放效果,可应用于口腔内的局部缓释给药,在牙周炎治疗方面具有潜在的应用价值。
利益冲突所有作者均声明不存在利益冲突
